骨肽对骨质疏松大鼠的保护作用
2020-04-07李玉娟刘骅焱罗克程东升
李玉娟, 刘骅焱, 罗克, 程东升
(1.北京理工大学 生命学院,北京 100081; 2.烟台毓璜顶医院,山东,烟台 264000)
骨质疏松症(osteoporosis,OP)是临床上较为频发的骨密度及骨质量下降,骨脆性增加,从而容易发生骨折的全身性骨病[1]. OP临床表现为骨骼疼痛、脊柱变形、易发骨折,患者行动受到影响,甚至生活不能自理[2]. 近年来,骨质疏松症的发病率逐年上升,严重影响患者的生活质量,引起广泛关注. 目前,临床上用于治疗骨质疏松的药物主要有:双膦酸盐类[3]、降钙素类[4]、雌激素[5]、甲状旁腺激素[6]等,这几类药物虽有治疗效果,但易引起患者恶心、呕吐等副作用[7-8]. 目前,从动物骨骼中提取的肽类物质因安全性高、疗效好,越来越引起研究学者的注意,有文献报导了不同类型的骨肽类药物具有调节骨代谢,促进成骨细胞增殖,形成新骨,以及调节钙、磷代谢,增加骨钙沉积等方面的疗效[9-10].
本研究所用的骨肽为新鲜牛骨提取得到的多肽类物质,为深入验证其对骨质疏松的保护作用,连续灌胃大鼠2 w维甲酸构建骨质疏松大鼠模型,通过病理学检查、股骨干重与灰重测定、骨钙磷及微量元素检测、血清与尿液生化指标检测,综合分析口服不同剂量骨肽对维甲酸导致的大鼠骨质疏松的保护作用. 骨肽的临床给药途径包括口服给药、注射给药等,使用时可根据患者实际情况进行选择. 前期研究观察了骨肽对大鼠骨折的保护作用和对大鼠骨密度的影响,均采用口服给药的方式,本研究为深入研究其保护机制,沿用了口服给药的方式.
1 实验材料
1.1 实验试剂
维甲酸(批号:205B031,北京索莱宝公司);依替膦酸二钠片(批号:160830102,北京百德康药房有限公司);蒙太骨肽(内蒙古天奇生物科技有限公司);大鼠骨碱性磷酸酶(BALP)、骨钙素(BGP)、抗酒石酸酸性磷酸酶5b(TRACP-5b)试剂盒(上海古朵生物技术公司);羟脯氨酸(HOP)试剂盒(南京建成弘大生物技术有限公司).
1.2 实验仪器
DPX骨密度仪(美国LUNAR公司);7500 ce电感耦合等离子体质谱仪(美国Agilent公司);Milli-Q超纯水系统(美国Bedford公司);酶标仪(美国BioTeK公司).
1.3 实验动物
健康雌性SD大鼠48只,SPF级,3月龄,体重(280 ±20)g,由北京大学医学部(实验动物科学部)提供,许可证号:SCXK(京)2016-0010. 实验前独适应性饲养1 w,自由进食进水.
2 实验方法
2.1 药物制备
维甲酸混悬液的制备:将700 mg维甲酸置于20 mL蒸馏水中震荡混匀(混悬液),继续加蒸馏水定容至100 mL,配制成7 mg/mL维甲酸混悬液.
依替膦酸二钠溶液的制备:将依替膦酸二钠片压碎混匀,称取适量依替膦酸二钠(EDT)粉末溶于蒸馏水中,配制成4 mg/mL依替膦酸二钠溶液.
骨肽溶液的制备:分别将12.5,25.0,50.0 g骨肽粉末置于15 mL蒸馏水中,37 ℃培养箱中震荡过夜,继续加蒸馏水定容至100 mL,配制成0.125,0.250,0.500 g/mL骨肽溶液.
2.2 骨质疏松模型构建与给药方案
3月龄健康雌性SD大鼠适应性饲养1 w后,随机分为6组:对照组、模型组、阳性药组、低骨肽组、中骨肽组、高骨肽组. 每天上午,模型组、阳性药组、低、中、高骨肽组大鼠以70 mg/kg剂量灌胃给与维甲酸混悬液,对照组大鼠灌胃给与等量蒸馏水,持续2 w;每天下午,阳性药组大鼠以40 mg/kg剂量灌胃依替膦酸二钠溶液,低、中、高骨肽组大鼠分别以1.25,2.50和5.00 g/kg剂量灌胃骨肽溶液,对照组与模型组灌胃等量蒸馏水,持续4 w.
2.3 样本采集
灌胃4 w后,将各组大鼠分别转移至代谢笼中,连续收集24 h大鼠尿液并于-20 ℃冻存. 次日,用戊巴比妥以6 mg/kg的量对大鼠进行腹腔注射,待大鼠麻醉后,剪开大鼠胸腔,从心尖部进针,穿刺进左心室,缓慢抽血,4 ℃静置过夜后3 000 r/s离心10 min取血清,-20 ℃分装冻存. 心脏穿刺取血后,剪开大鼠腿部皮肤,依次取大鼠左右两侧股骨,去除软组织后,右股骨固定于组织固定液中,4 ℃保存;左股骨包裹于用生理盐水浸湿的纱布,-80 ℃冻存.
2.4 病理学检查
骨密度检测:将各组大鼠完整股骨踝向下置于骨密度仪测试平台上,用探头扫描全部股骨,记录所得骨密度值.
HE染色病理切片观察:将固定于组织固定液中的各组大鼠右侧股骨用磷酸盐缓冲液(pH 7.2)漂洗,放于pH 7.4的4.13% EDTA-2Na溶液中4 ℃脱钙30 d. 然后将右侧后肢股骨上1/3端沿正中矢状面剖开,石蜡包埋切片,HE染色,显微镜下观察骨小梁面积与数量.
2.5 股骨干重与骨灰重测定
将去除软组织的大鼠左股骨用生理盐水冲去骨髓,在环流热空气高热箱中120 ℃烘干1 h,先应用固体物理密度仪自动测量体积,然后以三氯甲烷和甲醇(2∶1)混合液脱脂72 h,再120 ℃烘干6 h,测量其干重;随后置于马福炉中600 ℃灰化6 h,测量其灰重,干重与灰重结果均以g/cm3表示.
2.6 骨钙磷质量分数测定
配制10 μg/mL含Ca/P的混合标准贮备溶液,标准溶液系列由标准贮备液逐级稀释配得,介质为5% Merk级硝酸. 以5% Merk级硝酸为介质配制10 μg/mL铑、铼标准溶液,并稀释至1 μg/mL,作为内标溶液. 调谐溶液为10 ng/mL的锂、钴、钇、铈、铊混合标准溶液(2%硝酸介质).
称取各只大鼠股骨样本约0.05 g,用5% Merk级硝酸定重至50 mL PET塑料瓶中混匀,同时设定空白组. 在优化实验条件下,选择同位素43Ca,31P,对样品消解液进行分析测试.
ICP-MS仪器全自动调谐给出仪器的工作参数,满足灵敏度、背景、氧化物、双电荷、稳定性要求等各项指标. 调谐后的仪器参数设置如表1所示.

表1 ICP-MS操作参数Tab.1 Operation parameter of ICP-MS
2.7 血清中BALP、BGP、TRACP-5b质量分数检测
将-20 ℃保存的各组大鼠血清置于冰上逐渐融化,分别使用相应的ELISA试剂盒检测血清中BALP、BGP、TRACP-5b的质量分数. 根据试剂盒说明书,应用双抗体夹心法,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加TMB底物显色,并在酸的作用下转化成最终的黄色. 颜色的深浅和样本中的待测物含量呈正相关. 用酶标仪在450 nm波长下测定吸光度(OD值),通过标准曲线计算样品中待测物质浓度.
2.8 尿液中HOP浓度测定
将-20 ℃保存的各组大鼠尿液置于冰上逐渐融化,使用羟脯氨酸试剂盒检测尿液中的羟脯氨酸浓度. 根据试剂盒说明书,测定步骤包括碱水解、调PH至6.0~6.8左右、氧化剂氧化、二甲氨基苯甲醛显色,使用酶标仪在550 nm波长下测定吸光度(OD值),最后根据OD值计算待测尿液样本中的羟脯氨酸浓度.
3 数据处理
采用 SPSS statistics17.0 数据处理软件进行数据的统计分析. 上述所有试验结果采用均数±标准差(Mean±SD)表示,进行t检验分析显著性,当p<0.05认为差异有统计学意义.
4 实验结果
4.1 双能X线骨密度仪检测
骨密度测定结果如图1,与对照组相比,模型组大鼠股骨的骨密度明显降低(p<0.05);依替膦酸二钠溶液,1.25,2.50,5.00 g/kg剂量骨肽溶液灌胃后与模型组大鼠相比,骨密度升高,且随着骨肽剂量的升高,各组大鼠股骨的骨密度逐渐增大.
4.2 HE染色病理切片观察
HE染色结果如图2,图中红色箭头代表骨小梁,绿色箭头代表骨髓腔. 使用Image-Pro Plus软件测定各组大鼠HE染色结果图中骨小梁区域所占百分比. 对照组大鼠骨小梁所占百分比为49.8%,模型组骨小梁面积显著降低(35.8%). 低、中、高剂量骨肽和阳性药治疗后,骨小梁所占百分比分别为43.2%,44.1%,49.3%,49.4%,该结果说明大鼠骨小梁结构变得更致密,骨髓腔面积减小.
4.3 股骨干重、灰重、钙磷质量分数测定
干重、灰重、钙磷元素质量分数测定结果如表2所示. 与对照组相比,模型组大鼠股骨干重、灰重及骨钙磷质量分数明显均显著减小(p<0.01,p<0.05,p<0.01);灌胃给予2.50,5.00 g/kg骨肽溶液以及依替膦酸二钠溶液后干重、灰重及骨钙磷质量分数显著升高(p<0.05,p<0.01,p<0.01),灌胃给予1.25 g/kg骨肽溶液后,骨钙磷质量分数明显升高(p<0.01),干重与灰重有所升高,但差异不显著.

表2 股骨干重、灰重测定结果Tab.2 Results of measurement of femur dry weight and ash weight
注:与对照组比较,*p<0.05;与模型组比较,#p<0.05,##p<0.01
4.4 血液中BALP、BGP、TRACP-5b与尿液中HOP检测
大鼠血清中的BALP、BGP、TRACP-5b尿液中HOP的浓度测定结果如表3所示. 与对照组相比,模型组大鼠BALP、BGP浓度明显降低,TRACP-5b、HOP浓度明显升高. 与模型组相比,各实验组大鼠血清中的BALP、BGP浓度均有不同程度的升高,TRACP-5b浓度有不同程度的降低;依替磷酸二钠、1.25 g/kg骨肽灌胃后,大鼠尿液中的HOP浓度明显降低(p<0.01,p<0.05);2.50,5.00 g/kg骨肽灌胃后,羟脯氨酸浓度无显著变化.
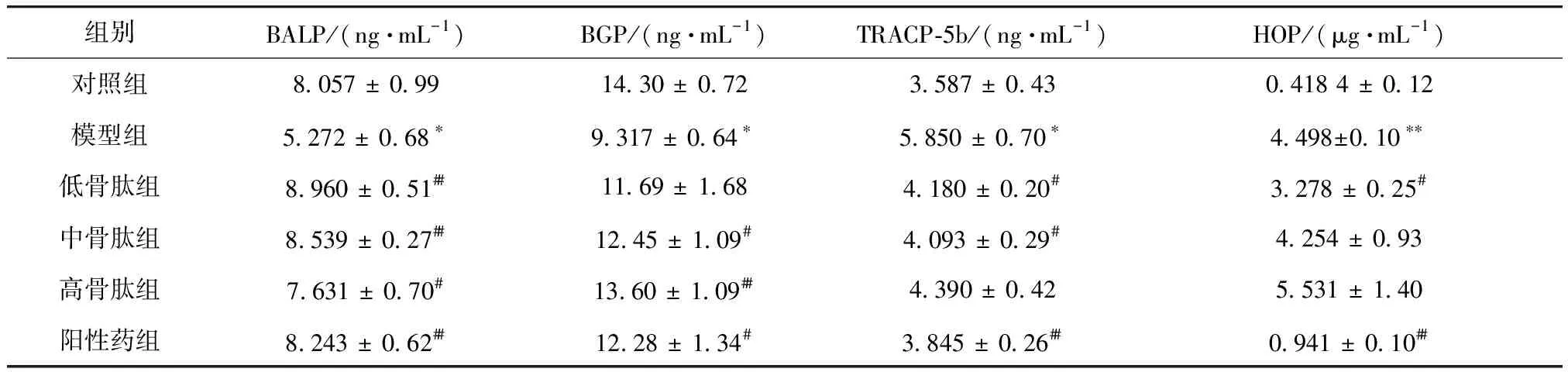
表3 血清与尿液生化指标检测结果Tab.3 Results of serum and urine biochemical index test
注:与对照组比较,*p<0.05;与模型组比较,#p<0.05,##p<0.01
5 实验讨论
牛骨肽含有多种活性肽类[10],包括酪蛋白磷酸肽等,能起到调节骨代谢及钙磷代谢、促进骨钙沉积、刺激成骨细胞增殖的作用,从而加快新骨形成,促进骨折愈合. 本研究采用的骨肽粉由内蒙古天奇生物科技有限公司提供,骨肽生产过程中所用的牛骨等原料(GB 2707)、酶解用酶制剂(GB 2760)、辅料(如蔗糖素GB 25531)等均符合国家相关标准规定. 同时对产品的感官要求、理化指标、污染物、真菌毒素、微生物限量等进行了严格的质量控制,如产品的总氮质量分数大于13.5%、肽质量分数大于80%、重金属(如铅、铬、镉等)质量分数低于0.5 mg/kg、致病菌限量符合GB29921规定等. 不同批次产品之间,对上述各类指标进行严格控制,确保了批次间的质量和稳定性. 根据前期骨肽对骨折的保护作用相关研究(数据未发表)所使用的骨肽剂量,结合骨肽在水中的最大溶解度情况,本研究最终选择1.25,2.50,5.00 g/kg 3种剂量.
骨密度(bone mineral density, BMD)是诊断骨质疏松和预测骨质疏松骨折的重要指标之一,是评价药物干预疗效的最佳定量指标,被世界卫生组织(WHO)用来作为定义骨质疏松(OP)的诊断标准[11]. 本实验结果显示:维甲酸灌胃2 w后,大鼠骨密度相较对照组显著降低,股骨骨髓腔面积增加,骨小梁密度降低. 3种剂量骨肽溶液灌胃治疗后,大鼠骨密度增加,且增加程度与骨肽剂量呈正相关,骨小梁结构更加致密,骨髓腔部分面积减小,表明骨肽溶液对维甲酸诱导的大鼠骨密度降低、骨小梁结构损伤具有明显治疗效果.
骨灰重、干重比是反映骨矿质量分数的重要指标,它能直接反映出骨内有机质与无机盐的质量分数及比例,在一定范围内,比值越低,骨无机质质量分数越低. 而Ca、P是骨无机盐中质量分数最高、功能意义最大的两个代表性元素,直接检测骨Ca、P质量分数,并结合骨灰重/干重,可以更直观和精确地评定治疗OP药物的疗效[12]. 维甲酸诱导大鼠骨质疏松使得大鼠股骨干重、灰重及骨钙磷质量分数均显著降低,2.50、5.00 g/kg骨肽溶液灌胃治疗后,与模型组相比,大鼠股骨干重、灰重及骨钙磷质量分数均显著增加,表明2.50, 5.00 g/kg的骨肽溶液具有明显增加股骨干重、灰重及骨钙磷质量分数的效果,而1.25 g/kg的骨肽溶液治疗效果不明显.
BALP是由成骨细胞分泌的一种酶,能使无机磷酸盐水解,降低其对骨盐形成的抑制作用,从而促进骨形成[13],血清BALP浓度越低,越容易发生骨质疏松;BGP主要由骨细胞和成牙质细胞合成分泌,具有抑制软骨矿化、维持正常骨矿化速率的作用,能反映骨重建和骨形成状况[14];TRACP-5b来源于破骨细胞,参与骨基质中固体钙磷矿化物的降解,是骨吸收生化指标之一[15];尿液HOP由尿羟脯氨酸胶原降解产生,血钙降低时,出现骨的溶解吸收,尿羟脯氨酸排出增多. 骨质疏松患者表现为骨形成速率减小(即BALP、BGP降低),骨吸收速率增大(即TRACP-5b、HOP升高). 本实验结果显示,维甲酸造模2w后大鼠血清BALP、BGP浓度显著降低,血清TRACP-5b、尿液HOP浓度显著升高,而1.25,2.50,5.00 g/kg骨肽溶液及依替磷酸二钠能升高血中BALP、BGP浓度,降低TRACP-5b浓度,药效作用基本与骨肽剂量呈正相关,且1.25 g/kg骨肽溶液灌胃后,HOP浓度明显下降,说明骨肽溶液具有增大骨形成速率、减小骨吸收速率的作用. 给予阳性药治疗后,大鼠血清中BLAP的含量略高于正常对照组,形成这一现象的原因可能是依替膦酸二钠的对维甲酸所致的大鼠BLAP降低具有代偿性作用,或使BLAP浓度明显升高,甚至略高于正常对照组. 阳性药组尿液中HOP浓度略高于正常对照组,表明依替膦酸二钠能明显降低大鼠尿液中HOP浓度,但未能使大鼠完全恢复至正常状态. 以上现象或与依替膦酸二钠生理活性较强有关.
综上,骨肽溶液灌胃给予骨质疏松大鼠后,不同剂量骨肽呈现出一定程度改善骨质疏松的效果,2.50 g/kg骨肽溶液对维甲酸所致大鼠骨质疏松的治疗效果最明显,其具体机制有待深入研究.
