超声-闪式联合法制备蓝莓花色苷提取物及其 体内外抗肿瘤活性评价
2020-04-02薛宏坤谭佳琪刘成海
薛宏坤,谭佳琪,刘成海,刘 钗,
(1.东北农业大学工程学院,黑龙江 哈尔滨 150030;2.东北农业大学农学院,黑龙江 哈尔滨 150030)
蓝莓中富含花色苷、多酚和黄酮等活性成分,具有较高的医学和药用价值,市场认知度高、需求量大,已被广泛用于食品、药品和保健品领域中[1]。其中花色苷属于一种水溶性的天然色素,安全无毒。研究表明花色苷具有抗氧化、抗疲劳、抗炎、抗肿瘤和增强视力等 功效[2]。因此,如何高效地从蓝莓中提取花色苷已成为当前研究的热点。
目前,对花色苷的提取主要采用传统的溶剂提取,该方法操作简单,但耗时长,溶剂消耗量大,提取效率低,无法满足当前需求[3]。随着提取技术的发展,各种先进的提取技术应运而生,如微波提取[4]、超声提取[5]、超临界提取[6]和酶法提取[7]等技术已经用于花色苷的提取中,其中微波提取具有加热速度快,效率高等特点,但由于萃取液内物料的极性不同,吸收和转化微波能的能力不同,造成萃取液温度分布不均,局部高温造成热敏性成分的降解,使之失去原有的生理活性[8]。超临界提取对提取设备要求较高,价格昂贵。酶法提取条件温和,但对pH值变化较敏感。超声提取是利用其空化效应、热效应和机械效应加速植物细胞壁破裂,降低细胞内活性成分传质阻力,提高传质系数,使细胞内的活性成分更容易从细胞中扩散到周围溶剂中,从而提高效率[9]。另一种闪式提取法也是活性成分提取最常用的方法之一,其主要原理是通过高速旋转的刀头将植物组织细化成颗粒,并通过剪切效应、负压渗滤和溶剂萃取等效应将植物细胞中的活性成分快速溶出,从而提高效率[10]。这两种方法均具有提取效率高、操作简单和过程易控制等特点,因而被广泛应用于活性成分的提取中。目前,对于两者联合使用提取蓝莓花色苷的研究还鲜见报道。关于提取后所得的花色苷的研究主要集中在对其进行分离纯化、抗氧化活性等方面。而花色苷在抗肿瘤活性方面的作用也逐渐成为当前关注的热点,但对其抗肿瘤作用机制尚无定论。
鉴于此,本研究采用超声-闪式联合提取法提取蓝莓花色苷,通过单因素试验探究超声功率、闪提转速、提取时间、料液比和乙醇体积分数对蓝莓花色苷含量的影响,并分析不同萃取条件下花色苷的萃取特性;在此基础上,通过遗传算法优化花色苷提取工艺参数;采用体内和体外实验探究花色苷提取物的抗肿瘤活性,并对其抗肿瘤作用机制进行探讨。
1 材料与方法
1.1 材料与试剂
BABL/c小鼠40 只,雌雄各半,6 周龄,体质量182 g,SPF级,由哈尔滨肿瘤医院提供,许可证号为SCXK(黑)2006008。S180小鼠腹水瘤细胞由哈尔滨肿瘤医院提供,由昆明种小鼠腹腔积液传代。
半高丛蓝莓 黑龙江省哈尔滨市东北农业大学园艺学院;无水甲醇、无水乙醇(均为分析纯) 天津 市富宇精细化工有限公司;MTT、磷酸盐缓冲溶液(phosphate buffered saline,PBS) 北京索莱宝科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO) 上海莱昂生物科技有限公司;注射用环磷酰胺 江苏恒瑞医药股份有限公司;RPMI 1640和胎牛血清 美国Gibco公司;胰蛋白酶 国药集团化学试剂有限公司;Annexin V-FITC/PI细胞凋亡与坏死检测试剂盒 碧云 天生物技术研究所;小鼠IL-12、IL-10、TNF-α酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒 上海酶联生物科技有限公司。
1.2 仪器与设备
DK-98-IIA型恒温水浴锅 天津市泰斯特仪器有限公司;LAMBDA35型紫外-可见分光光度计 美国Perkin Elmer公司;TD-50冻干机 上海浦东冷冻干燥设备有限公司;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;LN12-JHBE50T闪式提取器 北京中西远大科技有限公司;DS-3510DTH超声波清洗器 上海奥析科学仪器有限公司;超声-闪式联合提取装置为超声波清洗器与闪式提取器组合改装而成;MultiskanMk3型酶标仪、ST16R冷冻离心机 美国Thermo公司;细胞培养箱 美国Forma公司;TS100倒置荧光显微镜 日本Nikon 公司;Attune NxT流式细胞仪 赛默飞世尔科技(中国)有限公司;BSC-20超净工作台 沈阳宝创实验室设备有限公司;J-SG微量移液器 北京川布兰科技发展有限公司;HZQ-F全温振荡培养箱 哈尔滨市东联电子技术开发有限公司;PRACTUM224-1CN分析天平 德国赛多利斯仪器有限公司。
1.3 方法
1.3.1 样品前处理
实验前将冷冻的蓝莓从冰箱中取出,室温解冻3 h,打浆,将果浆置于玻璃皿中,放在-18 ℃冰箱中冷冻12 h,然后置于真空冷冻干燥机冻至24 h,取出用植物粉粹机将其粉碎,过40 目筛,制成果粉,避光密封在4 ℃冰箱中保存备用。
1.3.2 蓝莓花色苷提取物(blueberry anthocyanins extracts,BAE)的制备
取5 g蓝莓果粉于提取容器中,按照1∶30(g/mL)的料液比加入体积分数60%乙醇溶液将其充分溶解,然后将提取容器置于超声-闪式联合提取装置中,设定闪提转速8 000 r/min,超声功率350 W,提取时间10 min,提取结束后,将提取液置于离心机中以6 000 r/min离心15 min,将上清液收集于玻璃瓶中。向滤渣中再加入体积分数60%乙醇溶液,操作同上,提取2 次,合并3 次提取液。将其用旋转蒸发仪于40 ℃减压蒸发浓缩至浸膏质量不再发生变化,所得浸膏即为BAE,最后将其置于离心管中,放入4 ℃冰箱备用。
1.3.3 花色苷含量的测定
采用pH示差法测定不同提取条件下提取物中花色苷含量,参考于泽源等[11]的方法并略做改动。取1 mL样品(BAE),分别加入9 mL pH 1.0氯化钾缓冲液和9 mL pH 4.5乙酸钠缓冲液,将其充分混合,避光静止1 h,分别在520 nm和700 nm波长处测定其吸光度,分别依据式(1)和式(2)计算提取物中花色苷含量和纯度。
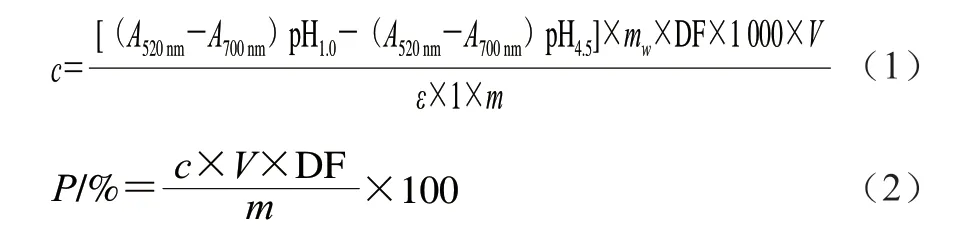
式中:c为提取物中花色苷含量/(mg/g);A为样品提取液的吸光度;DF为稀释倍数;mw为矢车菊素-3-葡萄糖苷的相对分子质量(449.2);ε为矢车菊素-3-葡萄糖苷的消光系数(26 900);m为蓝莓果粉的质量/g;V为萃取液体积/mL;P为蓝莓花色苷纯度/%。
1.3.4 单因素试验
在预实验的基础上,选择乙醇为提取溶剂,超声-闪式联合法为提取蓝莓花色苷的方法,操作同1.3.2节。以5 g蓝莓粉为提取对象,对超声功率、闪提转速、提取时间、料液比和乙醇体积分数5 个因素进行单因素试验,讨论各因素对花色苷含量的影响。其中超声功率设300、350、400*、450、500 W 5 个水平;闪提转速设6 000、7 000、8 000*、9 000、10 000 r/min 5 个水平;提取时间设6、8、10*、12、14 min 5 个水平;料液比设1∶10、1∶20、1∶30*、1∶40、1∶50(g/mL)5 个水平;乙醇体积分数设40%、50%、60%*、70%、80% 5 个水平。结果均为3 次重复实验所得的平均值。*表示当考察其他因素对蓝莓花色苷含量影响时,用*标记的因素保持恒定水平。
1.3.5 响应面试验
在单因素试验结果的基础上,以超声功率(X1)、闪提转速(X2)、乙醇体积分数(X3)为自变量,以花色苷含量(Y)为响应值。根据Box-Behnken试验设计,因素与水平设计如表1所示。
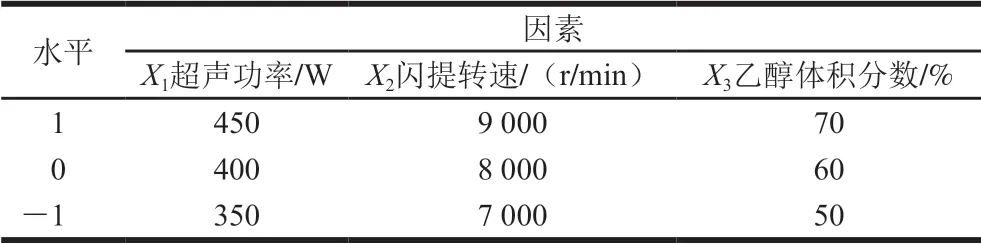
表 1 响应面试验设计因素与水平Table 1 Coded and actual levels of factors
采用响应面分析法得到的二次回归模型如式(3)所示:
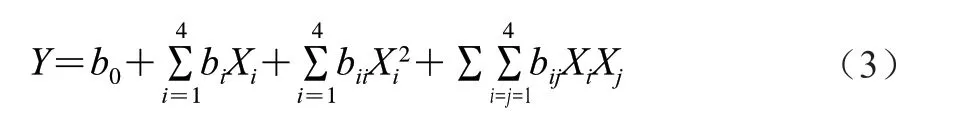
式中:b0为截距回归系数;bi为线性回归系数;bii为二次项的回归系数;bij为交互项的回归系数;Xi、Xj为自变量。
1.3.6 超声提取、闪式提取和传统溶剂提取法提取蓝莓花色苷
超声提取法条件设定为:超声功率400 W、乙醇体积分数60%、料液比1∶30(g/mL)、提取时间10 min;闪式提取法条件设定为:转速8 000 r/min、乙醇体积分数60%、料液比1∶30(g/mL)、提取时间10 min;传统溶剂提取条件设定为:乙醇体积分数60%、料液比 1∶30(g/mL)、提取时间50 min,将上述3 种提取方式得到的花色苷含量与超声-闪式联合法(超声功率400 W、转速8 000 r/min、乙醇体积分数60%、料液比 1∶30(g/mL)、提取时间10 min)进行对比,根据蓝莓花色苷含量判定提取方式的优劣。
1.3.7 遗传算法设计
在单因素结果基础上,选取超声功率、闪提转速和乙醇体积分数3 个因素为决策变量。即:

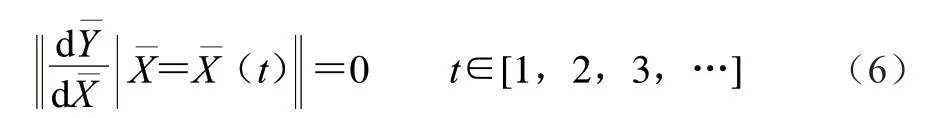
优化的约束条件:依据单因素试验结果,选择各因素水平的上下限,花色苷含量优化约束条件如下式所示:

1.3.8 BAE抗肿瘤活性体外实验
1.3.8.1 MTT法检测S180细胞的增殖
在上述最优参数组合下得到的BAE,参照刘燕琳等[12]的方法溶解于RPMI 1640培养基中,将BAE配制成质量浓度为(200、400、600、800、1 000 μg/mL)样品溶液,溶液过0.22 μm滤膜,经除菌置于-20 ℃冰箱中保存。
S180细胞培养于含有质量分数10.0%胎牛血清、质量分数1.0%青霉素/链霉素的RPMI 1640培养基中,然后置于含体积分数5% CO2和90%相对湿度的培养箱中37 ℃恒温培养。将处于对数期的S180细胞按1×105个/mL的密度分别接种于96 孔培养板,贴壁培养24 h。弃去上清液,用PBS清洗3 次,分别准确移取100 μL不同质量浓度的样品加入到每孔中,阴性对照组用等量的完全培养基取代,48 h后,弃上清液,加入100 μL 1.0 g/L MTT孵育4 h,吸出MTT,加入DMSO,摇床低速振5 min,490 nm波长处测定吸光度。依据式(8)计算BAE对S180细胞的生长抑制率:
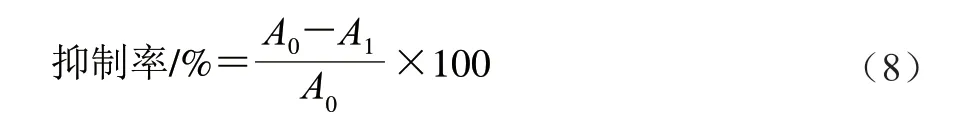
式中:A0为阴性对照组的吸光度;A1为给药组的吸光度。
1.3.8.2 流式细胞仪检测S180细胞的凋亡率及周期分布
S180细胞经过BAE样品(质量浓度0(空白组)、200、400、600、800、1 000 μg/mL),处理48 h后,使用Annexin V-FITC/PI双染色细胞凋亡检测试剂盒检测S180细胞的凋亡及周期分布。检测方法严格按照试剂盒说明进行,在倒置显微镜下观察、拍照。
1.3.9 BAE抗肿瘤活性体内实验
1.3.9.1 实验动物分组
采用随机数字法,将40 只BABL/c小鼠分为5 组,每组8 只,雌雄各半,其分组为空白对照组、模型对照组、BAE低剂量组、中剂量组和高剂量组。
1.3.9.2 造模方法
将S180瘤株接种在昆明种小鼠的腹腔中,接种7 d后,选择腹腔积液饱满的荷瘤小鼠颈椎法将其处死,抽取乳白色的腹腔积液,然后将其稀释成单细胞悬液,检测活细胞数,成活率大于95%方可接种。调整细胞浓度为1×107个/mL,在模型对照组、BAE低剂量组、中剂量组和高剂量组每只BABL/c小鼠右侧腋窝皮下接种0.2 mL,空白对照不接种,建立S180荷肉瘤小鼠模型。
1.3.9.3 给药方式
实验接种第2天开始,每天上午腹腔注射给药,其中BAE低、中、高剂量组分别给予BAE100、200、 400 mg/(kg·d),空白对照组和模型对照组给予同体积的生理盐水,给药12 d,末次给药24 h后,摘除眼球取血,离心取上清液。脱颈椎处死小鼠,剥离肿瘤,称质量,依据式(9)计算抑瘤率:

按照马新博等[13]操作方法,采用ELISA法检测S180荷瘤小鼠血清中IL-12、IL-10和TNF-α的含量。
1.4 数据处理
2 结果与分析
2.1 对比不同提取方式对蓝莓花色苷含量和纯度的影响
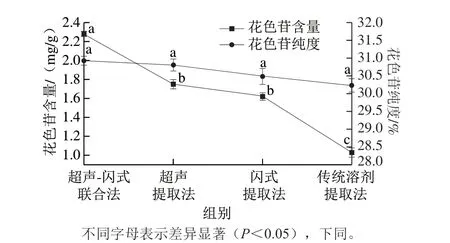
图 1 提取方式对蓝莓花色苷含量和纯度的影响Fig. 1 Effects of extraction methods on the yield and purity of anthocyanins
由图1可知,4 种提取方式(超声-闪式联合法提取、超声提取、闪式提取和传统溶剂提取法)对蓝莓花色苷纯度无显著影响(P>0.05)。4 种提取方式下蓝莓花色苷含量分别为(2.28±0.03)、(1.75±0.05)、(1.62±0.04)、(1.03±0.05)mg/g,超声-闪式联合法所得蓝莓花色苷含量较超声提取、闪式提取和传统溶剂提取法分别提高了23.25%、28.95%和54.82%,研究结果表明超声-闪式联合法更适合提取蓝莓花色苷,因此后续实验均采用该方式对蓝莓花色苷进行提取。
2.2 单因素试验结果
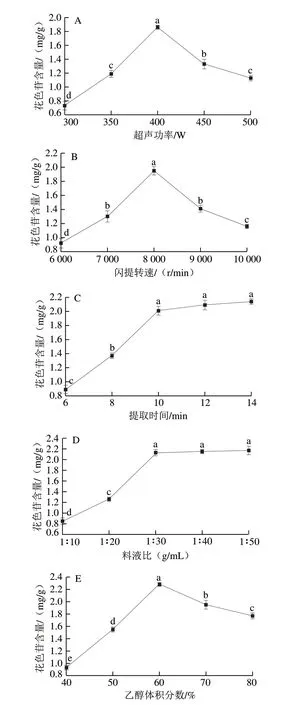
图 2 超声功率(A)、闪提转速(B)、提取时间(C)、料液比(D)和乙醇体积分数(E)对花色苷含量的影响Fig. 2 Effects of ultrasonic power (A), flash extraction speed (B), extraction time (C), solid-to-liquid ratio (D) and ethanol concentration (E) on the yield of anthocyanins
由图2A可知,当超声功率在300~400 W时,随超声功率增加花色苷含量显著增加(P<0.05)。其原因是随超声功率增加,超声所产生的机械效应和空化效应能力增强[14],造成蓝莓细胞壁被破坏,使得花色苷由内向外的传质阻力显著降低[15],因此花色苷更容易从蓝莓细胞中扩散到溶剂中,进而提高花色苷含量[16]。但当超声功率在400~500 W时,花色苷含量随超声功率增加呈现显著降低的趋势(P<0.05)。这是由于超声功率过高,产生的高强度空化作用破坏花色苷结构,使得花色苷含量显著降低[17]。故选择超声功率在350、400、450 W 3 个水平进行组合实验。
由图2B可知,当闪提转速在6 000~8 000 r/min时,随闪提转速增加花色苷含量显著增加(P<0.05),在8 000 r/min 时,花色苷含量达到最大值(1.95±0.06)mg/g。 其原因是随闪提转速增加,萃取液中所产生的剪切力显著增加,较大的剪切力能有效破坏蓝莓细胞壁[18],从而使蓝莓细胞中的花色苷更容易扩散到溶剂中,因此花色苷含量显著增加。但当闪提转速超过8 000 r/min 时,花色苷含量随闪提转速增加呈现显著降低的趋势 (P<0.05)。该研究结果与朱兴一等[19]采用闪提提取油茶枯饼中茶皂素结果一致。故选择闪提转速在7 000、8 000、9 000 r/min 3 个水平进行组合实验。
由图2C可知,提取时间在10 min前,花色苷含量随提取时间延长呈现显著增加的趋势(P<0.05),当提取时间超过10 min,花色苷含量随提取时间无显著变化 (P>0.05)。通过方差分析可知,最佳提取时间为10 min,故后续实验不再优化提取时间。高虹等[18]采用超声-闪式联合提取香菇柄麦角甾醇也有类似的结果。
由图2D可知,当料液比在1∶10~1∶30(g/mL)时,花色苷含量随溶剂用量增加而显著增加(P<0.05),在 1∶30(g/mL)时,花色苷含量达到最大值(2.13±0.06)mg/g。 其原因是随萃取液用量的增加,固液浓度梯度增加,浓度梯度作为花色苷传质驱动力,高浓度梯度有利于花色苷由内向外扩散,使得花色苷含量增加[20]。由于固液界面存在传质极限,当萃取液用量继续增加,固液界面的浓度差增幅逐渐降低[21],故花色苷含量随溶剂用量增加无显著变化(P>0.05)。通过方差分析知,最佳料液比为1∶30(g/mL),故后续实验不再优化料液比。
由图2E可知,当乙醇体积分数在40%~60%时,随乙醇体积分数增加花色苷含量显著增加(P<0.05),其原因是随乙醇体积分数增加,乙醇溶解能力增强,促进花色苷溶解,同时扩散系数增加,故花色苷含量增加[22]。在乙醇体积分数为60%时,其极性与花色苷极性相似,依据相似相容原理,此时花色苷溶解度最高,故花色苷含量取得最大值(2.28±0.03)mg/g。随后随乙醇体积分数增加花色苷含量显著降低(P<0.05),归因于高体积分数乙醇使醇溶性的杂质、色素和亲脂性强的成分溶出量增加,其成分与花色苷竞争乙醇-水分子[23-24],使得花色苷溶出量降低,进而导致花色苷含量降低。故选择乙醇体积分数在50%、60%、70% 3 个水平进行组合实验。
2.3 响应面试验结果
2.3.1 模型建立与显著性检验
Box-Behnken响应面试验方案和结果见表2。以花色苷含量(Y)为响应值,对实验所得的数据进行多元回归拟合分析,得到蓝莓花色苷含量对超声功率(X1)、闪提转速(X2)和乙醇体积分数(X3)的数学模型如式(10)所示:
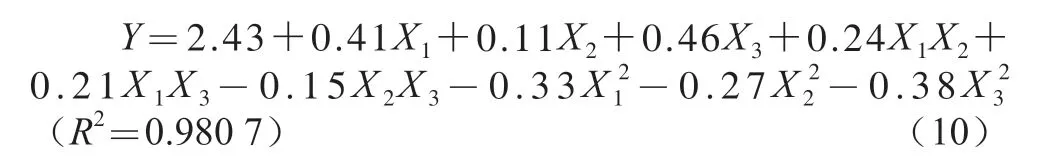
对式(10)系数进行显著性检验,结果如表3所示。
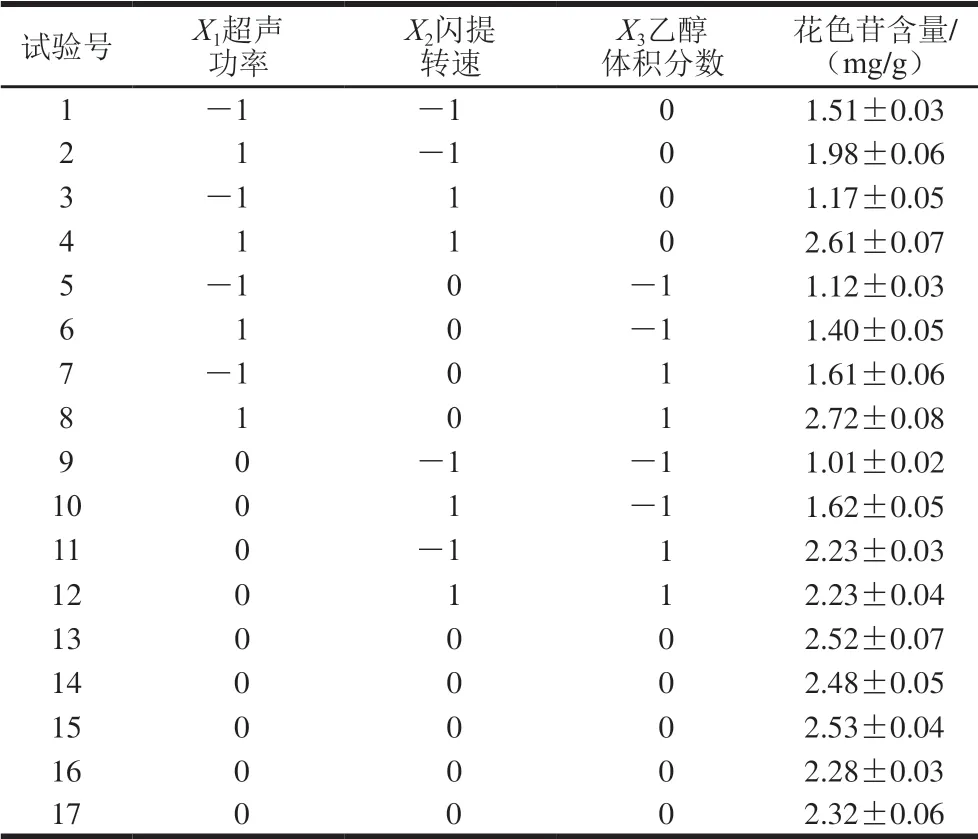
表 2 Box-Behnken响应面试验设计及结果Table 2 Box-Behnken design with experimental results
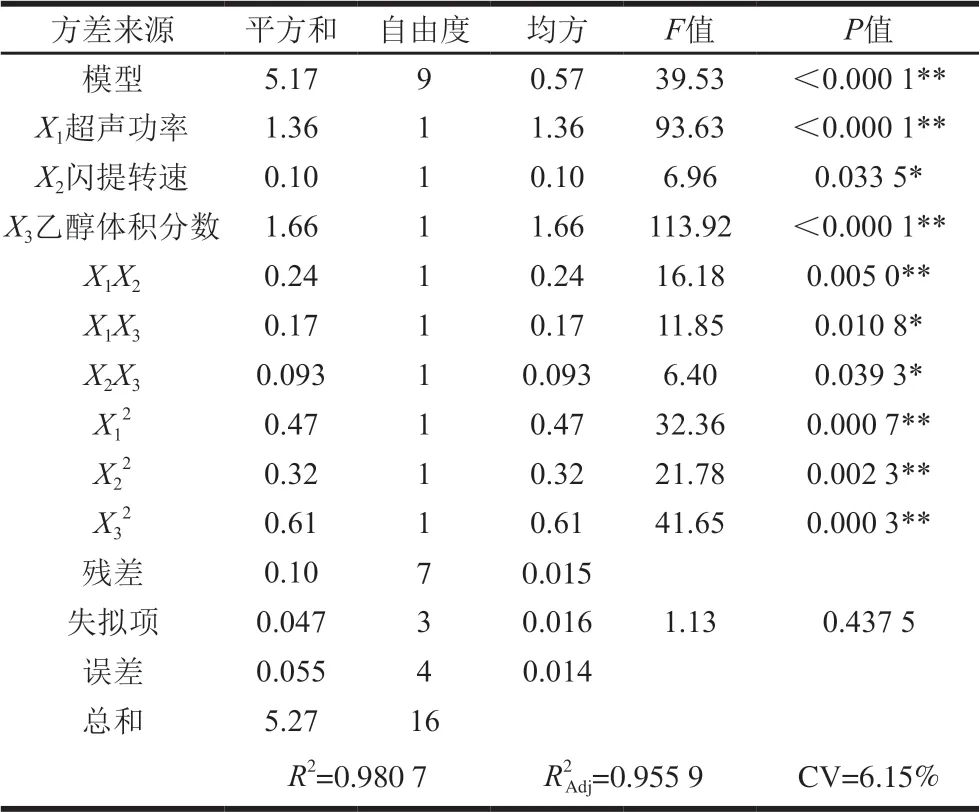
表 3 花色苷含量的回归模型方差分析Table 3 Analysis of variance of quadratic polynomial regression model
由表3可知,所得的数学模型决定系数R2=0.980 7,F=9.53,P<0.000 1,表明所得模型极显著。模型失拟项P=0.437 5>0.05,表明模型失拟项不显著,通过以上数据说明该模型对试验数据拟合充分,可靠性较好,可以较好地描述各因素与响应值的真实关系。
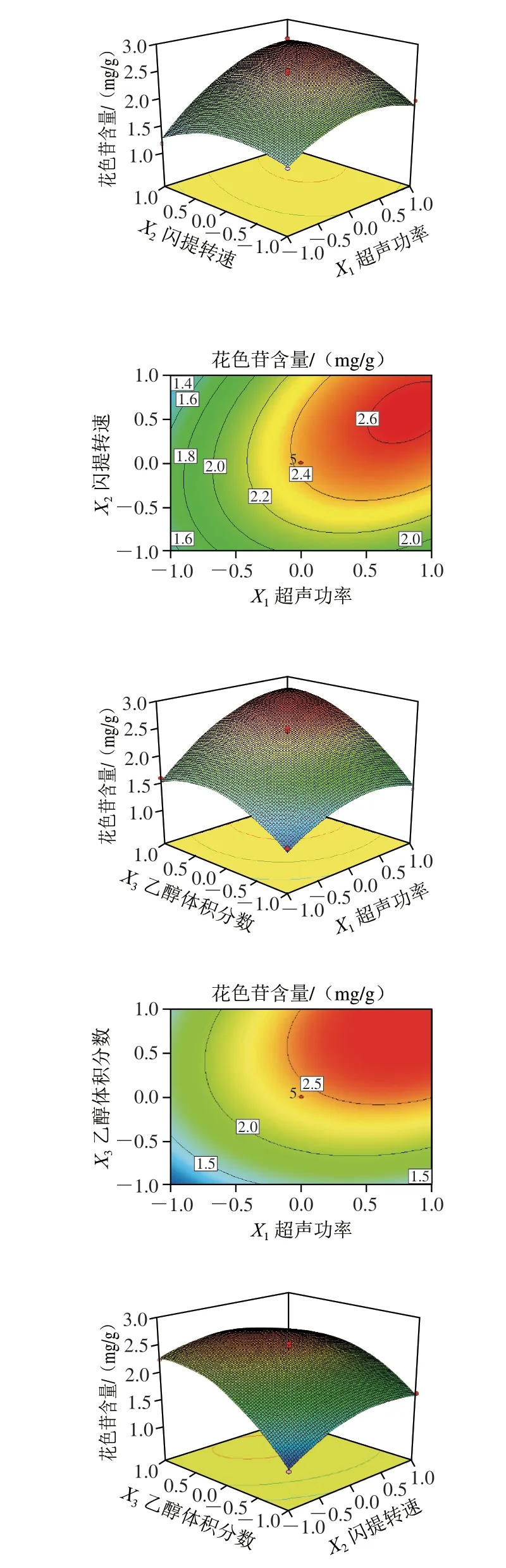
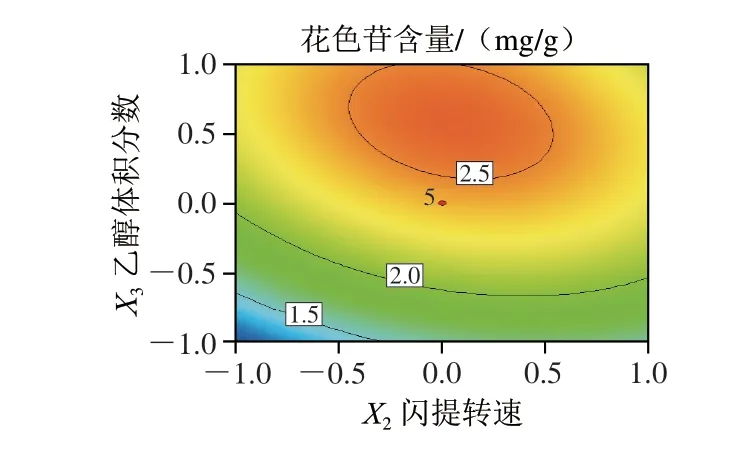
图 3 各因素交互作用的响应面和等高线图Fig. 3 Response surface and contour plots showing the interactive effects of variables on the extraction yield of anthocyanins
依据F值大小可以判断各试验因素对花色苷含量影响的程度,F值越大,表明该试验因素对提取效果的影响越显著。由表3可知,F(X1)=93.63,F(X2)=6.96, F(X3)=113.92,即各试验因素对蓝莓花色苷含量的影响顺序为乙醇体积分数>超声功率>闪提转速,且乙醇体积分数和超声功率对花色苷含量的影响达到极显著的水平。响应面的坡度陡峭程度可以反映该因素对蓝莓花色苷含量影响的强弱,响应面相对平缓,说明该因素对花色苷含量影响作用较小。等高线图的形状说明试验因素两两的交互作用是否显著,如果等高线形状是椭圆,则说明两变量的交互作用显著;若等高线形状是圆,则说明变量的交互作用不显著[25]。由图3可知,蓝莓花色苷含量均随3 个试验因素水平的增加呈现先增加后减小的趋势,存在极大值。由等高线图可以看出,3 个试验因素两两的交互作用均呈现椭圆,表明因素之间的交互作用均显著,这与方差分析的结果一致。等高线随乙醇体积分数的变化趋势高于超声功率,而超声功率的变化趋势高于闪提转速。综上可知,对蓝莓花色苷含量影响因素顺序为乙醇体积分数>超声功率>闪提转速,该结果也与方差分析的结果一致。
2.3.2 超声-闪式联合提取蓝莓花色苷的工艺参数优化
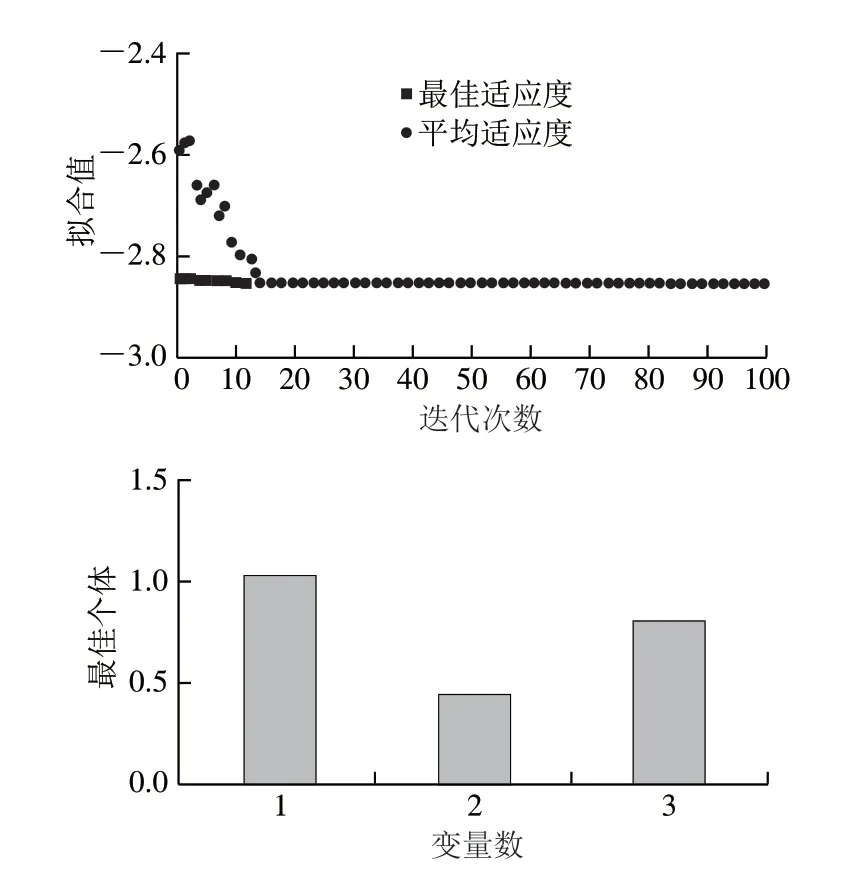
图 4 遗传算法优化结果Fig. 4 Results of optimization by genetic algorithm
遗传算法相关参数设定如下:种群大小设定为180,变异率设定为0.2,交叉率设定为0.85,最大迭代设定为100,其余参数均使用系统默认值,经Matlab 2016软件中的遗传算法优化工具箱计算得出,迭代15 次,花色苷含量取得最大值,此时超声功率(X1)、闪提转速(X2)和乙醇体积分数(X3)水平编码分别为1.00、0.44、0.81,即试验水平分别为450.0 W、8 440.0 r/min、68.1%,在此条件下,所得花色苷含量理论值为2.85 mg/g。遗传算法M文件运行结果如图4所示。
2.3.3 验证实验
通过遗传算法优化得到提取花色苷工艺参数组合为超声功率450.0 W、闪提转速8 440.0 r/min、乙醇体积分数68.1%,花色苷含量和纯度的理论值分别为2.85 mg/g和31.15%。为验证该方法的可靠性,考虑实际情况,将最佳工艺参数修正为超声功率450 W、闪提转速8 400 r/min、 乙醇体积分数6 8%,在此条件下所得花色苷含量和纯度的验证实验值分别为(2.71±0.08)mg/g和(31.79±0.53)%,两者理论值和实验值的相对误差分别为4.91%和2.05%。说明模型可以较好地模拟和预测蓝莓花色苷含量和纯度,进一步证明采用遗传算法优化蓝莓花色苷提取工艺参数可行。
2.4 不同质量浓度BAE对S180细胞体外增殖的抑制作用
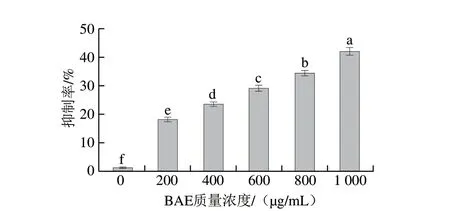
图 5 BAE对S180细胞生长抑制作用的剂量效应Fig. 5 Inhibitory effect of blueberry anthocyanin extract on growth of S180 cells
由图5可知,不同质量浓度BAE处理S180细胞48 h后,S180细胞的抑制率随BAE质量浓度增大呈现显著增加的趋势(P<0.05)。当BAE质量浓度在200 μg/mL时,对S180细胞的抑制率为(18.12±0.86)%;而当BAE质量浓度在1 000 μg/mL时,对S180细胞的抑制率为(40.05±1.33)%,后者较前者对S180细胞的抑制率提高了21.93%。结果表明BAE能显著抑制S180细胞增殖,并且BAE质量浓度越大,抑制效果越显著,表现出显著的剂量效应。
2.5 不同质量浓度BAE对S180细胞凋亡的影响
目前,大量研究证明BAE具有抗氧化和清除自由基的能力[26],对癌细胞的增殖具有显著的抑制作用,加速癌细胞的凋亡[27]。因此,本实验在MTT的基础上,进一步探究不同质量浓度BAE对癌细胞凋亡的影响。由图6可知,不同浓度BAE(200、400、600、800、1 000 μg/mL)处理48 h后,S180细胞凋亡率分别为(18.82±0.93)%、(29.75±1.33)%、(42.55±2.01)%、(52.80±1.69)%和(66.25±1.54)%,与对照组相比,凋亡率分别提高了15.47%、26.40%、39.20%、49.45%和62.90%。结果表明,花色苷提取物能促进S180细胞凋亡,且质量浓度越大,S180细胞凋亡率越高。Urias-Lugo[28]和Yeh[29]等同样研究发现花色苷提取物能显著提高癌细胞的凋亡,其作用机制是通过上调和下调相关的凋亡蛋白和凋亡因子,从而促进癌细胞凋亡。
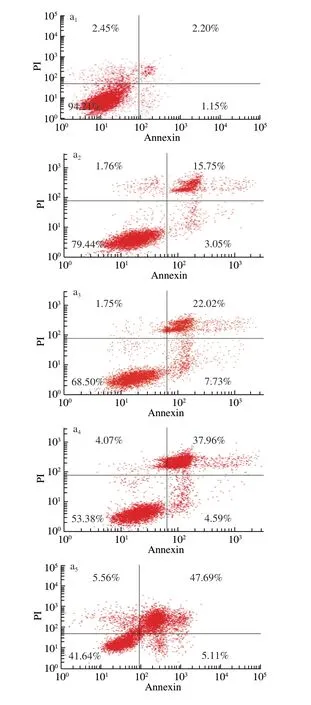
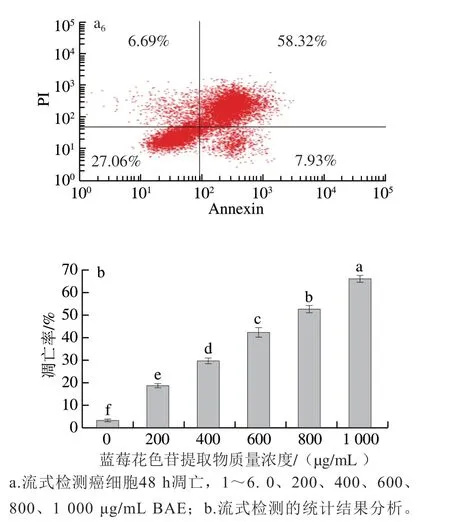
图 6 不同质量浓度BAE作用48 h后S180细胞凋亡的影响Fig. 6 Apoptosis rate of cancer cells cultured for 48 h in the presence of blueberry anthocyanin extract at different concentrations
2.6 不同质量浓度BAE对S180细胞凋亡周期的影响
S180细胞经过BAE样品(质量浓度0(空白组)、200、400、600、800、1 000 μg/mL),处理48 h后,S180细胞凋亡周期情况如图7和表4所示。
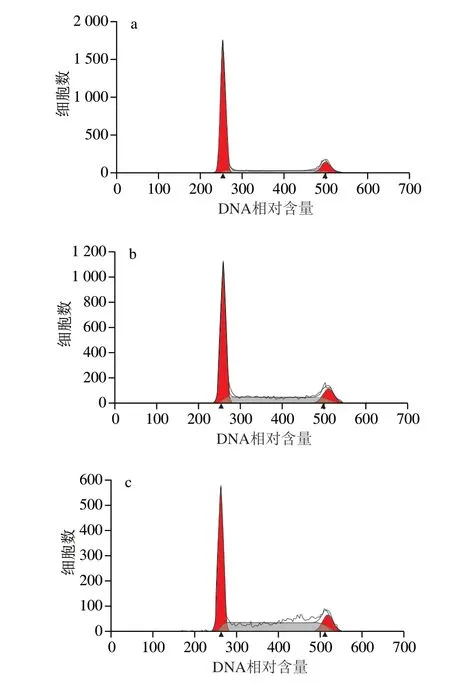
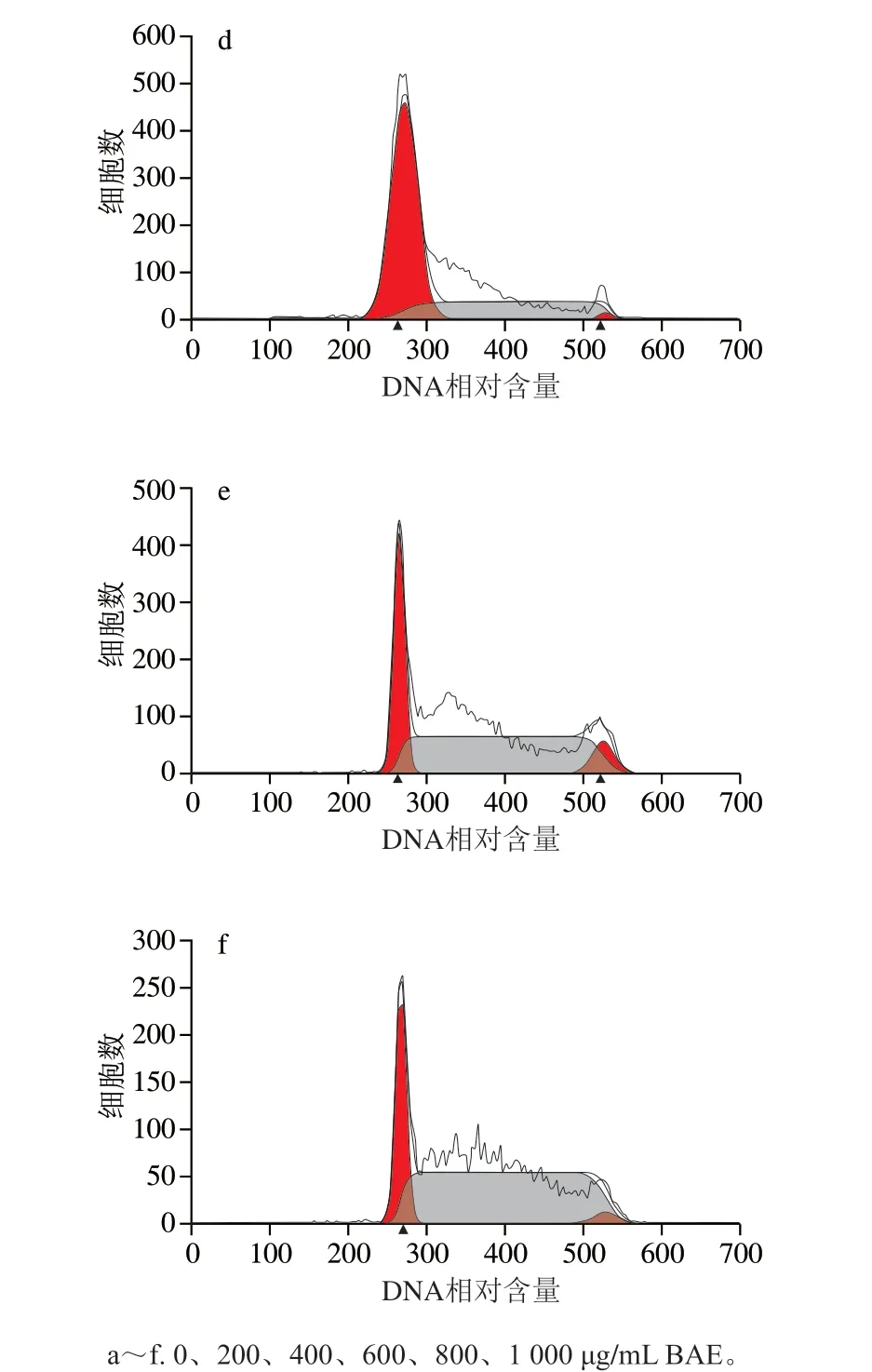
图 7 不同质量浓度花色苷提取物对S180细胞周期的影响Fig. 7 Effect of blueberry anthocyanin extract at different concentrations on cell cycle of S180 cells
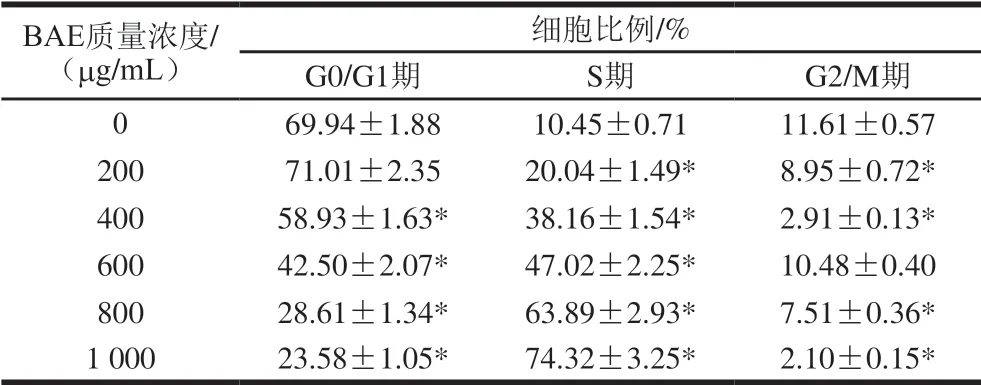
表 4 BAE作用48 h对S180细胞周期的影响Table 4 Effect of blueberry anthocyanin extract on cell cycle of S180 cells at 48 h of culture
由图7和表4可知,不同质量浓度BAE(200、400、600、800、1 000 μg/mL)作用于S180细胞48 h,与空白对照相比,S期细胞比例分别增加了9.59%、27.71%、36.57%、53.44%和63.87%,而G0/G1期细胞比例分别降低了11.01%、27.44%、41.33%和41.36%(除BAE质量浓度在200 μg/mL)。与空白对照相比,G0/G1期、S期细胞比例差异均有统计学意义(P<0.05)。结果表明花色苷提取物使S180细胞主要阻滞于S期。
2.7 各组S180荷瘤小鼠的抑制效果
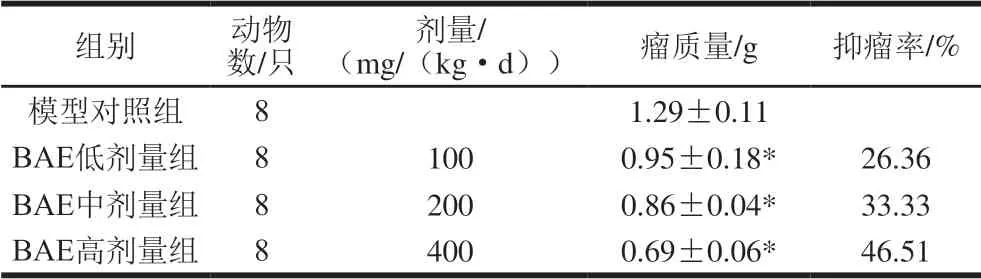
表 5 BAE对S180荷瘤小鼠瘤质量的影响Table 5 Effect of blueberry anthocyanin extract on tumor mass of sarcoma 180 tumor-bearing mice
由表5可知,与模型对照组相比,BAE低剂量组、中剂量组和高剂量组S180荷瘤小鼠瘤质量分别降低0.34、0.43、0.60 g,差异具有统计学意义(P<0.05)。表明BAE对S180荷瘤小鼠的肿瘤有抑制作用。BAE低剂量组、中剂量组和高剂量组对S180荷瘤小鼠的抑瘤率分别为26.36%、33.33%和46.51%,高剂量组对S180荷瘤小鼠的抑瘤率较中剂量组和低剂量组分别提高了13.18%和20.15%,分析数据可知BAE质量浓度越大,对S180荷瘤小鼠的抑瘤率越高,说明BAE对S180荷瘤小鼠肿瘤生长有剂量效应。
2.8 各组S180荷瘤小鼠血清中IL-12、IL-10和TNF-α的含量
CD+T细胞分为Th0、Th1和Th2三个亚群。Th1具有提高NK、LAK细胞的毒性,诱导IL-2和g干扰素的产生,促进T细胞生成,介导细胞免疫应答。Th2具有分泌IL-4、IL-6、IL-10等细胞因子,促进B细胞增殖,介导体液免疫应答。在外界刺激下,Th0可转化成Th1和Th2,Th1/Th2比值漂移与肿瘤形成相关,在恶性肿瘤中Th2占优势[30-31]。Th1介导的细胞免疫承担机体抗肿瘤免疫。IL-12促进Th0向Th1转化,是Th1细胞免疫的启动者之一,在抗肿瘤免疫中发挥正向调节作用。Th2分泌合成IL-10,它是重要的负调控因子,能有效抑制IL-12的合成。因此本实验选择Th1型细胞因子IL-12和Th2型细胞因子IL-10作为检测指标,其结果如表6所示。
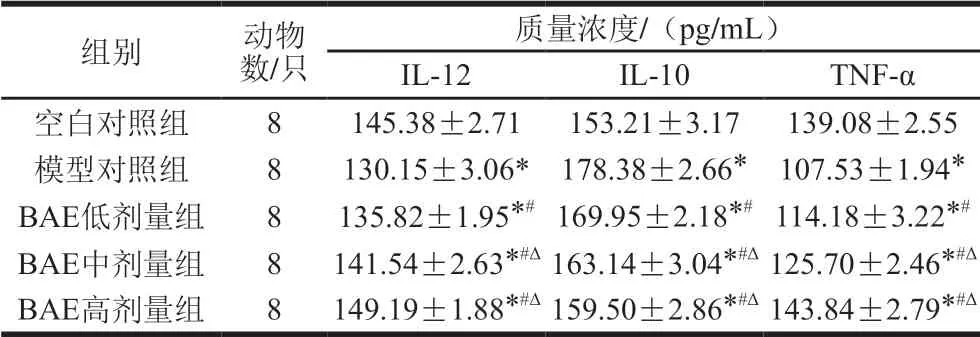
表 6 各组S180荷瘤小鼠血清中IL-12、IL-10和TNF-α的含量比较Table 6 Comparison of serum levels of IL-12, IL-10 and TNF-α in S180 tumor-bearing mice in control and treatment groups
由表6可知,模型对照组小鼠血清中IL-12含量较空白对照组显著降低(P<0.05),IL-10含量显著增加 (P<0.05),结果表明荷瘤小鼠造模成功。BAE作用荷瘤小鼠后,与模型对照组对比,BAE低剂量组、中剂量组、高剂量组小鼠血清中IL-12含量均显著升高 (P<0.05),而IL-10含量显著降低(P<0.05),且高剂量组和中剂量组在IL-12和IL-10含量变化幅度显著高于较低剂量组。分析上述数据可知,移植肿瘤后,小鼠的免疫功能受到抑制,打破了Th1/Th2的平衡,Th2占优势,而BAE作用后,IL-12含量显著增加,进一步促进Th1细胞发挥免疫调节作用,同时IL-10含量显著降低,使得Th2优势地位被打破,从而使免疫反应向Th1漂移。因此,体内的肿瘤生长被抑制。实验结果表明BAE是通过增强机体免疫功能,调节Th1/Th2漂移而发挥对肿瘤作用的抑制,且BAE质量浓度越大,抑制作用越强。
TNF-α是由巨噬细胞和单核细胞产生,对肿瘤细胞有明显的杀伤作用。由表6可知,模型对照组、BAE低剂量组和中剂量组小鼠血清中的TNF-α含量均显著低于空白对照组(P<0.05),而高剂量组显著高于空白对照组(P<0.05)。经BAE作用后,与模型对照组相比,BAE低剂量组、中剂量组和高剂量组小鼠血清中TNF-α含量均显著升高(P<0.05),且剂量越大,TNF-α含量越高。结果表明BAE具有促进S180荷瘤小鼠产生TNF-α,从而达到抑制肿瘤生长的作用。
3 结 论
本研究在单因素试验的基础上进行响应面试验,利用遗传算法优化得出超声-闪式联合提取蓝莓花色苷的工艺参数组合:提取时间10 min、料液比1∶30(g/mL)、 超声功率450 W、闪提转速8 400 r/min和乙醇体积分数6 8%,在此条件下花色苷含量和纯度分别为(2.71±0.08)mg/g和(31.79±0.53)%。通过方差分析可知,该数学模型极显著,所得的方程拟合度较高,对花色苷含量的影响主次顺序为乙醇体积分数>超声 功率>闪提转速。通过体外S180细胞实验和体内的S180荷瘤小鼠抑瘤实验进一步证实BAE具有抑制肿瘤生长的作用,其作用是通过诱导细胞凋亡和增强机体免疫抑制肿瘤生长。本研究结果为蓝莓花色苷提取和抗肿瘤药物开发提供新思路。
