重组型番鸭细小病毒JH10株的分子特征解析
2020-04-02王志仙秘清灵凌珏怡贾婧宇王钜华王建业朱国强
王志仙,秘清灵,凌珏怡,贾婧宇,鲍 芳,王 昱,王钜华,王建业,朱国强
(1.扬州大学兽医学院 江苏省动物重要疫病与人兽共患病防控协同创新中心 江苏省动物预防医学重点实验室农业农村部禽用生物制剂创制重点实验室,扬州 225009;2.扬州优邦生物药品有限公司,扬州 225008)
番鸭细小病毒(Muscovy duck parvovirus,MDPV)属于细小病毒科细小病毒亚科依赖细小病毒属,按照ICTV最新分类体系,在该属下仅列有3个种,其中一个种为雁形目依赖细小病毒,MDPV和鹅细小病毒(Goose parvovirus,GPV)均列为该种下的毒株或者变种[1]。MDPV基因组约为5100个核苷酸的单链DNA,基因组两侧翼为末端倒置重复序列(inverted terminal repeats,ITR)。MDPV和GPV享有高度相似的基因组结构,只是在ITR长度上,MDPV比GPV多出约12个碱基[2-4]。它们的基因组均包含2个阅读框(open reading frame,ORF),左侧ORF编码非结构蛋白Rep,受P9启动子调控,通过对mRNA的选择性剪切可生成Rep1以及其他几个分子量更小的Rep蛋白[5]。右侧ORF编码结构蛋白Cap,受P41启动子调控,通过对mRNA选择性剪切以及起始密码子的选择性使用,右侧ORF可生成VP1、VP2和VP3 3个结构蛋白,以约1∶1∶8的比例组成病毒衣壳[6]。
MDPV感染3周龄内雏番鸭,患病番鸭表现以腹泻、软脚和喘气为主要特征的临床症状,发病率可达27%~62%,死亡率为22%~43%,俗称番鸭“三周病”[7-8]。国内雏番鸭细小病毒病的最早报道始于1986年前后[9],此病还流行于其他番鸭养殖国家[10-12]。2010年6月,浙江金华某番鸭养殖场的7日龄雏番鸭暴发一起疑似MDPV感染的疫病,死亡率近50%,用番鸭胚从病死番鸭肝脏中分离到一株病毒,命名为JH10株。本研究中,为了明确该毒株的基因组特征,对JH10株的全基因组进行了PCR扩增和测序,并进行了重组分析,显示JH10是一株重组型的MDPV。本研究为今后深入阐明重组型MDPV的致病机理奠定了基础。
1 材料与方法
1.1 病毒与主要试剂 番鸭细小病毒JH10株由本实验室分离保存。Primestar Max高保真聚合酶、TaqDNA聚合酶、DNA ligation kit购自大连宝生物工程有限公司;凝胶回收试剂盒购自天根生物科技有限公司。
1.2 引物的设计与合成 根据GenBank已发表的MDPV YY株基因组序列(GenBank登录号:KX000918),借助Primer Premier 5.0 软件设计6对引物(表1),将基因组分成6个片段进行扩增,各片段相互重叠。引物由苏州金唯智生物科技有限公司合成。
1.3 病毒基因组提取 取400 μL JH10株番鸭胚传代至第4代的尿囊液,9600×g,离心5 min,吸取上清,加入100 μL TE缓冲液(50 mmol/L Tris,20 mmol/L EDTA,pH 8.0)混合,继续加入10% SDS和蛋白酶K至终浓度分别为1%和400 μg/mL,50℃水浴2 h。用等体积的苯酚-氯仿-异戊醇(25∶24∶1)和氯仿-异戊醇(24∶1)各抽提1遍。上清液加入2.5倍体积的无水乙醇和1/10体积醋酸钠(pH 5.2),-20℃沉淀过夜。次日20 000×g,离心20 min,去上清液,核酸沉淀用70%无水乙醇洗涤1次,20 000×g,离心5 min,去上清液。沉淀用真空离心浓缩仪离心10 min以去除残留酒精,DNA沉淀用30 μL去离子水溶解,-20℃保存备用。
1.4 PCR扩增和克隆 采用50 μL扩增体系,其中加入上下游引物各1 μL,DNA模板2 μL,Primestar Max高保真聚合酶混合物25 μL,不足部分用ddH2O补齐。PCR循环条件按照每1 kb延伸15 s,30个循环。PCR产物经核酸电泳检测后,采用凝胶回收试剂盒回收纯化各片段。用Taq酶对各片段3'末端进行加“A”反应,按照10×PCR buffer 1.2 μL,纯化片段8 μL,dNTP 1 μL,去离子水1.5 μL,Taq酶0.3 μL。反应管置于PCR仪,72℃反应10 min。加“A”后的各片段立即与pMD19-T载体相连接,转化DH5α感受态细胞,送阳性克隆至金唯智生物科技有限公司测序。采用DNAStar 5.0程序包中的SeqMan软件对测序结果进行拼接。
1.5 重组分析和遗传进化数构建 采用DNAStar 5.0程序包中的MegAlign软件和ClustalX 2.1软件对JH10株进行同源性比对分析。重组分析软件SimPlot version 3.5.1和RDP4 v.4.43用于检测JH10株可能发生的重组事件。在RDP4重组分析中,采用RDP、GENCONV、MaxChi、BootScan、SicCAN、LARD、3SEQ 7种算法检测重组事件,采用MEGA 6.01程序构建遗传进化树。

表1 用于JH10株基因组扩增的引物Table1 The primers designed for amplifying the complete genome of strain JH10
2 结果
2.1 PCR扩增和序列拼接 采用6对引物分别扩增JH10株基因组中的相应片段。结果显示,获得的各目的片段,与预期相符(图1),各片段分别为190、536、1406、1388、1437、582 bp。用SeqMan软件将各目的片段进行序列拼接,获得完整基因组序列,JH10株基因组全长5071个核苷酸,并将该毒株序列上传至GenBank,其收录号为MH807698。
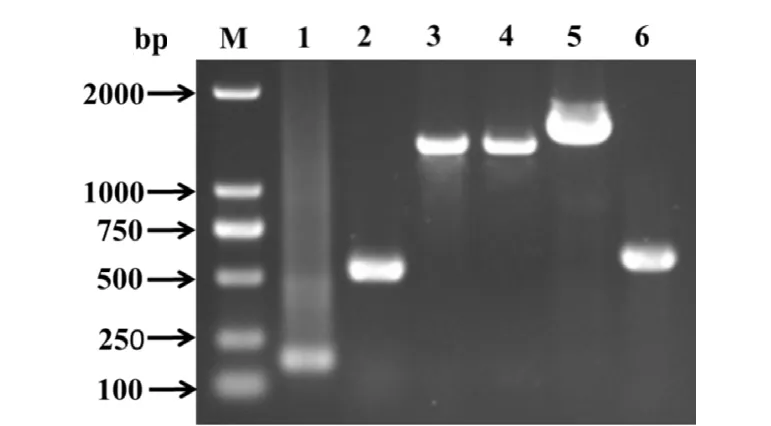
图1 PCR扩增JH10株基因组片段Fig.1 Amplification of the genomic fragments of strain JH10 by PCR
2.2 基因组ITR序列分析 经ClustalX 2.1软件对JH10株ITR序列进行比对分析,结果显示,JH10株的ITR由424个核苷酸组成,其中385个核苷酸组成回文结构,内侧的D序列则由39个核苷酸组成,与3'端ITR的D'序列反向互补,能够使整个基因组分子在更大范围内形成一个大的回文结构。JH10株ITR与经典型MDPV FM和YY株进行序列比对显示,其在茎部均存在14个核苷酸对的缺失(图2)。此外,JH10株ITR在回文区茎部还存在额外的2个核苷酸缺失,但均处在互补位置,不影响其他核苷酸互补配对形成发夹结构。JH10株ITR与经典型MDPV YY株的同源性达到97.2%,而与经典型GPV强毒株LH株ITR的同源性则为85.5%,表明JH10株ITR来自经典型MDPV。
2.3 JH10株的重组分析 经Simplot 3.5.1和RDP4软件对JH10株基因组进行了重组分析,结果显示,在其基因组的2个位置检测到明显的重组信号(图3)。一个重组信号产生在P9启动子区,重组发生在鹅胚化弱毒株SYG61v和经典型MDPV YY株之间。RDP4检测的重组断裂点起始位置在424位碱基处,终点在615位核苷酸处,结果显示JH10株P9启动子序列与SYG61v具有100%的同源性。另一个重组信号产生在VP3区域,RDP4检测的重组断裂点起始位置在基因组的3120位核苷酸处,终点在4278位核苷酸处,大致位置从VP3基因起始密码子下游约100个碱基处延伸至约基因组4300位核苷酸处,覆盖了约1100 bp的范围。重组产生在经典型MDPV YY和GPV之间,参与重组的GPV包括国内强毒株LH、匈牙利强毒株B和国内弱毒疫苗株SYG61v,但SYG61v仅是参与了较小范围内的片段重组。本研究结果表明,JH10株是重组型的MDPV,但其包括ITR和Rep基因在内的基因组主体骨架仍来自经典型MDPV,只是在P9启动子区和VP3基因内部通过重组获得了不同来源的GPV毒株序列。

图2 JH10株与经典型MDPV强毒株 FM和YY的5'ITR序列比对Fig.2 5'ITR sequence alignments between the JH10 isolate and the classical MDPV strain YY, FM

图3 JH10株基因组的重组分析Fig.3 Recombination analyses were performed against the JH10 genome
2.4 JH10株的遗传进化分析 以VP3基因重组区域的1100个核苷酸片段构建遗传进化树,结果显示,JH10株与所有8个经典的GPV病毒株处于同一个进化分支中,而所有4个MDPV经典株处于另一个分支上(图4)。以重组区域上游的VP1氨基端694个核苷酸片段和重组区域上游VP1 羧基端405个核苷酸分别构建遗传发生树,结果显示,JH10均与经典的MDPV毒株处于同一分支,而所有经典型GPV毒株处于另一个分支。结果表明,针对JH10株不同基因节段绘制的遗传进化树分析结果与前述的重组分析结果完全吻合。
3 讨论
JH10株全基因组的测序使得我们可以在全基因组水平上将之与经典的GPV和MDPV病毒株展开重组分析比较,结果显示JH10株既不同于经典型GPV,也不同于经典型MDPV,它的本质是一种重组型MDPV(rMDPV)。JH10株基因组主体骨架仍来自于经典型MDPV毒株,只是在P9启动子区和VP3基因中部通过重组获得了不同来源的GPV序列。近来,已有不同时期的MDPV分离株先后被鉴定为重组型MDPV[13-14],因此我们可以推测这一类型毒株在我国番鸭群中流行已有多年,对番鸭养殖业持续造成危害。
JH10株结构蛋白基因和P9启动子区域整合了GPV强毒株和弱毒株的相应序列,结构蛋白基因的重组可以使重组病毒获得不同于经典型MDPV毒株的抗原性,以经典型MDPV弱毒疫苗株免疫过的雏番鸭对rMDPV仍旧易感。rMDPV最为特征性的标志是结构蛋白基因发生重组的同时也伴随了P9启动子的重组。P9启动子的上游即是5' ITR,ITR上分布着多个转录因子结合位点[2],下游即为Rep蛋白表达框,rMDPV毒株与经典型MDPV毒株在这两部分的序列高度同源。因此,从基因适配性角度考量,rMDPV毒株采用经典型MDPV的P9启动子序列才更为合理,但事实却是重组病毒的P9启动子序列来自于GPV疫苗株SYG61v,而不是经典型MDPV毒株或者GPV强毒株的P9启动子序列。SYG61v毒株是一种鹅胚适应的弱毒疫苗株,该毒株的亲本强毒株为我国著名的兽医学家方定一[15]于1961年所分离,SYG61v弱毒株制成的活疫苗在我国广泛用于防治小鹅瘟[3,16]。鉴于rMDPV毒株对雏番鸭具有较高的致死率,因此,深入揭示一个相对弱化的P9启动子在rMDPV毒力增强中发挥的作用具有重要意义。
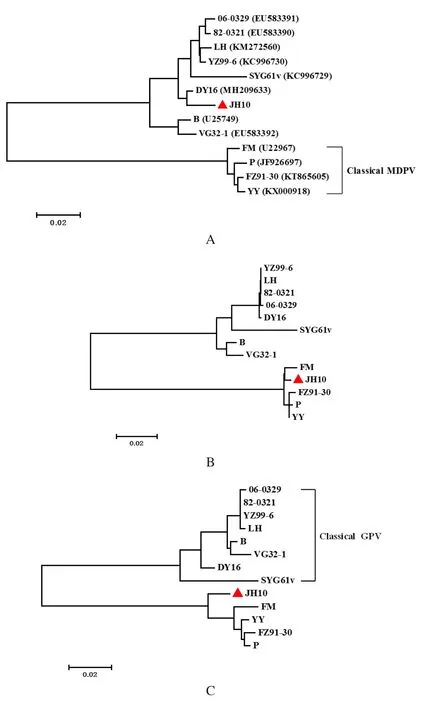
图4 JH10株与12个经典GPV和MDPV病毒株基于VP1基因构建的遗传进化树(括弧中为各毒株的GenBank基因登陆号)Fig.4 The phylogenetic trees constructed based on the different DNA fragments of the VP1 gene of strain JH10 and twelve classical MDPV and GPV strains (GenBank accession numbers are in parentheses)
