姜黄素抑制马立克氏病病毒在CEF细胞中的复制
2020-04-02乔丹丹秦爱建
冯 春 ,杨 帆 ,乔丹丹 ,秦爱建 ,3,钱 琨 ,3
(1.扬州大学 教育部禽类预防医学重点实验室,扬州 225009;2.扬州大学 江苏省动物预防医学重点实验室,扬州 225009;3.江苏高校动物重要疫病与人兽共患病防控协同创新中心,扬州 225009)
马立克氏病(Marek's disease,MD)是由α疱疹病毒科马立克氏病病毒(Marek's disease virus,MDV)感染引起的恶性T细胞淋巴瘤,导致家禽严重的免疫抑制,给家禽业造成了严重的经济损失[1]。目前MD的防控主要是疫苗免疫,常用的疫苗包括血清I型弱毒疫苗CVI988、814株,Ⅱ型疫苗SB-1以及Ⅲ型疫苗HVT[2]。研究表明临床使用的MDV疫苗能保护机体不发生急性恶性肿瘤,但并未能阻止体内病毒的复制和释放。在疫苗选择压力下,MDV毒力不断进化,近年来有免疫鸡群暴发MD的报导[3],提示MDV有突破现有疫苗保护的趋势。因此,在研发更加有效疫苗的基础上,寻求有效抗病毒药物也是一种控制疾病发生、发展的途径。
中草药源远流长,其提取物中含大量生物活性物质,部分提取物或代谢产物具有广谱的抗病毒作用和多种免疫调节功能,无药物残留,目前得到国内外研究人员的广泛关注[4]。姜黄素(Curcumin,Cur)是一种橙色晶体状粉末,为酸性多酚类化合物,从姜黄的根茎中提取得到。化学式为C21H20O6(3-甲氧基-4-羟基-苯基-1,6-庚二烯-3,5-二酮),不仅具有二酮类结构,也具有多酚类结构。姜黄素结构的特殊性和稀有性决定了其抗病毒的化学药理作用[5]。Du等[5]发现姜黄素通过阻碍病毒脱衣壳以及病毒介导的细胞融合现象抑制猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)内化进入MARC-145细胞;Bryan等[6]发现姜黄素可以抑制寨卡病毒(Zika virus,ZIKV)和基孔肯尼雅病毒(Chikungunya virus,CHIKV)等囊膜病毒吸附到细胞表面从而抑制病毒感染;Zhu等[7]发现姜黄素可以抑制牛Ⅰ型疱疹病毒BoHV-1进入MDBK细胞;Kutluay等[8]发现姜黄素可以抑制单纯疱疹病毒的早期即刻(Herpes simplex virus immediate-early,HSV-IE)基因的表达影响病毒复制。然而,姜黄素对家禽病毒病的疗效还鲜有报道。
本研究旨在探究姜黄素对MDV超强毒株RB-1B在鸡胚成纤维细胞(chick embryo fibroblast cell,CEF)中复制产生的影响,为防控MD有效抗病毒药物的研发提供依据。
1 材料和方法
1.1 生物材料和试剂 鸡胚成纤维细胞(CEF)由9~10日龄的SPF鸡胚制得;MDV超强毒株RB-1B由本实验室保存;胎牛血清(fetal bovine serum,FBS)和DMEM均购自GIBCO公司;姜黄素购自SIGMA公司;针对血清I型MDV糖蛋白gB的单抗BA4由本实验室制备并保存;内参抗体α-Tubulin购自SIGMA公司;细胞裂解液RIPA buffer购自康为世纪公司;CCK-8溶液、BCA蛋白定量试剂盒购自上海碧云天生物技术有限公司;FITC标记的山羊抗鼠二抗、HRP标记的羊抗鼠二抗均购自Jackson公司;HRP化学发光底物液购自Bio-Rad公司;总RNA提取试剂盒购自Axygen公司;PrimerScriptTMRT reagent kit with gDNA Eraser(Perfect for Real Time)反转录试剂盒以及SYBR荧光染料购自TaKaRa公司;其他试剂均为国产分析纯。
1.2 细胞毒性实验 姜黄素溶于DMSO中,配置贮存浓度为20 mmol/L,于-20℃保存备用。药物细胞毒性检测按照CCK-8说明书操作,简述如下:姜黄素用含1%FBS的DMEM稀释至5、10、20、25、40、80 μmol/L。将不同浓度的姜黄素加入到细胞孔内,每个浓度设置4个重复,分别设置DMSO以及各个浓度有药物无细胞的对照,37℃细胞培养箱培养96 h,每孔加入10 μL的CCK-8溶液,37℃继续孵育0.5~4 h,酶标仪于D450处读取数值。细胞存活率=
1.3 姜黄素对MDV复制的影响 为观察不同浓度姜黄素对MDV复制的影响,选择0、2、20 μmol/L浓度姜黄素在12孔细胞板中预处理细胞4 h,然后每孔加入200 pfu病毒与不同浓度姜黄素的混合物,设置4个重复,并使用含姜黄素的维持液培养96 h后,收集细胞分别用于RNA提取、蛋白裂解、间接免疫荧光和病毒噬斑计数。为观察姜黄素作用的时间效应,参考文献[9],将姜黄素(20 μmol/L)与MDV的混合物共同加入到CEF细胞中,设置仅接种MDV不加姜黄素组作为对照组,分别于接种MDV后24、48、72、96 h测定MDV基因表达水平和增殖情况。
1.4 不同时间点加入姜黄素对MDV复制的影响 根据参考文献[4, 9-10],确定姜黄素抑制MDV复制作用的时间点,分别在MDV感染前中后的不同时间段加入姜黄素(20 μmol/L)处理CEF细胞,实验方案简述如下,第一种方案(P1):MDV感染前4 h用姜黄素(20 μmol/L)预处理CEF细胞,PBS清洗后接种MDV,1%含FBS的DMEM于37℃培养箱培养96 h;第二种方案(P2):姜黄素和MDV的混合物共同加入到CEF细胞中,吸附4 h 后PBS洗涤,加入含1%FBS的DMEM于37℃培养箱培养96 h;第三种方案(P3):MDV感染CEF细胞4 h后,使用PBS洗涤细胞并用含姜黄素和1% FBS的DMEM于37℃培养箱培养96 h;第四种方案(P1+P2+P3):细胞预处理阶段、MDV吸附感染阶段以及MDV后期复制阶段,细胞培养液中均含有20 μmol/L的姜黄素,37℃培养箱培养96 h,测定MDV滴度验证姜黄素对MDV复制不同阶段的抑制情况。
1.5 姜黄素直接对病毒感染性的影响 根据参考文献[7, 11]设计实验如下:分别将MDV与姜黄素(20 μmol/L)混合物或者MDV与DMEM混合物在37℃孵育1.5 h,然后将混合物接种至单层CEF细胞中,96 h后分别测定病毒基因表达量以及病毒增殖情况。
1.6 Western blot检测 收集细胞利用RIPA buffer裂解,并使用BCA试剂盒进行蛋白定量。采用常规方法进行SDS-PAGE、转印、5%脱脂乳封闭、一抗(gB蛋白的单克隆抗体BA4和内参α-tubulin)和二抗(HRP羊抗鼠1∶10 000)的孵育、显色等步骤,最终使用HRP增强型化学底物避光显色5 min后,于超灵敏化学发光成像系统拍照保存。
1.7 间接免疫荧光检测 MDV接种于CEF细胞96 h后,利用固定液(丙酮∶乙醇=3∶2)室温固定CEF细胞5 min,PBS洗涤后加入BA4抗体孵育60 min后,在加入二抗FITC标记的羊抗鼠孵育30 min后,于荧光显微镜下观察并拍照。
1.8 病毒噬斑计数 将含病毒的细胞悬液进行10倍梯度稀释,稀释后的10-1~10-7病毒悬液分别接种至96孔细胞板中的CEF细胞,4~5 d后对相应稀释梯度的噬斑进行计数,计算方式如下:病毒滴度(pfu/mL)=(平均每孔噬斑数×稀释倍数)/每孔接种病毒量(mL)
1.9 real-time PCR检测 病毒基因gB、Meq的表达量采用real-time PCR来检测。real-time PCR引物序列见表1。按照说明书提取RNA并取1 μg总RNA作为模板进行反转录获得cDNA,cDNA加入体系之前用ddH2O进行10倍稀释。反应体系为:SYBR Premix ExTaqTMⅡ 10 μL、ROX Reference Dye Ⅱ 0.4 μL、上下游引物(10 μmol/L)各0.8 μL、ddH2O 6 μL、模板2 μL,共20 μL。real-time PCR在ABI 7500系统中进行反应,反应程序为95℃预变性30 s;95℃变性5 s,60℃退火34 s,共40个循环。以18s为内参基因对样本进行归一化处理,每个样本3个重复。
1.10 数据结果统计分析 利用GraphPad (version 5.0)软件对结果进行Student-t分析,以确定不同组别之间是否具有显著性差异。*代表p<0.05,表现为差异显著具有统计学意义;**代表p<0.01,表现为差异极显著具有统计学意义;***代表P<0.001,表现为差异极极显著具有统计学意义。
2 结果
2.1 姜黄素对CEF的细胞毒性实验 不同浓度的姜黄素与CEF细胞孵育96 h后,每孔加入CCK-8检测姜黄素对CEF细胞毒性。结果显示,姜黄素在浓度20 μmol/L内对CEF细胞的生长没有明显影响,甚至在浓度10 μmol/L时还具有一定的促生长作用,结果见图1。因此,本研究最终选择2、20 μmol/L作为工作浓度进行后续实验。
2.2 姜黄素明显抑制MDV的复制和增值 在MDV接种前4 h以及接种后96 h整个过程中加入姜黄素显著抑制了MDVMeq、gB基因的表达,并且抑制作用呈现剂量依赖性,见图2A、2B;噬斑计数结果显示姜黄素在浓度20 μmol/L时,显著降低MDV在CEF细胞中的增殖,结果见图2C;间接免疫荧光和Western blot结果也显示,姜黄素明显抑制了MDV的复制和增殖,见图2D、2E。
2.3 姜黄素抑制MDV复制具有时间依赖性 在MDV接种CEF细胞后96 h内,不同时间点收集CEF细胞进行检测。加姜黄素组与不加姜黄素对照组MDVgB基因的表达量以及噬斑数量差异显著,具有统计学意义,见图3。结果表明,姜黄素在CEF细胞中抑制MDV的复制,且具有时间依赖性。

表1 real-time PCR引物序列Table 1 Primer sequences of real-time PCR

图1 姜黄素在CEF细胞中的毒性检测Fig.1 The cytotoxic effect of curcumin on CEF cells
2.4 姜黄素抑制MDV复制过程解析 为了解姜黄素抑制病毒感染的作用环节,设计四种不同的加药方案,均于接种MDV后96 h收取细胞,用于MDV RNA提取及MDV滴度测定。结果表明,在MDV与CEF细胞吸附阶段和MDV复制后期阶段加入姜黄素均能抑制MDV复制,以细胞吸附阶段作用最显著,而药物预处理CEF细胞时,对MDV复制没有影响,见图4。
2.5 姜黄素直接影响MDV的感染性 为了进一步明确姜黄素对MDV感染性作用,将MDV与姜黄素在37℃共同孵育1.5 h后感染CEF细胞,real-time PCR和噬斑计数结果均显示,姜黄素处理组的MDV基因表达和增殖均明显减弱,表明姜黄素能直接影响MDV的感染性,结果如图5所示。
2.6 姜黄素对病毒感染细胞中细胞因子表达的影响 有文献[12-14]报道,姜黄素可以通过调节细胞信号因子影响病毒的增殖。本研究检测了经姜黄素处理与未处理的被MDV感染CEF细胞中的IL-1β、IL-6、IFN-β、ISG12-2、Mx-1和OASL等细胞因子的表达水平,见图6。结果显示,姜黄素处理组中,IFN-β、ISG12-2 、Mx-1和OASL表达水平明显下降,而炎症相关因子IL-1β和IL-6表达水平显著升高。
3 讨论
马立克氏病是MDV引起的一种高度接触传染性、淋巴组织增生性疾病。该病是第一个可以用疫苗预防的肿瘤性疾病[2]。但到目前为止,还没有有效的方法可以完全治疗患病鸡,阻止病毒在体内复制,只能通过疫苗免疫鸡群来控制疾病的发生。药物抗病毒可减少病毒在体内的复制,有研究表明,姜黄素通过不同机制发挥抗病毒活性,这些机制涉及直接抑制病毒复制机制或抑制病毒复制所必需的细胞信号传导途径。已有研究表明,姜黄素通过影响CHIKV、ZIKV、HCV、BoHV-1和PRRSV囊膜的流动性干扰病毒囊膜与细胞膜的融合抑制病毒感染[5-7,15],或者通过影响细胞内泛素-蛋白酶体系统或细胞凋亡过程来降低JEV、DENV、CVB3的感染性[12-14],此外姜黄素还通过显著影响HSV-1 IE基因表达,从而降低了HSV-1启动裂解感染周期的能力[8]。

图2 姜黄素抑制病毒基因表达呈剂量依赖性Fig.2 Inhibition of virus replication by Curcumin in a dose dependent manner

图3 姜黄素抑制病毒复制呈时间依赖性Fig.3 Inhibition of virus replication by Curcumin in a time dependent manner
本研究结果表明,姜黄素能剂量和时间依赖性的抑制MDV基因的表达以及病毒在CEF中的增殖,这些结果与以往姜黄素抑制BoHV-1、ZIKV和CHIKV在细胞中的复制结果相似[6-7],提示姜黄素对家禽病毒也同样具有一定的抑制作用。不同时间点加入姜黄素的实验结果显示,病毒在细胞吸附阶段抑制作用最显著,这或许和药物能直接影响MDV的感染性有关,这与姜黄素抑制IAV病毒吸附和后期复制阶段类似[16]。由于MDV感染细胞的受体及传播机制还未明晰,所以姜黄素抑制病毒吸附细胞的具体机制有待日后深入研究。以往报道显示姜黄素可以通过调控细胞信号因子的表达而影响病毒的复制,例如姜黄素通过调控宿主细胞泛素蛋白体系统及细胞凋亡相关过程影响病毒复制[12-14]。本研究选择了部分抗病毒细胞因子及炎症相关因子进行realtime PCR检测,结果发现常见的抗病毒因子都随着病毒复制减少而降低,而炎症因子IL-6和IL-1β却相反,显著升高,提示炎症反应可能与MDV的复制相关,其中具体机制还有待进一步研究。在动物体内实验中,姜黄素口服给药在小鼠模型中显示出抗癌作用;在巨细胞病毒感染的模型中,姜黄素胃内给药显着降低了病毒DNA载量和IgM水平,表明姜黄素在体内抗病毒活性的潜力[17];未来姜黄素通过口服给药预防体内MDV的剂量及安全性还需要今后的体内实验数据来确定。本研究结果表明,姜黄素以剂量和时间依赖的方式抑制MDV在CEF细胞中的复制。此外,姜黄素还通过直接影响病毒的感染性来抑制MDV在CEF细胞中的复制。这些结果提示,中药姜黄素具有开发为抗MDV有效药物的潜力。

图4 姜黄素在不同加入时间抑制 MDV增殖的作用Fig.4 Antiviral effects of Curcumin on MDV proliferation at different time points
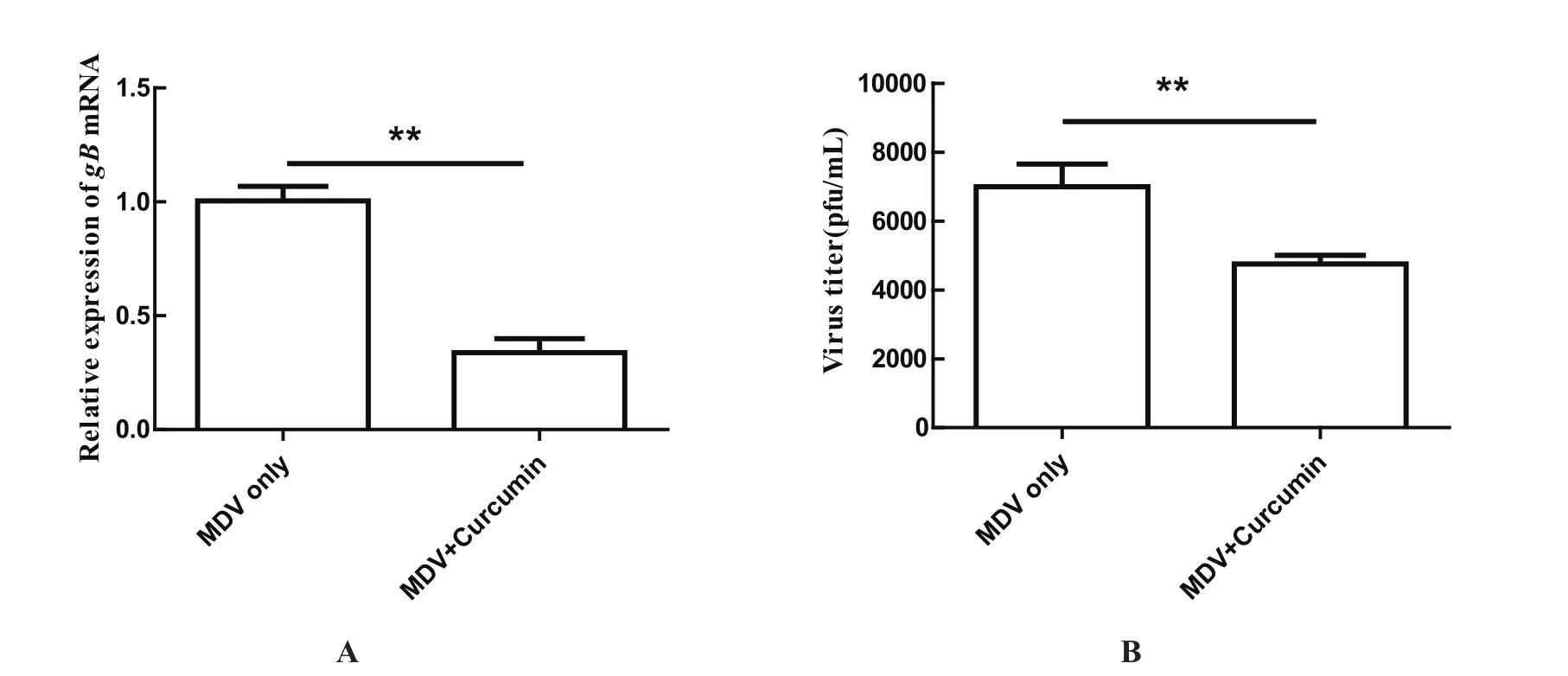
图5 姜黄素直接影响MDV的感染性Fig. 5 Direct virucidal activity of Curcumin on MDV

图6 姜黄素对MDV感染CEF细胞因子表达影响Fig.6 Effects of Curcumin on cytokines expression in MDV infected cells
