肾小管上皮细胞来源包含miroRNA-21的微囊泡在心肌肥大中的作用
2020-04-01赵家璧
狄 佳,周 华,李 旻,徐 婷,赵家璧
(1.苏州大学第三附属医院 a.肾内科;b.免疫风湿科,江苏 常州 213003;2.南京医科大学附属常州第二人民医院 病理科,江苏 常州 213003)
心血管疾病(CVD)是影响慢性肾脏病(CKD)患者预后最重要的因素,CKD患者心血管死亡率约占总死亡率的44%[1],其中慢性心力衰竭为主要死因之一。心肌重构是心力衰竭发展的一个重要病理机制,目前认为抑制心肌重构是预防和治疗心力衰竭的重要手段,而心肌细胞肥大是心力衰竭发展过程中心肌重构的一个主要特征之一。microRNA(miRNA)在心肌细胞肥大和凋亡中起到重要作用,其参与心力衰竭的发生和发展,并可作为心力衰竭诊断、治疗和预后的新的生物学标志物及治疗靶点[2]。近年来,一种被称为“MVs”的细胞间通讯方式越来越受到研究者们的关注[3-4]。2007年,Valadi发现微囊泡(MVs)中含有miRNA。生理和病理状态下最基础的细胞代谢、增殖、分化和死亡等过程均受到miRNA 的调节[5],包含miRNA的MVs作为重要的细胞间通讯的分子平台在疾病中的作用正成为新的研究前沿。心肌肥大时心脏miRNA-21(miR-21)表达明显增多,有趣的是这些miR-21大多数包含于MVs,存在于心脏周围液体中[6],这些MVs的来源尚不清楚。本文观察了肾小管上皮细胞产生的包含miR-21的微囊泡在心肌肥大中的作用,从而可能拓展对疾病机制的理解,并可能为CKD导致心力衰竭的治疗新策略提供实验依据和理论基础。
1 材料与方法
1.1细胞培养和处理 大鼠近端肾小管上皮细胞系(NRK-52E)和大鼠心肌细胞(H9C2)购自美国模式菌种收集中心(ATCC)。用含10%胎牛血清(FBS,Life Technology)和100 U/ml青-链霉素(Life Technology)的D-MEM/F12培养液(Life Technology),在37 ℃,含5% CO2的孵箱中培养细胞。细胞贴壁生长达到80%融合后,换成无血清的 D-MEM/F12 培养液孵育过夜(16 h),再次更换无血清的 D-MEM/F12培养液,加入重组人转化生长因子β1(rhTGF-β1,R&D Systems)处理,换成无血清的D-MEM/F12培养液再孵育细胞 48h,收集此无血清、无rhTGF-β1的D-MEM/F12培养液,依次在4℃的环境下离心:300 g×5 min,1 200 g×20 min,10 000 g×30 min,弃沉淀,再经用滤器浓缩上清液,即为条件培养液。对照培养液的收集方法同上,但细胞未经TGF-β1处理。受体心肌细胞用条件培养液处理并检测。用脂质体转染试剂(Life Technology)将miR-21的抑制物或阴性对照(均购自Qiagen)转染H9C2。依据试剂说明书,细胞50%融合后,换成无抗生素、含10%胎牛血清(FBS)的D-MEM/F12培养液将适量miR-21抑制物或阴性对照与250 μl无血清培养基(Life Technology)混合,室温5 min,5 μl脂质体转染试剂与250 μl无血清培养基混合,室温20 min,在37 ℃,含5% CO2的孵箱中培养细胞6 h后,更换为含抗生素、含10% FBS的培养液培养并给予相应的处理。
1.2MVs的提取和观察 采用差速离心的方法提取条件培养液中的MVs,方法概述如下:收集细胞培养液依次在4 ℃的环境下离心,300 g×5 min,1 200 g×20 min,10 000 g×30 min,弃沉淀,收集上清液在4 ℃的环境下离心110 000 g×60 min,沉淀物即为MVs。用适量的PBS重悬MVs。用TRIzol® LS试剂(Life Technology)提取MVs中的总RNA。用透射电镜观察MVs的形态,荧光染色观察MVs,方法参照文献[7],概括如下:Dil-C18是一种膜的荧光染料,用Dil-C18染料预处理供体NRK-52E细胞1h,用磷酸缓冲淮(PBS)清洗细胞3次,依据前文所述方法收集条件培养基,并离心得到被Dil-C18染色的MVs。对照MVs的收集方法类似,将MVs重悬在D-MEM/F12培养液中,孵育受体心肌细胞,用荧光显微镜观察受体细胞并拍照。
1.3miRNA的实时定量 PCR(qPCR) 用TRIzol(Life Technology)提取组织或细胞中的总RNA,用miScript RT II试剂盒(Qiagen),以1 μg 的总RNA 为模板合成miRNA的cDNA文库,反应体系为20 μl(其中总RNA 模板2 μl),充分混匀,37 ℃×60 min,95 ℃×5 min,立即置于冰上冷却,-20 ℃保存。用miScript SYBR Green PCR试剂盒Qiagen),以10 ng的miRNA的cDNA为模板扩增,反应体系为20 μl(其中10×miScript miR-21 或U6 引物2 μl,miRNA 的cDNA 模板1 μl),充分混匀,95 ℃×15 min×1 次,(94 ℃×15 s,55 ℃×30 s,70 ℃×34 s)×40 次,在70 ℃×34 s步骤收集荧光信号。每个样本重复3次,采用ABI7300默认的阈值读取CT值,3次平均值得到CT样本,ΔCT=CTmiR-21-CTU6,ΔΔCT=ΔCT 处理-ΔCT 对照,取2-ΔΔCT作miRNA 相对定量的柱状图。
1.4心肌细胞长径的测量 H9C2心肌细胞消化后,培养基重悬细胞并进行计数,分别取2×105个细胞到6孔板中,待细胞培养24 h贴壁后更换细胞培养基为含2% FBS的DMEM培养基继续培养24 h使细胞处于静止期。不同条件培养结束后,用目镜测微尺测量心肌细胞长径。400倍镜下每组随机选取6个胞浆横纹清晰、细胞核完整、形态规则的心肌细胞,测量细胞长径。
1.5二喹啉甲酸(BCA)蛋白定量的检测 H9C2心肌细胞每孔分别加入100 μl蛋白裂解液冰浴下对细胞进行充分裂解,细胞裂解后,收集裂解液于1.5 ml离心管中,12 000 g离心取上清,后按照BCA蛋白试剂盒说明进行定量。
1.6酶联免疫吸附检测人心内肽(ANP)水平 H9C2心肌细胞不同条件培养后,吸去H9C2心肌细胞的培养液,PBS清洗2遍后胰酶消化细胞,800 g离心收集细胞,200 μl PBS重悬细胞并转移到新的1.5 ml离心管中。将离心管置于冰浴中超声(45 W,15 s超声3次,间隔15 s)以充分裂解。按照CUSABIO公司ANP试剂盒的检测方法测定ANP浓度。每个试验条件设3复孔同时进行实验,以其均值作为统计数据。
1.7统计学方法 用SigmaStat 软件(版本3.5,Jandel Scientific Software)分析实验数据。组间比较采用方差分析和t检验,P<0.05为差异有统计学意义。
2 结 果
2.1TGF-β1 可诱导供体肾小管上皮细胞产生MVs 以体外培养的NRK-52E为研究对象,收集对照培养液及5 ng/ml的TGF-β1处理细胞24 h后的条件培养液,分别超速离心,留取沉淀用透射电镜观察,发现条件培养液沉淀物中有呈簇状的双层膜结构的小囊泡,直径在50~200 nm,符合MVs的形态学特征,见图1。

图1 肾小管上皮细胞产生的条件培养液超速离心获得的沉淀物的冷冻电镜照片a.无TGF-β1 处理的供体肾小管上皮细胞产生的条件培养液超速离心获得的沉淀物;b.5 ng/ml的TGF-β1处理的供体肾小管上皮细胞产生的条件培养液超速离心获得的沉淀物。标尺=100 nm
2.2Dil-C18 染料标记的MVs可进入受体心肌细胞 用Dil-C18染料标记培养的肾小管上皮细胞并收集TGF-β1处理后的条件培养液,超速离心获得Dil-C18染料标记的MVs,加入受体心肌细胞培养液中,并于不同时间点观察,受体心肌细胞内可见Dil-C18红色荧光阳性的小颗粒,且数量随着处理时间的延长而增加,提示MVs能从TGF-β1处理的肾小管上皮细胞传递到受体心肌细胞中,见图2。
2.3TGF-β1 诱导产生的MVs可促使受体心肌细胞肥大 为探讨MVs对心肌细胞的作用,我们分别用条件培养液经超速离心后的上清液和沉淀的MVs处理培养的心肌细胞,200 μl条件培养液沉淀的MVs处理心肌细胞48 h,能导致细胞长径、蛋白浓度及ANP含量的增加,而上清液没有上述效应。因此,结果提示TGF-β1处理后的供体肾小管上皮细胞分泌的 MVs能促使受体心肌细胞发生肥大效应,见图3。
2.4TGF-β1诱导肾小管上皮细胞分泌的MVs中包含miR-21 为探讨肾小管上皮细胞产生MVs促使心肌细胞肥大的机制,我们收集了对照组和5 ng/ml的TGF-β1处理后的肾小管上皮细胞的培养液,超速离心分离条件培养液沉淀的MVs后,分别提取总RNA并检测其中的miR-21含量,qPCR分析显示,与对照组相比,TGF-β1处理的供体肾小管上皮细胞分泌的MVs中miR-21的含量显著增高。在此基础上,我们进一步确定MVs能否将外源性miR-21导入受体心肌细胞。同样,与含有miR-21的供体NRK-52E细胞条件培养液中分离的MVs作用24 h后,受体心肌细胞中miR-21的含量较对照组显著增加,见图4。
2.5包含miR-21 的MVs诱导心肌细胞肥大 为进一步探讨外源性miR-21在促进心肌细胞肥大中的作用,我们将miR-21抑制剂预转染受体心肌细胞,并将收集的含有MVs的条件培养液继续诱导心肌细胞48 h。转染miR-21抑制剂的心肌细胞与转染NC的对照组相比,条件培养液诱导组细胞长径、蛋白浓度和ANP含量均明显增加,而预转染miR-21抑制剂的受体心肌细胞则未发生肥大效应。这些结果表明,MVs诱导的心肌细胞肥大可被miR-21抑制剂所消除,见图5。
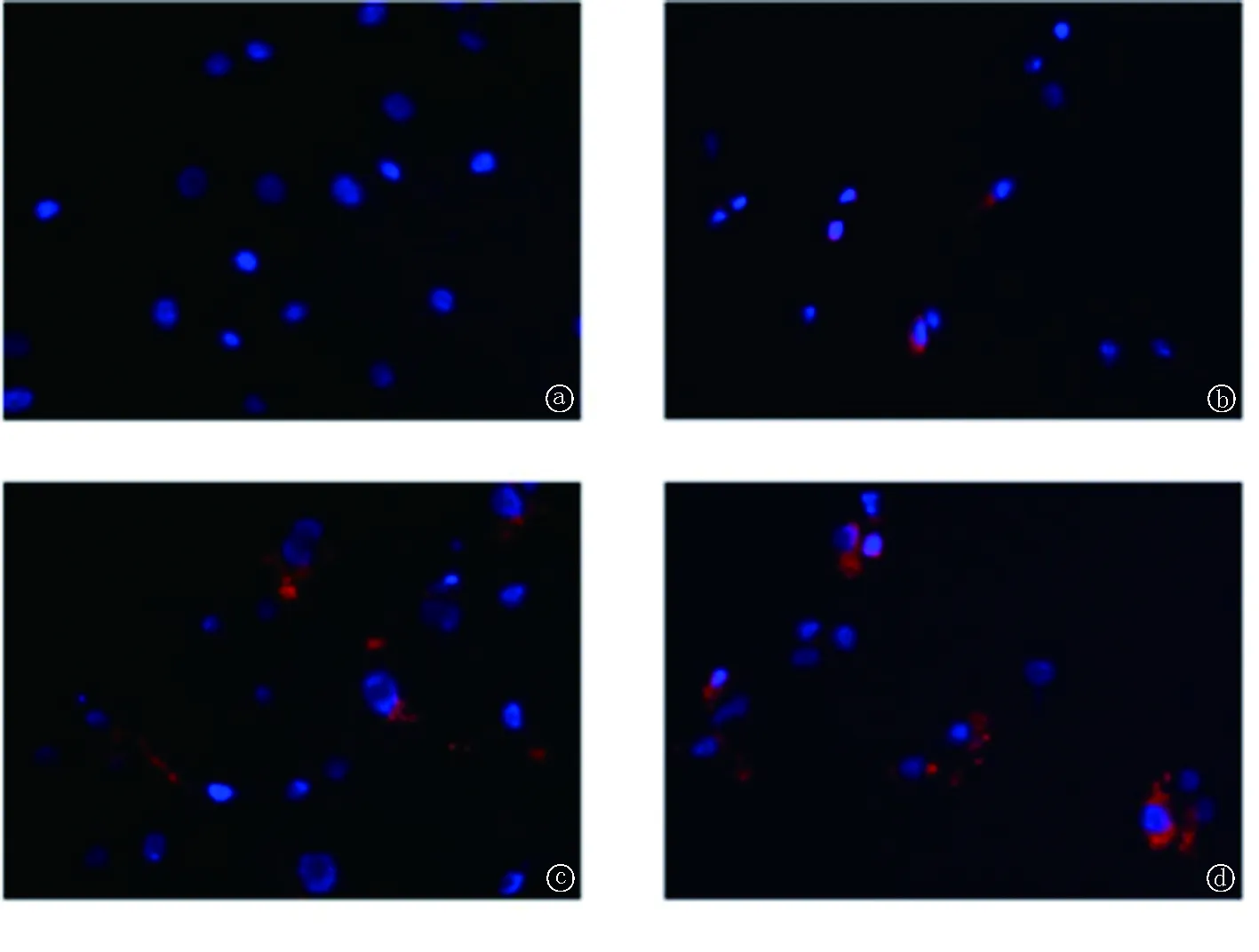
图2 用Dil-C18 染料标记MVs,处理受体H9C2细胞不同时间后的荧光显微镜照片a-d.供体NRK-52E细胞经Dil-C18染料标记,超速离心获得条件培养液的MVs,处理受体NRK-52E细胞0 h(a)、6 h(b)、12 h(c)、24 h(d)。红色:Dil-C18标记的MVs,蓝色:细胞核

图3 200 μl条件培养液沉淀的MVs处理心肌细胞48 h后细胞肥大效应分别用条件培养液经超速离心后的上清液和沉淀的MVs处理培养的心肌细胞细胞长径(a)、蛋白浓度(b)及ANP含量(c)。*P<0.05

图4 肾小管上皮细胞分泌的微囊泡中及受体心肌细胞中miR-21的含量a.对照培养液和条件培养液超速离心分离的MVs中miR-21的q-PCR结果;b.对照培养液及条件培养液中分离的MVs作用受体心肌细胞24h后miR-21的q-PCR结果。*P<0.05

图5 MiR-21抑制剂预转染受体心肌细胞后用含有MVs的条件培养液诱导48 h后细胞的肥大效应分别用转染对照、含有MVs的条件培养液、转染miR-21抑制剂、含有MVs的条件培养液+转染miR-21抑制剂处理后的心肌细胞长径(a)、蛋白浓度(b)和ANP含量(c)。*P<0.05
3 讨 论
心力衰竭是CKD患者死亡的重要原因,并发心力衰竭的CKD患者数量呈持续增长,而CKD患者普遍存在多种并发症,如高血压、糖尿病和动脉粥样硬化等,其均可独立地增加心脏风险,因此很难完全明确CKD介导心力衰竭的潜在机制。肾素-血管紧张素-醛固酮系统(RAAS)抑制剂有逆转左心室肥厚,改善左心室功能的作用[8],但可能导致肾小球滤过率下降及血肌酐水平上升,引起高钾血症的危险性增加,限制了其在严重肾功能不全中的应用。而即使积极采取多种治疗手段如调整血流动力学、减轻液体超负荷、纠正贫血、营养不良,纠正骨矿物质代谢紊乱乃至透析治疗,仍不能完全逆转CKD时心力衰竭的发生发展,提示肾-心交互作用的复杂性,需要积极探索其他心、肾相互作用的调控因子。细胞通讯是心、肾之间相互影响的重要方式。研究发现MVs是介导非接触的细胞间信息通讯的重要载体[9]。本研究通过观察肾小管上皮细胞产生的MVs在心肌肥大中的作用,为临床提供新的策略及手段。
细胞在正常生理条件下可以产生少量MVs,在某些病理生理情况下产生明显增多[10]。本实验中我们首先用TGF-β1诱导肾小管上皮细胞损伤并收集这些细胞的条件培养液,采用低温超速离心方法观察到离心后获得的沉淀物在电镜下符合MVs的形态学特征,且较正常对照明显增多。MVs是细胞状态的缩影,一般情况下,细胞膜磷脂如磷脂酰丝氨酸(phosphatidylserine,PS)和磷脂酰乙醇胺(phosphatidylethanolamine,PE)位于细胞膜内侧,当细胞内钙离子浓度升高时,PS从细胞膜内侧翻向外侧[11]。本研究中我们用荧光染料Dil-C18标记供体细胞,因Dil-C18是一种脂质染料,可用于标记供体细胞的细胞膜,MVs的脂质膜结构中通常包含部分来源细胞的细胞膜成分,故当细胞分泌MVs时MVs也被Dil-C18标记,从而可用来验证供体细胞产生的MVs能否进入受体细胞[12]。我们用供体细胞产生标记有Dil-C18的MVs处理受体心肌细胞,结果显示MVs可以从肾小管上皮细胞传递到心肌细胞,并且处理时间越长,进入细胞的MVs数目越多。
为进一步验证这些MVs的作用,我们用TGF-β1处理肾小管细胞,将收集的培养液经超速离心得到的上清液和沉淀的MVs分别作用于心肌细胞,结果证实沉淀中的MVs能够诱导心肌细胞肥大,而不含有MVs的上清液则没有该效应,提示TGF-β1处理肾小管细胞产生的MVs才是真正诱导心肌细胞肥大的原因。虽然MVs是介导细胞间通讯的重要载体,然而真正介导细胞间作用的是MVs中包含的各类分子。循环miRNA由于受到MVs的保护非常稳定,避免了核糖核酸酶(RNase)的降解,作为运输miRNA的主要载体受到广泛关注[13]。其中,miR-21能促使病理性心脏重塑和血管生成,成为心肌肥大作用中的研究热点[14]。有研究发现miR-21在高血压肾损害中呈高表达,并推进高血压及其相关肾损害的病理进程[15],更提示外泌性MVs在心肌肥大中的重要作用。在参与肾纤维化的多种miRNAs中,miR-21也被证实起着十分重要的作用[16]。已证实纤维化肾脏小鼠模型中肾脏来源的miR-21明显上调,且研究发现血循环中miR-21的水平与肾纤维化程度亦呈正相关[17],提示肾脏纤维化时肾脏细胞分泌的miR-21可能通过MVs进入血循环。因此在慢性心、肾疾病的进展中,miR-21均发挥着重要的调节作用。我们观察到用TGF-β1处理肾小管细胞产生的MVs中含有大量的miR-21,且这些MVs作用于受体心肌细胞后可使心肌细胞中miR-21含量显著增加,而转染miR-21的抑制剂下调肾小管上皮细胞中miR-21含量后,能够消除其导致的心肌肥大效应,进一步验证了肾脏来源的包含miRNA-21的MVs可作用于心肌细胞导致心肌肥大。
综上所述,本研究发现TGF-β1处理后损伤的肾小管上皮细胞能够分泌包含miR-21的MVs,并可介导miR-21从肾小管上皮细胞传递到心肌细胞并引起心肌细胞的肥大。系统研究包含miRNA的MVs在心、肾细胞间的通讯作用及对靶基因的调控将进一步拓展对疾病机制的理解,并可能为CKD导致心力衰竭的治疗新策略提供实验依据和理论基础。
