人参多糖对氧化应激损伤肝细胞的保护作用机制研究
2020-04-01,2,*
,2,*
(1.长春中医药大学,吉林长春 130117;2.吉林省中医药科学院,吉林长春 130012)
人参(PanaxginsengC. A. Mey)为“百草之王”,其功效有大补元气、复脉固脱、补脾益肺、生津安神等,其富含的生物活性物质主要包括人参总多糖、人参总皂苷、人参总蛋白等。人参多糖具有增强免疫力[1]、促进造血、降血糖、抗利尿、抗衰老、抗血栓、抗菌、抗炎、抗肿瘤等多种功能。
肝脏在糖异生与糖酵解的作用下维持着人体的能量动态平衡。活性氧(eactive oxygen species,ROS)引发的氧化应激在多种疾病的发病机制中起关键作用,肝脏受损及肝脏糖异生功能异常与氧化应激息息相关[2]。目前,恢复机体糖异生功能,降低氧化应激带来的损伤,修复肝功能成为研究热点[3]。已有大量研究关于生物活性物质对肝脏的保护作用,Jeon等探究了人参的有效物质对人体肝脏的保护作用[4];王荣等探究了五味子多糖对肝细胞的保护作用[5];随着现代研究的不断深入,研究人员发现人参较其他功能性植物的应用更加广泛,不但能够提高机体免疫力,同时能够保护肝细胞免受损伤[6]。
但从氧化应激的机理方向阐述,人参中的何种成分对肝细胞受损后发挥保护作用尚未研究。本研究通过构建 H2O2诱导的体外大鼠肝细胞氧化损伤模型,探讨人参多糖对受损肝细胞的影响和相关机制,为下一步体内实验提供数据支撑。
1 材料与方法
1.1 材料与仪器
大鼠肝细胞BRL-3A 武汉普诺赛生命科技有限公司;MEM培养基、青霉素-链霉素双抗溶液、胰酶 美国Hyclone公司;胎牛血清 美国Gibco 公司;DMSO 北京鼎国昌盛生物技术有限责任公司;ELISA试剂盒 上海朗顿有限公司;人参样品 长春中医药大学中医药大健康创新中心提供;H2O2溶液 sigma公司;罗丹明123、细胞凋亡检测试剂盒 BD Pharmingen TM;ROS检测试剂盒 赛默飞世尔科技公司。
二氧化碳细胞培养箱 美国Thermo公司;超净台 苏州净化有限公司;In-finite200 Pro多功能微孔板分析仪 瑞士Tecan公司;FlowSight多维全景流式细胞仪 Amnis公司;中空纤维系统 上海子起生物科技有限公司;冻干机 深圳市依米科技有限公司;真空干燥箱 上海雅程仪器设备有限公司。
1.2 实验方法
1.2.1 人参有效物质的制备
1.2.1.1 人参总蛋白的制备 采用碱提酸沉的方法[7],将100 g人参经过粉粹后,过三号筛(50目),加入10倍量的碱水(pH为8)低温浸提4 h,过滤,以3500 r/min离心5 min,取上清以0.22 μm中空纤维柱过滤,滤液以HCl溶液调至等电点,静置1 h后,7000 r/min离心10 min,所得沉淀即为人参总蛋白,冻干机冻干,称其重量,人参总蛋白收率为3.5%,经BCA试剂盒检测测得其纯度为75%。
1.2.1.2 人参总多糖的制备 采用水提醇沉的方法[8],将100 g人参经过粉碎后,过三号筛(50目),进行100 ℃沸水提取,第一次10倍水,第二次8倍水,分别煎煮2、1 h,过滤后滤液合并,3500 r/min离心5 min,浓缩,用蒸馏水定容至200 mL,加入4倍体积的无水乙醇使药液终浓度为80%的醇浓度进行醇沉,使其在4 ℃冰箱过夜,离心后所得沉淀即为粗多糖,之后进行sevage法脱蛋白,减压真空干燥箱烘干,人参总多糖收率为7.8%,经苯酚-浓硫酸法测得纯度为63.4%。
1.2.1.3 人参总皂苷的制备 采用超声波提取法[9-11],将100 g人参经过粉碎后,过三号筛(50目),以60%的乙醇溶液提取,料液比1∶30 (g/mL),提取温度70 ℃,超声30 min后3500 r/min离心5 min,取上清,水浴80 ℃蒸干乙醇后,减压真空干燥箱烘干,人参总皂苷收率为8.3%,根据保健食品功效成分及卫生指标检验规范测得纯度为70%。
1.2.2 细胞培养 BRL-3A细胞于含10%胎牛血清的MEM培养液在37 ℃,5% CO2的培养箱中培养,取对数生长期细胞用于后续实验[12-13]。
1.2.3 氧化应激模型的建立 使用MEM培养基将H2O2稀释至25 μmol/L,采用细胞计数器将大鼠肝细胞(BRL-3A)密度调整到3×104个/mL加到96孔板中,每孔100 μL,放入37 ℃、5% CO2的培养箱中,24 h后将原培养基去除,氧化应激模型组每孔加入含有H2O2,终浓度为25 μmol/L的MEM培养基100 μL,放入37 ℃、5% CO2的培养箱中,作用2 h,即得到氧化应激损伤模型。
1.2.4 人参提取物对氧化应激模型的保护作用 细胞培养瓶中细胞密度达到90%时,吸出培养基,加入0.25%胰酶1 mL,室温放置1~2 min待培养瓶中细胞消化至圆形时,将胰酶吸出,加入3 mL的MEM培养基,使用吹管将细胞轻轻吹打下来,以1100 r/min的转速,离心5 min,计数,均匀地铺至细胞培养板中,培养24 h后,分为对照组、损伤组和给药组。对照组:MEM培养基正常培养;损伤组:加入终浓度为 25 μmol/L H2O2溶液培养肝细胞2 h,随后吸出,补加MEM培养基在37 ℃、5% CO2的培养箱中培养24 h;给药组:加入终浓度为25 μmol/L H2O2溶液培养肝细胞2 h,随后吸出,分别用含有人参多糖(0.4、0.8、1.6 mg/mL)、蛋白(0.4、0.8、1.6 mg/mL)皂苷(0.04、0.08、0.16 mg/mL)的MEM培养基作用于受损伤的肝细胞,在37 ℃、5% CO2的培养箱中培养24 h[14]。
1.2.5 MTT法测定细胞活力 BRL-3A细胞密度调整到3×104个/mL加到96孔板中,每孔100 μL,按照实验分组干预处理后每孔加入 MTT溶液30 μL,37 ℃继续孵育4 h,终止培养,加入150 μL DMSO溶解,设置空白孔调零,酶标仪上振荡3 min后在490 nm波长处检测各孔OD值,记录并计算细胞存活率[15]。
1.2.6 SOD及MDA含量的检测 采用ELISA试剂盒法测定细胞内的SOD及MDA的变化情况,将各组细胞消化洗涤后至液氮中反复冻融三次,以2000 r/min的转速离心20 min,仔细收集上清用于测定[16]。
1.2.7 细胞凋亡检测 BRL-3A细胞接种于6孔培养板,密度调整到3×104个/mL,每孔2 mL,按照实验 1.2.4 分组干预处理后收集细胞,用PBS洗涤细胞3次,1500 r/min离心5 min,取沉淀,加入200 μL 1×Binding buffer悬浮细胞,之后加入5 μL Annexin V-EGFP混匀后,加入5 μL Propidium Iodied混匀,室温避光反应15 min,用流式细胞仪检测,激发波长Ex=488 nm,发射波长Em=530 nm。Annexin V-EGFP的绿色荧光通过FITC通道检测,PI红色荧光通过PI通道检测。荧光补偿调节使用未经凋亡诱导处理的正常细胞作为对照,去除光谱重叠和设定十字门的位置[17]。
1.2.8 线粒体膜电位(mitochondrial membrane potential,MMP)的检测 BRL-3A细胞接种于6孔培养板,密度调整到3×104个/mL,每孔2 mL,按照实验分组干预处理后收集细胞,用PBS洗涤细胞3次,加入罗丹明123使其终浓度为2 μmol/L,37 ℃避光孵育30 min,1500 r/min离心5 min,弃上清,加入PBS洗涤细胞3次,最后加入200 μL PBS重悬细胞,使用流式细胞仪检测,激发波长507 nm,最大发射波长529 nm检测药物作用前后荧光强弱[18]。
1.2.9 ROS水平检测 用MEM培养基稀释DCFH-DA,终浓度为10 μmol/L。细胞培养结束后,弃掉培养液,每孔加入500 μL浓度为2 μmol/L的 DCFH-DA,在37 ℃的CO2培养箱内孵育30~60 min。用PBS缓冲液轻轻洗涤细胞3次,去除未进入细胞内的DCFH-DA,注意不要将细胞吸出。使用流式细胞仪检测。使用激发波长488 nm,发射波长525 nm,检测药物作用前后荧光的强弱。
1.2.10 G6P、PEPCK、ATP酶及肝糖原含量变化 将各组细胞消化洗涤后至液氮中反复冻融三次,2000 r/min离心20 min,仔细收集上清液用于测定,采用ELISA法测定细胞内的G6P、PEPCK、ATP酶及肝糖原的变化[19]。
1.3 数据处理
每个实验结果均做三次平行实验,采用SPSS Statistics 17.0计算平均值、标准偏差。通过GraphPad prism软件进行处理实验数据,进行t值检验。
2 结果与分析
2.1 人参提取物对H2O2损伤BRL-3A细胞的保护作用
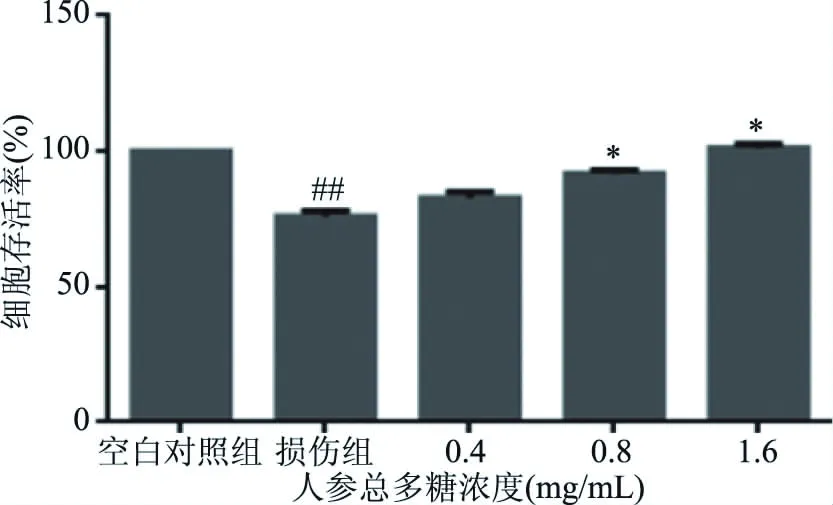
图1 人参总多糖对BRL-3A细胞活力的影响Fig.1 Effects of total ginseng polysaccharides on the activity of BRL-3A cells注:*为给药组与损伤组的对比呈显著关系,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);***表示差异非常显著(P<0.001),****表示差异极其显著(P<0.0001);#为损伤组与空白对照组的对比呈显著关系,#表示差异显著(P<0.05),##表示差异极显著(P<0.01);###表示差异非常显著(P<0.001),####表示差异极其显著(P<0.0001);图2~图5,图7~图12同。
通过对比人参的三种有效物质得到如下结果,经过分析之后,人参总多糖优于人参总蛋白与人参总皂苷,体现在损伤细胞对人参总多糖有浓度依赖性,如图1,人参多糖作用后,三个给药浓度(0.4、0.8、1.6 mg/mL)的细胞存活率较损伤组均有所上升,并且中、高剂量有显著性差异(P<0.05)。同一浓度的总多糖(图1)与总蛋白(图3)比较,总多糖恢复作用较好,总蛋白对细胞的作用不强,并且1.6 mg/mL的总蛋白作用后呈下降趋势。由图2可知,人参总皂苷对细胞无明显保护作用,细胞存活率无上升趋势。故在体外实验筛选中,最终选定人参总多糖进行后续实验,进一步探讨多糖发挥作用的机制[20-21]。

图2 人参总皂苷对BRL-3A细胞活力的影响Fig.2 Effects of total ginsenosides on the activity of BRL-3A cells

图3 人参总蛋白对BRL-3A细胞活力的影响Fig.3 Effects of total ginseng protein on the activity of BRL-3A cells
2.2 氧化应激模型中SOD、MDA的含量变化
肝细胞的氧化应激模型中H2O2导致SOD、MDA的含量急剧变化。SOD是体内重要的抗氧化酶,可催化超氧阴离子和H2O2发生反应,MDA作为脂质过氧化的关键标志物,可间接反映细胞遭受氧自由基损害的严重程度,协调氧化和抗氧化的平衡[22]。由图4、图5可以看出,损伤组胞内的SOD下降、MDA上升,破坏了机体平衡。经不同浓度的人参总多糖作用后,其氧化应激的相应指标得到了极大的改善,即给药组SOD上升,MDA下降,其中各浓度组MDA含量,中、高浓度组SOD含量较损伤组有显著差异(P<0.05),并随着人参多糖浓度的增加,保护作用增强,使受损肝细胞趋于正常水平。
2.3 细胞凋亡结果
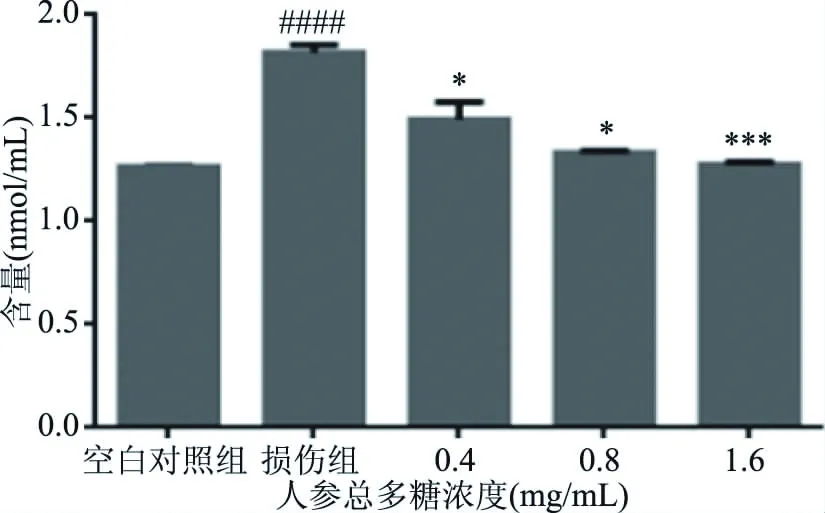
图4 MDA的含量变化Fig.4 MDA content change
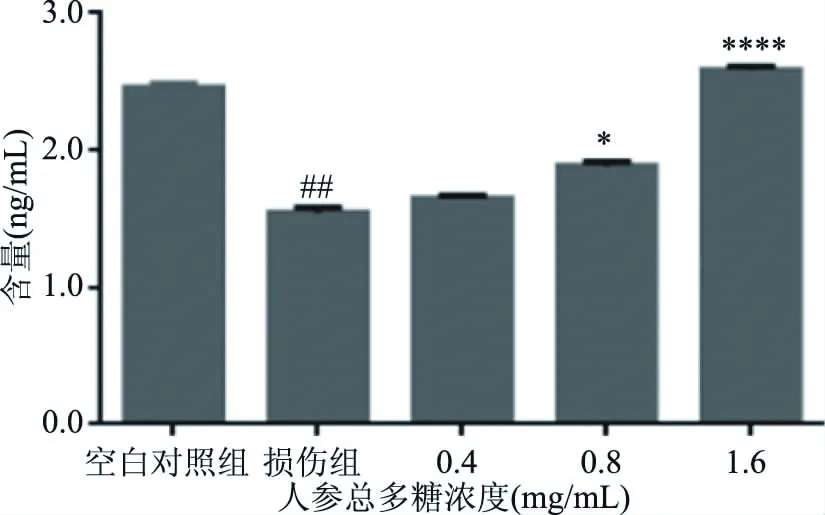
图5 SOD的含量变化Fig.5 SOD content change
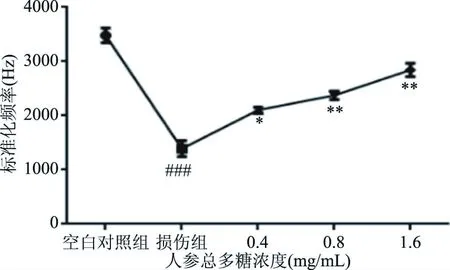
图7 人参总多糖对线粒体膜电位的影响Fig.7 Effects of total polysaccharide of ginseng on mitochondrial membrane potential
采用流式细胞术Annexin V/PI双染色定量检测细胞凋亡程度,其中R4与R5分别表示晚期凋亡与早期凋亡的细胞[23],由图6结果显示经不同浓度人参总多糖保护后可显著降低H2O2诱导的BRL-3A细胞凋亡(P<0.05),细胞早期凋亡与晚期凋亡均有所改善,在人参总多糖低浓度的作用下,减少了细胞的早期凋亡,中、高浓度作用下,同时减少了早期与晚期凋亡。随着浓度的升高,其保护作用逐渐增强,减少了细胞凋亡的发生,为下一步探究药物发挥作用的机制提供基础。
2.4 线粒体膜电位的检测
线粒体膜电位异常作为细胞凋亡发生的最早期事件,研究发现,在凋亡信号的刺激下,线粒体的膜电位丢失,使线粒体膜的通透性发生变化,各种凋亡因子会从线粒体释放到细胞质中,从而导致了线粒体膜电位的下降[24]。实验结果(图7)显示经过氧化氢损伤后,线粒体膜电位下降,随着人参总多糖药物浓度的上升,经流式细胞仪测定后,线粒体膜电位的中值均有显著性提高(P<0.05)。
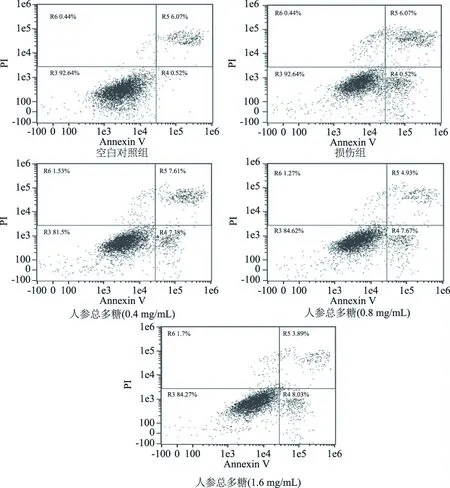
图6 人参总多糖对细胞凋亡的影响Fig.6 Effects of total polysaccharide of ginseng on cell apoptosis
2.5 ROS含量变化
细胞中活性氧(ROS)等自由基主要由线粒体产生,高浓度的ROS会造成氧化损伤,导致线粒体功能的丧失,最终诱发细胞凋亡[25],结果如图8所示,肝细胞的氧化应激模型中导致损伤组ROS升高,通过低、中、高三个浓度的人参总多糖作用后,其氧化应激的ROS指标逐渐下降,并有显著性差异(P<0.05),使受损肝细胞得到保护。
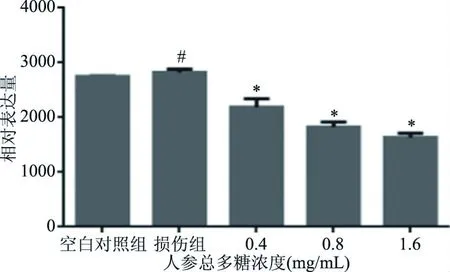
图8 人参总多糖对ROS的影响Fig.8 Effect of total polysaccharide of ginseng on ROS
2.6 糖异生功能的恢复(G6P、PEPCK及ATP酶)
糖异生的作用是为人体提供能量,是肝脏的功能之一,如图9、图10所示,损伤组与空白对照组比较,糖异生的关键酶含量显著下降(P<0.05),影响了糖异生的功能,从而影响了肝细胞生成糖原的能力。经过低、中、高三个浓度的人参总多糖作用后G6P、PEPCK的活力恢复。推测人参多糖作用后,激发了G6P、PEPCK所在的信号通路,为下一步QPCR与WB水平检测提供数据支撑。
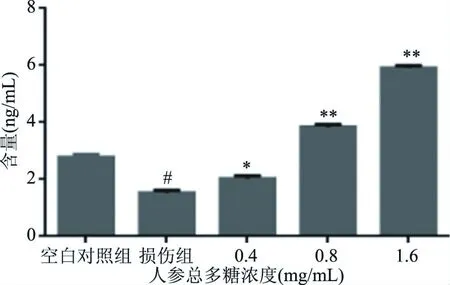
图9 人参总多糖作用下G6P的变化情况Fig.9 Changes in G6P under the action of total polysaccharides from ginseng
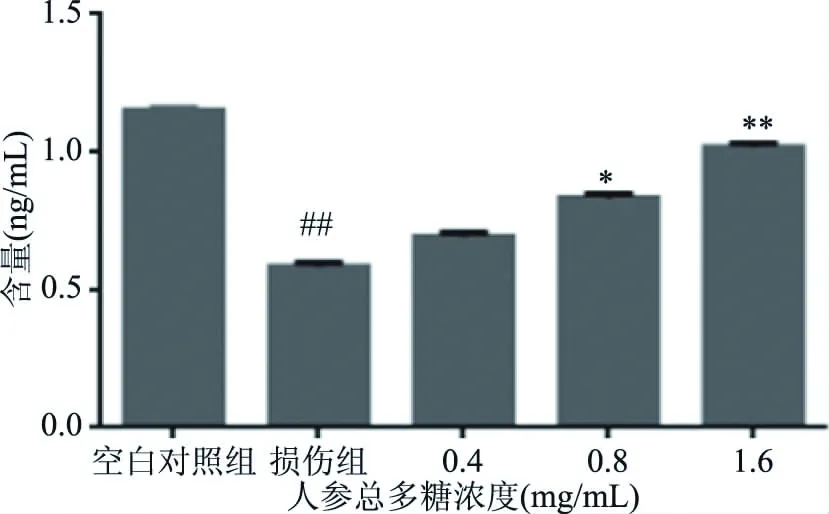
图10 人参总多糖对PEPCK的影响Fig.10 Effect of total polysaccharide of ginseng on PEPCK
经损伤后同样影响了肝细胞线粒体中ATP酶的改变,ATP酶为评价线粒体功能与能量代谢的重要指标,如图11所示。给药后ATP 酶的活力较损伤组极显著上升(P<0.01),人参总多糖可能通过改善线粒体的功能来恢复受损肝细胞的功能[26],同时,ATP酶与G6P给药后含量显著升高(P<0.05),分析可能与过氧化氢与药物共同诱导所致。

图11 人参总多糖对ATP酶的影响Fig.11 Effect of total polysaccharide of ginseng on atpase
2.7 肝糖原的含量变化
肝糖原是人体生命运动能量的重要来源,肝脏作为能量代谢的枢纽,其重要作用是产生糖原,糖原的储存量可直接影响机体的运动能力[27],如图12所示,损伤组经过损伤之后,肝糖原的含量减少,低、中、高人参总多糖干预后,肝糖原含量呈梯度增长,提高糖原储备量有助于糖异生功能的恢复,给药组肝糖原含量比损伤组明显升高,即增加能量物质的储备能力增强,肝脏糖异生功能恢复,从而恢复受损肝细胞的功能。
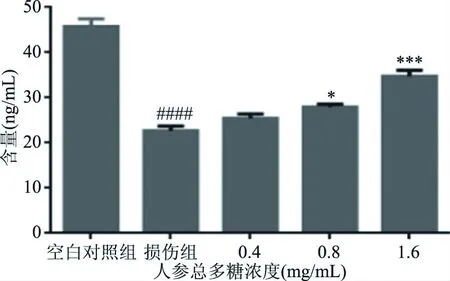
图12 人参总多糖对肝糖原的影响Fig.12 Effect of total polysaccharide of ginseng on hepatic glycogen
3 结论与讨论
本研究采用了过氧化氢对肝细胞损伤,模拟氧化应激的损害,实验模型组显示肝糖原含量下降,SOD降低,MDA升高,表明肝细胞功能已受到损伤,当糖原含量不足,不能为生命活动提供充足能量时,进而导致疾病的发生,同时大量的ROS将会破坏肝脏线粒体功能及糖异生功能等[28],高进涛等研究了氧化应激对Hacat细胞的保护作用;李雪惠等探讨了氧化应激对心肌细胞危害[29-30],均通过SOD与MDA的变化初步阐述了氧化应激造成的损伤,但对于药物对氧化应激造成损伤的保护作用机制尚未研究。
现代医学认为能量代谢与ATP的产生息息相关,线粒体及糖异生功能受损导致肝脏不能进行正常的能量代谢,肝糖原产生量减少,肝功能作用减弱。本实验结果显示,人参多糖作用后,肝脏产生肝糖原的量较损伤组有显著性上升(P<0.05),同时葡萄糖-6-磷酸酶与磷酸烯醇式丙酮酸羧激酶含量上升,糖异生作用在一定程度下恢复,人参具有双向调节的作用,当糖异生功能过强时,及时对其进行抑制[31]。
氧化应激导致的肝细胞损伤使细胞中的SOD稳态被破坏,而MDA的增加影响了ATP的释放,阻碍了肝细胞线粒体的功能,人参多糖作用后,肝细胞凋亡较损伤组减弱,线粒体膜电位回升,ATP酶含量升高,故肝脏能量代谢功能恢复,人参多糖经过升高SOD,降低MDA来减轻氧化应激带来的损伤。
本研究表明,人参多糖对氧化应激造成的肝细胞损伤有一定的保护作用,而氧化应激与人体疲劳等息息相关,故为下一步人参补气提供数据支撑。
