茶叶CHS基因表达特性及其与儿茶素积累的关系
2020-04-01,2,2,*
,2,2,*
(1.华南农业大学食品学院,广东广州 510642;2.广东省功能食品活性物重点实验室,华南农业大学,广东广州 510642)
茶叶是世界上三大无酒精饮料之一,富含茶多酚、生物碱、茶氨酸等多种功能活性物质[1]。茶多酚作为茶叶重要的功能物质组成,占茶叶干重的18%~36%,而其主要组分儿茶素(catechins)占到茶多酚总量的60%~80%[2]。茶叶中的儿茶素主要由表没食子儿茶素(EGC)、表没食子儿茶素没食子酸酯(EGCG)和表儿茶素没食子酸酯(ECG)等单体组成,具有降血压[3]、减肥[4]、预防糖尿病、心血管疾病及癌症等多种功效[5]。目前,茶叶中儿茶素生物合成途径已基本探明,其主要由类黄酮代谢途径,在系列合成酶的催化下合成。其中,查尔酮合酶(chalcone synthase,CHS)被认为是该代谢途径的首个限速酶,具有催化香豆酰-CoA和丙二酰-CoA转变成查尔酮的功能,在儿茶素的合成中占有重要地位[6-7]。
酶是基因表达的产物,CHS基因由Reimold等[8]1983年首次从欧芹中获得克隆,随后相继在金银花、苦荞、水仙等植物中分离得到。海棠花和矮牵牛中CHS基因表达分别与花色苷和花青素含量有关[9-10],而拟南芥[11]中研究发现CHS基因的表达水平与其类黄酮含量呈正相关,其表达的蛋白定位于内质网和液泡中。茶树CHS基因的研究始于1994年Takeuchi等[12]的报道。后续研究发现,茶树不同生长时期[13]、不同品种[14],其体内的CHS基因表达量均存在差异。CHS基因转录水平与代谢物花青素[15]和儿茶素[16]积累具有正向调控的功能已得到证实,并有研究推测CHS基因在茶树生长中发挥重要作用[17],其编码的蛋白亚细胞定位于细胞质中[18]。CHS基因作为植物类黄酮物质合成居于通路上游的限速酶基因,其表达水平对植物表型及代谢产物积累影响备受关注。迄今为止,茶叶中涉及CHS基因与茶叶代谢物的研究虽较多,但对CHS基因的表达研究均停留在转录水平,其在茶树体内的蛋白表达情况尚未揭示,尤其CHS基因在转录、翻译两层次的基因表达水平与茶叶儿茶素积累的关系还未见报道。
为揭示茶叶儿茶素积累与CHS基因表达特性的关系,本研究选取具有差异儿茶素代谢的英红9号和南昆山毛叶茶为实验对象,HPLC法测定儿茶素含量,克隆对应茶叶中的CHS基因,并对其体内表达蛋白进行亚细胞定位,经序列分析选取基因特异肽段人工合成,并用作抗原免疫兔子制备CHS基因特异抗体。结合qRT-PCR、Western杂交技术,分析茶叶中差异儿茶素代谢与儿茶素合成关键酶基因CHS从转录到翻译水平的关系,进一步揭示了茶叶儿茶素合成代谢的分子机理。
1 材料与方法
1.1 材料与仪器
英红9号品种和南昆山毛叶茶春季1芽2叶嫩稍 分别采于华南农业大学园艺学院和广东省龙门县南昆山镇;反转录试剂盒(编号:6210A)、pMD18-T载体、T4-DNA连接酶、LA Taq DNA聚合酶 宝日医生物技术有限公司;质粒小提试剂盒、DNA纯化回收试剂盒 天根生化科技有限公司;All-In-One DNA/RNA提取试剂盒(编号:B618203) 生工生物工程股份有限公司;KLH、Sulfolink Resin 美国Pierce公司;儿茶素标准品、福氏完全佐剂 Sigma公司;PCR引物合成、DNA测序 天一辉远生物技术有限公司;其它化学试剂 均为国产分析纯。
Agilent Eclipse XDB-C18色谱柱、Agilent 1200高效液相色谱系统 美国Agilent公司;PCR仪 Eppendorf公司;电泳仪 北京百晶生物技术有限公司;凝胶成像系统 Bio-Rad公司;StepOne型荧光定量PCR仪 美国ABI公司;激光共聚焦 美国PERKINELMER公司。
1.2 实验方法
1.2.1 儿茶素含量测定 茶鲜叶儿茶素的提取参考GB/T 8313-2008儿茶素提取方法。称取0.2 g均匀研磨的茶鲜叶于10 mL的离心管中,加入在70 ℃中预热的75%甲醇溶液5 mL,用玻璃棒充分搅拌湿润,立即移入70 ℃水浴中,浸提10 min,浸提后冷却至室温,转入离心机在3500 r/min转速下离心10 min,将上清液转入10 mL的容量瓶中。残渣再用5 mL的75%甲醇提一次,重复以上操作。合并提取液至10 mL容量瓶中,摇匀后过膜待用[19]。儿茶素测定采用Agilent 1200高效液相色谱仪,利用Eclipse XDB-C18色谱柱(4.6×250 mm,5 μm)进行分离,柱温度40 ℃,流速为1.0 mL/min,检测波长为280 nm,进样量为10 μL。流动相A为0.05%三氟乙酸,B为100%乙腈,进行线性梯度洗脱(0~5 min,95%~92% A;5~25 min,92%~89.5% A;25~45 min,89.5%~78% A)。采用安捷伦化学工作站(B.04.02)对原始信号自动积分,采用外标法计算各组分含量。
1.2.2 目的基因扩增 茶鲜叶总RNA提取采用上海生工All-In-One DNA/RNA小量提取试剂盒进行。以提取的RNA为模板,按照反转录试剂盒说明书合成cDNA第1链。根据GenBank中已登录茶树CsCHS基因(KY615681)全长信息,设计特异引物对:5′-ATGGTCACCGTCGAGGACATC-3′ 和5′-TTATGTAGACAAGCTATGGAGCACCACAG-3′。PCR体系为:1 μL cDNA,3 μL 10×Taq Buffer,3 μL dNTPs(2.5 mmol/L),上下游引物各1 μL(10 μmol/L)和 0.5 μL(5 U/μL)La Taq 酶,加去离子水补足至30 μL。反应条件为:94 ℃预变性1 min;94 ℃变性30 s,56 ℃退火40 s,72 ℃延伸1 min,共32个循环;最后72 ℃延伸10 min。目的条带切胶回收后连接至pMD-18T,并转化至大肠杆菌DH5α感受态,经鉴定的阳性菌落送交公司测序。
1.2.3 CHS蛋白亚细胞定位
1.2.3.1 亚细胞定位载体的构建 根据已克隆得到的CHS基因ORF序列,设计如下带酶切位点的特异引物对:5′-GAGAACACGGGGGACTGGTACCCGGGGATCCATGGTCACTGTCGAGGATGTTTG-3′(BamHI),5′-ACAGCTCCTCGCCCTTGCTCACCATGTCGACAG TGCACAAACTGTGGAGC-3′(SalI),PCR扩增目的序列。将扩增产物与提取的pC1301-GFP质粒分别经BamHI和SalI双酶切后,回收各目的片段,混合后用T4-DNA连接酶连接并转入大肠杆菌DH5α感受态。阳性克隆经菌落PCR、酶切分析后进行测序鉴定,获得pC1301-GFP/CHS融合表达载体[20]。
1.2.3.2 农杆菌介导转化烟草叶片 将构建好的定位载体质粒pC1301-GFP/CHS,电击转化到农杆菌EHA105中,28 ℃培养至OD600为0.3,用等体积的Buffer(含10 mmol/L MES,200 μmol/L Acetosyringone和10 mmol/L MgCl2)悬浮,并室温静置4~6 h,并将农杆菌菌液由下表皮注射到4周大的本式烟草叶片中,经培养4~6 d,用激光共聚焦显微镜直接观察叶片的荧光情况,以pC1301-GFP空载体作对照[21]。
1.2.4CHS基因转录水平测定 根据克隆所得CHS序列设计特异引物对:5′-RCTWGATGCTA GGCARGACA-3′和5′-TTGATTGTCGGCTTGATTACC-3′。根据GenBank中茶树的GAPDH基因全长信息设计特异内参引物对:5′-TTGGCATCGTTG AGGGTCT-3′和5′-CAGTGGGAACACGGAAAGC-3′。以反转录cDNA为模板,反应体系为:cDNA 2 μL,SybrGreen qPCR Master Mix(2×)10 μL,上下游引物(10 μmol/L)各0.4 μL,ddH2O 7.2 μL。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,共计40个循环。使用2-ΔΔCT法计算CHS基因相对表达量,对照(MY)中CHS基因的相对表达量为1,每个实验设3重复[22]。
1.2.5 CHS抗体制备与效价检测
1.2.5.1 抗体制备 根据克隆的CHS基因预测编码氨基酸序列,结合国际数据库中茶叶同源基因的特异性比较,并考查CHS蛋白的二级结构、抗原性、亲疏水性、表面触及可能性,选取C-STYPDYYFRITNSEHK-NH2为CHS特异肽段并进行人工合成。取5 mg合成的多肽与KLH偶联作为免疫抗原,另将2 mg多肽与BSA偶联作为检测抗原。用PBS将免疫抗原分别稀释为1 mg/mL,取稀释后的免疫抗原1 mL加入1 mL福氏完全佐剂,乳化后对大白兔颈背部皮下多点(至少8点)注射,2周免疫一次,免疫4次后采血检测抗体效价。每抗原同时免疫两只新西兰大白兔。
1.2.5.2 抗体纯化 将1 mL Sulfolink Resin 偶联1 mg多肽制备抗原亲和柱,亲和柱用10倍柱体积PBS平衡。兔血清经0.45 μm滤膜过滤后,过抗原亲和柱进行抗体吸附,待滤液流尽后加入PBS平衡并流尽溶液。往亲和柱加入抗体洗脱液,收集流出的洗脱液并检测280 nm处的吸光值,对吸光值大于1.0的组分合并,然后进行PBS透析获得纯化抗体用于后续检测。
1.2.5.3 抗体效价检测 采用间接ELISA方法,将200 μL纯化抗原(1 μg/mL)加入酶标板中,置于4 ℃过夜,洗脱封闭后加入稀释纯化抗体100 μL,37 ℃放置1 h。洗涤后加入已稀释二抗100 μL于37 ℃放置30 min。加入TMB于37 ℃放置15 min显色,用酶标仪测定450 nm波长处吸光值,检测获得样品效价[23]。
1.2.6 茶叶体内CHS基因翻译水平测定
1.2.6.1 总蛋白提取 参考取1 g茶鲜叶,在含有水不溶性PVPP的液氮中充分研磨。加入10 mL预冷10% TCA/丙酮(含0.07%β-巯基乙醇,1 mmol/L PMSF),于-20 ℃沉淀3 h。随后于4 ℃以12000×g离心15 min,弃上清。重复以上丙酮洗涤操作2~3次,收集沉淀于-80 ℃保存[24]。
1.2.6.2 Western blot分析 使用SDS聚丙烯酰胺凝胶(12%分离胶和5%浓缩胶)进行蛋白的分离,考马斯亮蓝R-250进行胶体染色。经湿法转印技术将凝胶中蛋白转到PVDF膜,用5%脱脂奶粉对膜进行封闭,4 ℃轻摇过夜。加入一抗(1∶5000稀释)4 ℃孵育过夜,TBST清洗3次。加入二抗(1∶5000稀释)26 ℃轻摇1 h,TBST清洗3次,然后加适量显影液显影。显色带经扫描仪扫描后,用ImageJ软件进行灰度分析,计算CHS蛋白与内参Actin蛋白灰度值之比,获得CHS蛋白相对表达量。
2 结果与分析
2.1 两种茶叶中儿茶素含量分析
本研究首先采用HPLC法测定两种茶叶中的儿茶素含量及组成,结果如图1所示,两种茶叶展现不同的儿茶素代谢特征。英红9号(YH)中儿茶素总含量为181.51 mg/g,而南昆山毛叶茶(MY)中儿茶素总含量则为106.02 mg/g,YH中儿茶素含量远高于MY并且前者为后者的1.71倍,差异极显著(P<0.01)。在儿茶素组成上,YH以表型儿茶素为主,并占儿茶素总量的90.63%,其中ECG含量最高占到儿茶素总量的34.57%。MY中儿茶素组成则完全不同于YH,以非表型儿茶素为主,占儿茶素总量的70.48%,尤其GCG含量占总儿茶素的47.14%。两种茶叶在儿茶素含量及组成上均存在较大差异,可能受到基因表达的调控作用,值得进一步探究。

图1 儿茶素含量的测定Fig.1 Determination of catechin contents 注:C:儿茶素;GC:没食子儿茶素;CG:儿茶素没食子酸酯;GCG:没食子儿茶素没食子酸酯;EC:表儿茶素;ECG:表儿茶素没食子酸酯;EGC:表没食子儿茶素;EGCG:表没食子儿茶素没食子酸酯; **:差异极显著,P<0.01。

图3 CHS蛋白功能域分析Fig.3 Analysis of conserved domain in CHS protein注:▲为丙二酰-CoA结合位点,红色方框为FAE1_CUT1_RppA结构域,绿色方框为ACP_syn_III_C结构域。
2.2 CHS基因克隆与序列分析
为探明英红9号和南昆山毛叶茶儿茶素差异代谢的分子基础,本研究进而对儿茶素合成代谢起关键作用的CHS基因开展深入研究。以提取的mRNA经逆转录得到的cDNA为模板,利用设计合成的CHS基因特异性引物从两种茶叶中扩增靶序列,结果如图2所示,PCR扩增出1100 bp的产物。将条带回收后与pMD18-T载体连接并转化大肠杆菌DH5α。将获得的阳性克隆经PCR及测序鉴定后表明,MY和YH中所克隆的CHS基因均包含1170 bp的开放阅读框,两者核苷酸序列仅具有单个碱基的差异,但编码389个相同的氨基酸序列,其相对分子量为42.57 kDa,等电点为5.97。与NCBI的GenBank数据库比对分析发现,所克隆的两种茶叶中CHS基因与数据库中已登录的茶叶CHS基因(KY615681)氨基酸序列同源性均达100%。使用NCBI-CDS对基因的功能结构域分析表明,克隆CHS基因所编码的蛋白包含8个丙二酰-CoA结合位点,这些活性位点使底物与CHS蛋白结合发生催化反应,参与类黄酮途径,调控儿茶素的合成,并还含有FAE1_CUT1_RppA(pfam08392)和ACP_syn_III_C(pfam08541)等功能域(图3),说明所克隆得到的CHS基因具有生物学功能。

图2 CHS基因的PCR扩增电泳图Fig.2 PCR amplification electrophoresis results of CHS gene注:M:DNA标记;1,2:MY-CHS;3,4:YH-CHS。
2.3 CHS基因表达蛋白的亚细胞定位
为探明CHS蛋白功能,本研究对CHS基因表达蛋白亚细胞定位开展分析。利用DNA重组技术将克隆的CHS基因组装进重组表达载体pC1301-GFP,将得到的重组表达载体pC1301-GFP/CHS进行PCR和双酶切鉴定,电泳结果分析均得到1100 bp左右的目的条带(图4),进一步测序结果表明载体构建成功,可用于后续实验。利用 GFP 蛋白表达会发出绿色荧光这一便于观察的特点,将构建的载体转入农杆菌并注射烟草叶片下表面,培养后用激光共聚焦显微镜进行观察,激发光波长为488 nm,发射光波长640 nm。观察结果如图5所示。转pC1301-GFP空载体的烟草细胞内布满了绿色荧光,而转pC1301-GFP/CHS载体的烟草其细胞内绿色荧光主要分布在细胞质,细胞膜和细胞核中也有部分荧光信号,因此将CHS基因表达蛋白定位于细胞质、细胞膜和细胞核中。
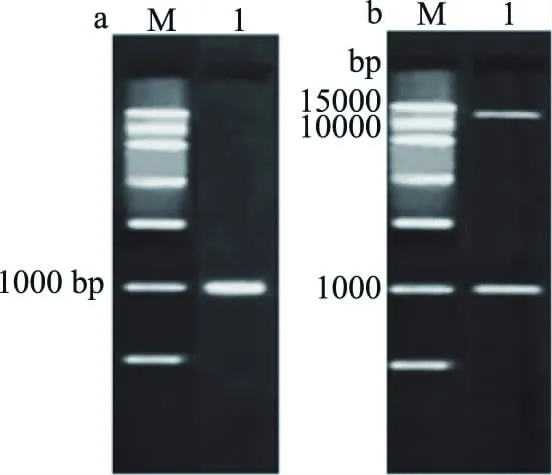
图4 重组载体PC1301-GFP/CHS鉴定Fig.4 Identification of recombinant vector PC1301-GFP/CHS注:a,M:DNA标记,1:PCR鉴定;b,M:DNA标记,1:双酶切鉴定。

图5 CHS在烟草中的亚细胞定位Fig.5 Subcellular localization of CHS in tobacco cell注:a:明场;b:荧光场;c:叶绿体自发荧光;d:叠加场。

表1 抗体效价检测Table 1 Detection of antibody titer
注:CHS抗体1和2为分别为免疫两只兔子合成的抗体。
2.4 CHS基因转录水平分析
为比较具差异儿茶素代谢的YH和MY两种茶叶中CHS基因表达情况,以提取mRNA反转录得到的cDNA为模板,选取GAPDH基因为内参,利用qRT-PCR对两种茶叶中的CHS基因进行了转录水平测定。结果如图6所示,CHS基因在YH中的相对表达量远高于MY,前者是后者的3.9倍,表达差异极显著(P<0.01),与儿茶素总量在两材料中的差异一致,表明CHS基因能够正向调控儿茶素的合成。
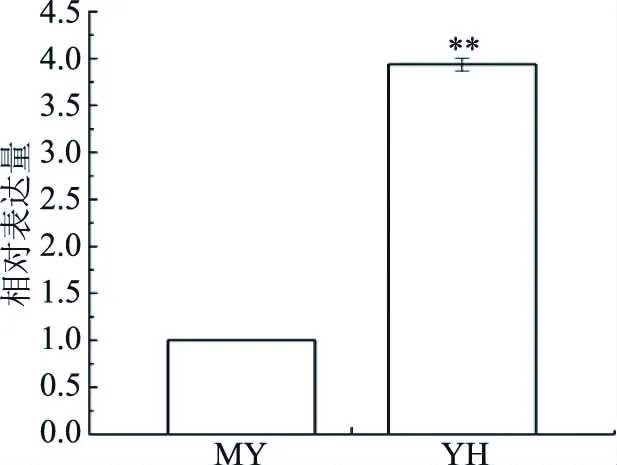
图6 CHS基因荧光定量PCRFig.6 qRT-PCR analysis of CHS gene注:**表示差异极显著,P<0.01。
2.5 CHS抗体制备与效价检测
功能基因在生物代谢及其调控中发挥重要角色,阐释功能基因的表达情况,尤其翻译水平与代谢的关系,成为生物代谢相关研究的重要环节[25]。生物体内基因表达蛋白的分析除了研究费用高昂的蛋白质组学外,主要是通过发展特异抗体用于检测基因翻译水平。为准确分析比较两茶叶体内CHS基因翻译水平差异,根据分析选取基因特定肽段经人工合成及修饰后免疫兔子获得多克隆抗体。相比原核表达蛋白制备的抗原,人工合成基因特定肽段制备抗原,其具有成分单一、灵敏度高、特异性强等优点[26]。并对纯化抗体通过间接ELISA法检测其效价,结果如表1所示。两只兔子来源的CHS抗体,浓度为1 μg/mL时,效价均达1∶80000,表明制备的多克隆抗体效价高,达到预期效果。基于CHS抗体1的效价高于CHS抗体2,选取CHS抗体1用于后续实验。
2.6 茶叶体内CHS基因翻译水平分析
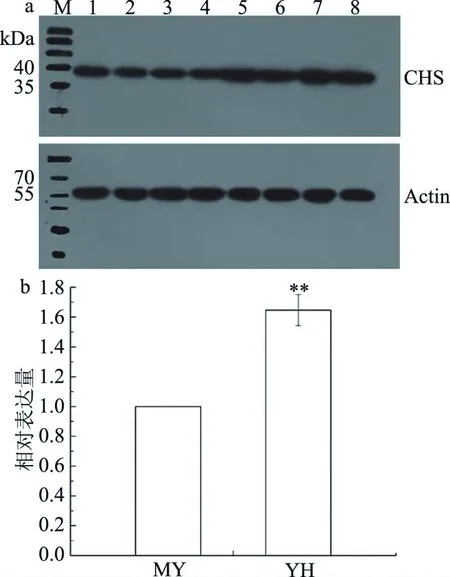
图7 CHS蛋白Western-blot 分析Fig.7 Western-blot analysis of CHS protein 注:a,M:标准预染蛋白,1~4:南昆山毛叶茶,5~8:英红9号;b,CHS蛋白与Actin蛋白灰度比值;**表示差异极显著,P<0.01。
为比较两种茶叶中CHS基因翻译水平的差异,将茶叶提取总蛋白SDS-PAGE电泳分离、转膜后,用制备的多克隆抗体按照Western-blot技术对CHS蛋白表达量进行测定分析(多克隆抗体为一抗,羊抗兔为二抗,Actin为内参)。结果显示(图7a),CHS仅在40 kDa左右有一特异性杂交条带,内参在55 kDa左右有一特异性杂交条带,均与实际分子量一致,表明制备的CHS多克隆抗体能特异检测出茶叶中的靶蛋白。利用灰度分析计算CHS蛋白与Actin内参蛋白表达量比值即相对表达量,结果如图7b所示,YH中CHS蛋白的相对表达量极显著高于MY(P<0.01)并达到1.7倍。CHS基因翻译水平与儿茶素总量在两种茶叶中的差异一致,从翻译水平进一步证明CHS基因正向调控儿茶素的合成。
3 结论
本研究通过RT-PCR从英红9号和南昆山毛叶茶中成功克隆得到1170 bp的CHS基因序列,在此基础上,根据其序列特点,选择特定肽段进行人工合成,制备成基因特定抗原后免疫动物,获得的多克隆抗体效价高,符合对靶蛋白精确定量的要求。研究表明,CHS基因在两种茶叶间的转录水平差异与儿茶素含量差异相一致,进一步的Western-blot杂交发现,CHS蛋白表达水平在高儿茶素茶叶体内的表达水平极显著高于低儿茶素含量的茶叶(P<0.01)。相关性分析表明,茶叶体内的儿茶素含量与CHS基因表达,无论在转录水平还是翻译水平均呈正相关,说明CHS基因正向调控儿茶素合成。亚细胞定位将CHS基因表达蛋白定位于细胞质、细胞膜和细胞核中。本研究所获得的茶叶CHS基因相关的生物学信息,及其与儿茶素积累的关系,为今后研究儿茶素代谢分子机制奠定了一定的基础。此外,本研究基于人工合成肽段发展茶叶CHS基因蛋白抗体所体现的简洁性、可靠性和高效性,为茶叶功能基因研究,尤其是为部分难以体外表达蛋白的基因制备抗体,提供了研究思路及技术参考。
