共表达鸡传染性法氏囊病病毒LX株VP2基因及鸡新城疫病毒PX02/3株F基因的重组火鸡疱疹病毒的构建
2020-03-31王子书杨大为李永清
王子书 , 王 萍 , 许 健 , 杨大为 , 李永清 , 江 波
(1.江西农业大学动物科学技术学院 , 江西 南昌 330045 ; 2.北京市农林科学院畜牧兽医研究所 畜禽疫病防控技术北京市重点实验室 , 北京 海淀 100097 ; 3. 北京市农林科学院畜禽疫病研究中心 , 北京 海淀 100097)
鸡新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的一种急性且高度传染性的疾病,是危害养禽业的最重要疾病之一[1]。NDV的表面糖蛋白F蛋白在调节病毒与受体细胞膜的融合以及病毒向体内的入侵中起关键作用,此外,F蛋白存在多处抗原位点能诱导机体产生中和抗体,使机体产生保护性免疫应答,是开发NDV亚单位疫苗的主要候选蛋白[2]。
传染性法氏囊病(Infectious bursal disease,IBD)是危害养禽业健康发展的重要免疫抑制病,传染性法氏囊病病毒(Infectious bursal disease virus,IBDV)是引起鸡传染性法氏囊病的病原[3]。VP2是IBDV的主要结构蛋白,与病毒毒力和细胞嗜性有关,同时VP2也是IBDV最主要保护性抗原,能诱导机体产生中和抗体[4]。有研究表明,IBDV VP2特异性抗体水平和保护率呈直接相关关系[5]。利用VP2蛋白制备疫苗能够有效预防和控制IBDV。
马立克病(Marek’s disease,MD)是由马立克病病毒(Marek’s disease virus,MDV)引起鸡的高度接触性传染病,其高死亡率对家禽业的健康发展构成严重威胁[6]。火鸡疱疹病毒(Herpesvirus of turkey,HVT)是从火鸡中分离得到的血清3型MDV,对鸡无致病性,宿主范围窄,具有良好的安全性和与MDV的交叉保护作用。它在鸡群中不能通过接触而发生水平传播,但可以在鸡体内持续存在,有利于外源基因的持续表达,并刺激机体产生更高的抗体水平。此外,HVT作为活病毒载体,有足够大的基因组,其复制非必需区可容纳较大的外源基因片段的插入,而不会影响其自身的复制和生物学特性,是比较理想的活病毒载体[7-9]。因此,HVT可以用作马立克病良好的异源疫苗。
本研究在HVT基因组的非必需区分别插入IBDV LX株VP2基因和NDV PX02/3株F基因的独立表达盒,其中VP2基因置于CMV启动子控制下,F基因表达盒使用了pec启动子,利用细菌人工染色体(BAC)技术和病毒拯救技术获得了同时表达NDV和IBDV保护性抗原基因的重组HVT病毒,为进一步研制同时防控鸡传染性法氏囊病、新城疫与马立克病的重组活载体疫苗以期降低疫苗使用成本,实现“一针多防”提供了科学依据。
1 材料与方法
1.1 质粒、病毒、细胞及工程菌 用于构建表达盒的真核质粒pVAX1和pCAGGS,购自美国Invitrogen公司;IBDV LX株为北京市农林科学院畜牧兽医研究所分离鉴定;基因VII型NDV PX02/3株由福建省农业科学院畜牧兽医研究所赠送;HVT FC126株,购自中国兽医药品监察所;含HVT-galk BAC质粒的大肠杆菌EL250株由本课题组保存。
1.2 主要试剂 限制性内切酶和T4 DNA连接酶,购自New England Biolabs安诺伦(北京)生物科技有限公司;Pfx高保真聚合酶、零背景快速连接试剂盒和感受态大肠杆菌细胞Top10,均购自天根生化科技(北京)有限公司;DL-2 000及DL-15 000 DNA marker,购自宝生物工程(大连)有限公司;质粒提取试剂盒,购自QIAGEN 公司;DMEM、opti-MEM和脂质体Lipofectamine 3000,均购自美国Invitrogen公司。
1.3 IBDVVP2及NDVF基因的克隆及序列优化 提取IBDV和NDV的病毒总RNA,反转录获得cDNA后分别以IBDVVP2基因特异性引物(5′-ATGACAAACCTGCAAGATCAAACC-3′,5′-CCTTATGG- CCCGGATTATGTCT-3′)和NDVF基因特异性引物(5′-CTCGAGATGGGCCCCAAATCTTCTACCAGG-G-3′,5′-CTCGAGTCACGCTCTTGTAGTGGCTCTCATC-3′)扩增IBDVVP2基因片段(1.35 kb)和NDVF基因片段(1.68 kb),同时设计引物在基因5′端引入Kozak序列(GCCACCAUGG)。
利用酶切位点KpnI/EcoR I和EcoR I/XhoⅠ将上述基因片段分别克隆到真核表达质粒pVAX1和pCAGGS中,构建重组表达质粒,命名为pVAX-VP2和pCAGGS-F。
1.4 重组HVT的转移载体pHVT-UL45-46及pHVT-US1-10 的构建 以HVT FC126株的基因组DNA为模板分别扩增HVT的复制非必需区US1和US10,并在US1的下游引入SalⅠ酶切位点及US10上游引入Hind Ⅲ酶切位点。采用重叠延伸PCR(Overlap extension PCR,OE-PCR)方法将US1与US10连接在一起,同时在US1与US10之间增加酶切位点SalⅠ/Hind Ⅲ,在US1片段上游与US10下游增加NotⅠ酶切位点。获得片段US1-SalⅠ-Hind Ⅲ-US10。同样的方法获得片段UL45-PacI-UL46。将上述片段分别克隆到pGEMT-Easy质粒(Promega公司)构建成重组质粒,并使它们的5′和3′端均带有NotⅠ酶切位点。重组质粒经测序正确后确定为转移载体。
1.5 携带IBDVVP2基因的重组HVT的转移载体构建 根据真核表达质粒pVAX的已知序列设计两端均带有PacI酶切位点的引物,从重组真核表达质粒pVAX-VP2中扩增出表达盒CMV-VP2-BGH基因片段,并在其两端引入PacI酶切位点;再将真核表达盒基因片段连接到pMD18-T载体,构建pCMV-VP2-BGH;PacI酶切pCMV-VP2-BGH及pHVT-UL45-46,然后将它们进行连接,获得重组转移载体pHVT-UL45-VP2-UL46。
1.6 携带NDVF基因的重组HVT的转移载体构建 利用SalⅠ和Hind Ⅲ限制性内切酶分别酶切含NDVF基因的真核重组质粒pCAGGS-F及重组HVT的转移载体pHVT-US1-10质粒,获得pec-NDV F-polyA的表达盒及带SalⅠ和Hind Ⅲ限制性内切酶位点的线性化pHVT-US1-10基因片段,再将上述基因片段进行连接,获得重组转移载体pHVT-US-F。
1.7 携带IBDVVP2基因的重组HVT细菌人工染色体(BAC)的构建 将转移载体pHVT-UL45-VP2-UL46采用NotI酶切后,胶回收酶切片段UL45-CMV-VP2-BGH polyA-UL46并测定浓度,同时将含HVT-galk BAC质粒的大肠杆菌EL250制备感受态细胞。将上述酶切产物加入感受态细胞中进行电转化。将电转化后的感受态细胞涂布到galk阴性筛选板(DOG板)上置于培养箱中培养,挑取单克隆采用VP2的特异性引物进行PCR鉴定,将鉴定阳性的单克隆进行纯化和进一步鉴定,即以UL45、UL46引物PCR鉴定表达盒插入的位置是否正确,从而获得HVT-VP2-BAC。最后提取重组HVT BAC的DNA,在鉴定其完整性后保存备用。
1.8 HVT-VP2-galk BAC的制备 利用设计带有HVT US1-10基因区中间位点两端序列的引物(5′-CATGCTGAAATGGGTAATCGCCTTATGAACATTAT-GTACTGGTGTTGCTTGGGACACGCCTGTTGACAATT AATCATCGGCA-3′;5′-TCTAATAAACTTAAAATGGC CTGATTCGTCTCGTACAACTGCCATATCGAGCATCA GCACTGTCCTGCTCCT-3′)对质粒pSK-galk进行galk基因的扩增,使galk基因的两侧分别带有 50 bp 的HVT US1-10基因序列;同时将已构建的含HVT-VP2-BAC质粒的大肠杆菌EL250制备感受态细胞,然后将纯化的galk基因的PCR产物电转化到含HVT-VP2-BAC的感受态细胞中。将电转化后的感受态细胞涂布在galk阳性筛选板上培养3 d后,以galk特异性引物筛选阳性克隆子,从而获得含HVT-VP2-galk BAC质粒的大肠杆菌EL250。
1.9 重组HVT-VP2-F BAC的构建 利用NotI酶切重组转移载体pHVT-US-F的质粒,胶回收酶切片段US1-pec-F-polyA-US10;同时以1.8构建的含HVT-VP2-galk BAC质粒的大肠杆菌EL250制备感受态细胞,同样将上述酶切片段电转化到含HVT-VP2-galk BAC细菌中,利用基因同源重组现象,使表达盒基因CAG-F-polyA替换了HVT-VP2-galk BAC中的galk基因,从而获得重组HVT-VP2-F BAC克隆。以NDVF基因的特异性引物对上述克隆子进行筛选和鉴定。
1.10 重组病毒rHVT-VP2-F的拯救 提取HVT-VP2-F BAC DNA,用LipofectamineTM3000脂质体转染试剂转染鸡胚成纤维(CEF)细胞,转染后置37 ℃ CO2培养箱培养3~5 d,经2~3次盲传后,可以观察到典型的HVT细胞病变(CPE)。收集有HVT病变的CEF细胞,一部分按常规方法进行液氮冻存,另一部分用于进行重组病毒的鉴定,进一步采用抗HVT鸡血清对重组病毒进行空斑染色和计数,以测定重组HVT的病毒滴度。
1.11 重组病毒rHVT-VP2-F的鉴定 取病变重组病毒总DNA,PCR检测VP2和F基因;取病变的细胞加入6×Loading buffer后煮沸5 min,分别以抗VP2蛋白单抗(1∶5 000)和抗NDV鸡血清(1∶500)为一抗,利用Western Blot检测重组病毒中外源蛋白VP2和F的表达;将重组病毒接种6孔板的CEF细胞,培养3 d 后,分别采用抗IBDV鸡血清(1∶100)和抗NDV鸡血清(1∶200)进行间接免疫荧光(IFA)检测VP2蛋白和F蛋白的表达。
重组三联病毒构建流程图见中插彩版图1。

2 结果
2.1 携带IBDVVP2基因和NDVF基因的重组HVT的转移载体 将获得的重组转移载体pHVT-UL45-VP2-UL46用PacI限制性内切酶可将转移载体酶切为大约6 000 bp和2 000 bp的片段,与预期结果一致(图2A)。将获得的重组转移载体pHVT-US-F用NotI进行酶切鉴定。结果显示,NotI能将该重组转移载体酶切成约6 000 bp和3 000 bp的片段,与预期大小一致(图2B)。
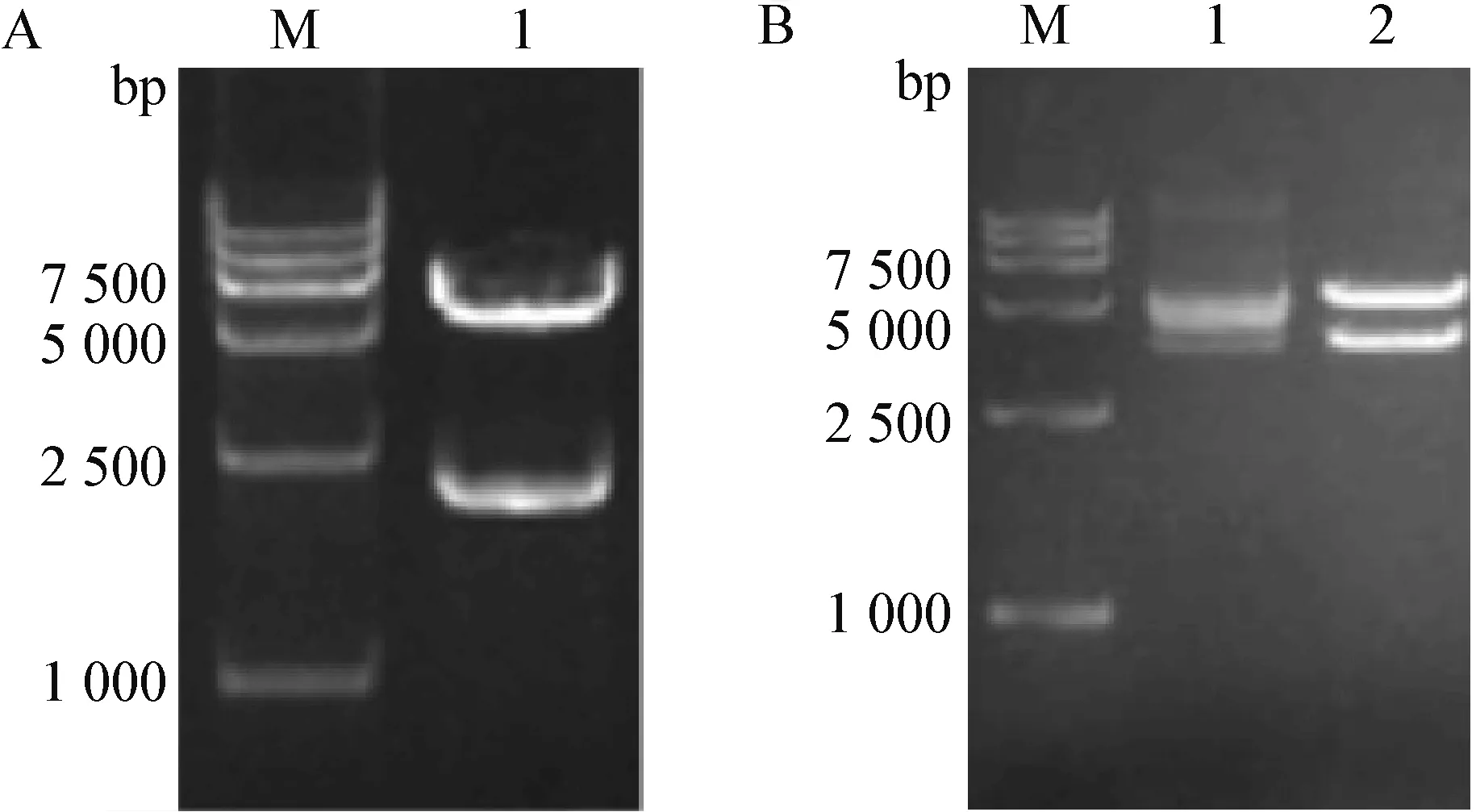
图2 重组转移载体pHVT-CMV-VP2-BGH、重组转移载体pHVT-US-F的PCR鉴定Fig.2 PCR of recombinant transfer vector pHVT-CMV-VP2-BGH and recombinant transfer vector pHVT-US-FA:Pac I酶切鉴定结果; M:DNA标准分子量DL-15 000; 1:Pac I酶切产物; B:Not I酶切鉴定结果; M:DNA标准分子量DL-15 000; 1:重组质粒; 2:Not I酶切产物A:The result of Pac I digestion; M:DL-15 000 marker; 1:Digested products of Pac I; B:The result of Not I digestion; M:DL-15 000 marker; 1:Recombinant plasmid; 2:Digested products of Not I
2.2 重组HVT-VP2 BAC的构建 将DNA片段UL45-CMV-VP2-BGH-UL46(约4 000 bp)电转化含HVT-galk BAC的大肠杆菌感受态细胞。转染后细菌在DOG选择培养平皿上生长5 d后,利用IBDVVP2引物进行重组克隆菌株的筛选,结果有3个菌落能被扩增出约1 400 bp的目的片段(图3)。

图3 重组HVT-VP2 BAC的PCR鉴定Fig.3 PCR of recombinant HVT-VP2 BACM:DNA标准分子量DL-2 000; 1~5:重组HVT-VP2 BAC的PCR产物M:DL-2 000 marker; 1~5:PCR products of recombinant HVT-VP2 BAC
2.3 重组HVT-VP2-F BAC的构建 将NotI酶切的DNA片段US1-pec-F-polyA-US10转染到按1.8构建的含HVT-VP2-galk BAC大肠杆菌感受态细胞中,复苏后的细菌在DOG培养板生长3~5 d后,挑取单个菌落以NDVF基因的引物筛选阳性重组子。结果有4个菌落能被扩增出约1 700 bp的目的片段(图4)。

图4 HVT-VP2-F BAC的PCR鉴定Fig.4 PCR of recombinant HVT-VP2-F BACM: DNA标准分子量DL-2 000; 1~11:重组HVT-VP2-F BAC的PCR产物M:DL-2 000 marker; 1~11:PCR products of recombinant HVT-VP2-F BAC
2.4 重组病毒rHVT-VP2-F的体外生物学特性鉴定
2.4.1 PCR鉴定重组病毒IBDVVP2及NDVF基因的整合 以P3代重组病毒rHVT-VP2-F感染CEF,待出现典型的细胞病变后,提取病毒感染的细胞DNA,首先要确定目的基因VP2和F是否整合到靶细胞的基因组中,因此提取获得的病毒的总DNA,分别以IBDVVP2以及NDVF的特异性引物进行扩增,并以galk基因的特异性引物作为对照。结果显示,rHVT-VP2-F能扩增出大小约1 700 bp的NDVF基因片段以及1 400 bp的IBDVVP2基因片段,均与预期相符,而galk特异性引物不能扩增出任何片段(图5),说明IBDVVP2以及NDVF同时整合到重组HVT基因组中,并在病毒感染的细胞中复制。

图5 重组HVT-VP2-F的PCR鉴定Fig.5 PCR of recombinant HVT-VP2-FM:DNA标准分子量DL-2 000; 1:IBDV VP2引物扩增产物; 2:NDV F引物扩增产物; 3:galk引物扩增产物M:DL-2 000 marker; 1:Amplification products of IBDV VP2 primer; 2:Amplification products of NDV F primer; 3:Amplification products of galk primer
2.4.2 Western Blot鉴定重组病毒感染CEF后外源基因的表达 将rHVT-VP2-F第3代细胞毒感染的CEF进行Western Blot鉴定。一抗用IBDV VP2单抗和抗NDV鸡血清,结果显示,条带大小与预期蛋白大小相符,大小约50 kDa和65 kDa。而亲本HVT感染CEF对照则未见任何反应条带,说明重组rHVT-VP2-F感染CEF后表达了IBDV VP2蛋白和NDV F蛋白(见中插彩版图6)。

2.4.3 IFA鉴定重组病毒rHVT-VP2-F感染CEF后外源基因的表达 将rHVT-VP2-F第3代病毒接种CEF,待细胞出现50%的病变后,固定CEF分别以抗IBDV鸡血清及抗NDV鸡血清为一抗进行IFA鉴定。结果表明:2种血清均能结合rHVT-VP2-F感染CEF,并在倒置荧光显微镜下观察到典型的黄绿色荧光的空斑(见中插彩版图7)。

2.4.4 重组病毒rHVT-VP2-F生长形态及滴度的测定 将重组病毒rHVT-VP2-F按照10-3、10-4和10-5三个稀释度接种CEF细胞4 d后,进行蚀斑试验检测。重组病毒rHVT-VP2-F和亲本HVT产生的蚀斑形态没有明显差别(见中插彩版图8),分别感染CEF 4 d后检测病毒滴度,亲本HVT病毒为1×105PFU/mL,重组病毒rHVT-VP2-F为9.5×104PFU/mL,两者无明显差异。

3 讨论
鸡新城疫、传染性法氏囊病以及马立克病均具有高发病率和高死亡率的特点,对养禽业危害巨大,严重威胁我国养禽业的健康发展。疫苗免疫是预防和控制这3种疾病最有效的措施。然而,传统疫苗是一种疫苗只能预防一种疾病。因此,研发一种既安全又有效的三价疫苗可同时预防这3种疾病,对实际生产具有重大意义。
基因工程重组活载体疫苗是利用基因工程技术将一种或几种病原的保护性抗原基因插入到活载体中。并使之在体内表达出保护性抗原的活疫苗,包括重组细菌载体活疫苗和重组病毒载体活疫苗[10]。该疫苗具有很多优点:首先,它可以降低生产成本,更廉价地批量生产;其次,易于区分感染动物和免疫动物;再者,可以使用活载体制备多价疫苗,达到一针防多病的目的。疱疹病毒的基因组庞大,有许多复制非必需区,并且具有很强的容纳外源基因的能力,可以插入多个外源基因,而且遗传稳定,受母源抗体影响较小,是良好的重组疫苗载体[12]。HVT活载体疫苗是基因工程疫苗研究的热点,被认为是构建表达外源抗原基因并诱导产生保护性免疫的多价重组活疫苗最有效的载体之一,是安全有效的抗MDV疫苗。目前,重组疱疹病毒的构建主要基于BAC的感染性克隆,对病毒的基因组采用重组工程技术进行修饰[11]。普遍使用的方法是将HVT基因组克隆细菌人工染色体(BAC)中,利用反向遗传操作,使病毒的保护性抗原基因快速定向地插入到HVT基因组中[7]。HVT作为家禽疫苗载体具有良好的应用前景,新城疫、传染性法氏囊病等多种禽病保护性抗原均已在HVT载体中成功表达,重组HVT(rHVT)疫苗在美国、巴西等国家已被广泛使用[13-14]。机体产生免疫应答主要依靠抗原表位,制备基因工程疫苗时截取主要抗原表位更有利于疫病的防控。刘红梅等[15]将VP2基因插入CVI988疫苗株的非必需区US10片段中,成功表达VP2蛋白,攻毒保护试验表明,构建的表达IBDV VP2蛋白的rMDV可以使机体产生保护性免疫应答。Kenji等[16]通过在CVI-988疫苗株的US2位点表达VP2抗原,可以构建安全且有效的重组疱疹病毒的IBD亚单位疫苗。Liu等[2]利用干酪乳杆菌表达系统表达NDV F部分主要抗原表位蛋白,免疫保护试验和攻毒保护性试验表明,重组干酪乳杆菌pLA-NDV-F/L.casei能为机体提供免疫保护作用。
本研究以HVT为载体,利用同源重组的方法,选择UL45-46非必需区和US1-10非必需区作为外源基因的插入位点,构建表达IBDVVP2基因和NDVF基因的重组病毒rHVT-VP2-F。分别以IBDVVP2基因和NDVF基因的特异性引物对重组病毒进行筛选和鉴定,采用抗HVT鸡血清对重组病毒进行空斑染色和计数,以测定重组HVT的病毒滴度。IBDVVP2和NDVF基因能否在重组病毒感染的CEF中表达并获得抗原性蛋白,对其免疫后是否产生保护力至关重要,将rHVT-VP2-F第3代细胞毒感染的CEF进行Western Blot和IFA鉴定,结果显示,VP2和F蛋白获得表达。本研究构建的重组病毒,为研究rHVT-VP2-F三联活载体疫苗提供候选病毒株提供了科学依据。
