猪伪狂犬病病毒HNJY株的分离鉴定及其基因序列分析
2020-03-30张中华吴凤笋吕玉金刘玲玲张世军李文刚
张中华 , 吴凤笋 , 吕玉金 , 刘玲玲 , 张世军 , 李文刚
(1.河南农业大学牧医工程学院 , 河南 郑州 450002 ; 2.河南牧业经济学院动物医药学院 , 河南 郑州 450046)
猪伪狂犬病(Pseudorabies,PR)是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的多种家畜和野生动物的一种急性、热性传染病,主要临床症状为发热、奇痒、急性脑脊髓炎和繁殖障碍[1-2]。猪是PRV唯一的自然宿主和储存宿主,造成妊娠母猪流产,产死胎或木乃伊胎,哺乳仔猪高死亡率,给养猪业造成极大的经济损失[3-4]。
2011年底,我国PR疫情出现了新的变化[5],许多免疫过PRV疫苗的猪场和野毒抗体检测阴性的猪场,甚至是一些已经宣布净化PRV的猪场都出现了PR的疫情。为了解PRV的流行趋势及变异情况,本试验对2018年采集于河南省济源市某猪场的疑似猪伪狂犬病病料组织,进行PRV分离鉴定,以期获得PRV分离株的生物学特性,为有效防控PR提供理论参考依据。
1 材料与方法
1.1 材料
1.1.1 病料、阳性毒株、细胞及实验动物 病料组织于2018年1月采集自河南省济源市某猪场疑似感染PRV的病猪;PRV阳性对照毒株Min-A株、猪肾细胞(PK-15)由本实验室保存;6周龄SPF级BALB/c雌性小鼠,购自郑州大学实验动物中心。
1.1.2 主要试剂 pMD18-T Vector(2 692 bp)、ExTaq酶、Primer STAR GXL DNA Polymerase,均购自宝生物工程(大连)有限公司;HiPure Viral RNA/DNA Kit,购自广州美基生物科技有限公司;5×All-In-One RT Master Mix,购自Abcam公司;Ezup柱式病毒DNA抽提试剂盒、SanPrep柱式DNA胶回收试剂盒、SanPrep柱式质粒DNA小量抽提试剂盒,均购自生工生物工程(上海)股份有限公司;2×GC-Rich PCR Master Mix、Tailing-A Reaction Kit,均购自天根生化科技(北京)有限公司。
1.2 试验方法
1.2.1 病料组织的采集与处理 在无菌条件下取疑似患猪伪狂犬病病死猪的肺、肾、脾、脑等组织,按1∶5加入PBS充分研磨制成悬液。反复冻融3次,4 ℃,4 000 g离心15 min,取上清经0.22 μm滤膜过滤后放-80 ℃备用。
1.2.2 引物设计与合成 PRV、猪细小病毒(Porcine parvovirus,PPV)、圆环病毒2型(Circovirus type 2,PCV2)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、日本乙型脑炎病毒(Japanese encephalitis virus,JEV)和猪瘟病毒(Classical swine fever virus,CSFV)的鉴定引物为本实验室保存[6]。参照GenBank中发布的PRV序列(登录号:JF797219.1)设计4对引物分别扩增PRVgE、gB、gD、TK基因,参考文献[7]合成引物扩增gC基因。引物由生工生物工程(上海)股份有限公司合成。
1.2.3 病料组织的PCR鉴定 用HiPure Viral RNA/DNA Kit提取病料组织的RNA/DNA,按照Abcam公司RNA反转录试剂盒说明书获取cDNA。以提取的DNA或cDNA为模板进行PRV、PPV、PCV2、PRRSV、JEV和CSFV的 PCR鉴定。
1.2.4 病毒的分离与纯化 将处理过的组织病料上清经0.22 μm滤膜过滤并经双抗过夜处理后,接种至PK-15细胞,待细胞病变(Cytopathic effect,CPE)达到80%时收毒。经PCR鉴定,3轮空斑纯化后,在PK-15细胞上传代至稳定出现CPE时收毒。
1.2.5 分离株半数组织培养感染剂量(Tissue culture infectious dose 50,TCID50)的测定 取分离株病毒液用细胞维持液作连续10倍稀释,按100 μL/孔接种到96孔细胞培养板上,并设阴性对照,观察至第4~5天。记录细胞出现CPE孔数,取3次重复试验的平均值,按照Reed-Muench两氏法计算病毒的TCID50值。
1.2.6 分离株对小鼠的致病性试验 将48只6周龄BALB/c雌性小鼠随机分成6组,分别接种106.71、105.71、104.71、103.71、102.71TCID50/0.1 mL病毒液,同时接种DMEM作阴性对照,接种剂量均为100 μL/只,记录小鼠的死亡情况,计算分离株的半数致死量(Median lethal dose,LD50)。
1.2.7 分离株gE、gB、gC、gD及TK基因的克隆、测序鉴定及序列分析 以Ezup柱式病毒DNA抽提试剂盒提取纯化的病毒DNA,以此为模板扩增gE、gB、gC、TK、gD基因。将各基因扩增产物用1%(gE、gB)或1.5%(gC、gD和TK)琼脂糖凝胶电泳检测,并进行胶回收纯化;由于本试验使用的高保真酶扩增的目的片段为不带A尾的平末端DNA片段,因此需对目的片段加A后,克隆入pMD18-T Vector。经将双酶切鉴定为阳性的gE、gB、gC、gD、TK重组质粒送生工生物工程(上海)股份有限公司测序。
用DNASTAR.Lasergene.v 7.1中的MegAlign与GenBank中收录的国内外其他PRV毒株的gE、gB、gC、gD、TK基因序列进行比较分析,并使用MEGA 7软件中的Neighbor-Joining方法构建氨基酸进化树,分析PRV分离株的遗传序列特性。
2 结果
2.1 病料组织中PRV的PCR鉴定 以病料中提取的DNA为模板,用PRV鉴定引物进行扩增,得到1条约166 bp的条带,与阳性对照Min-A株得到的条带大小一致,如图1;以DNA和cDNA为模板进行其他病原的鉴定,分别得到152、198 bp和91 bp的目的片段,如图2。结果表明,病料中不仅有PRV感染,同时有PPV、PRRSV和CSFV混合感染。
图1 病料组织中PRV的PCR鉴定Fig.1 Identification of PRV in diseased tissue by PCRM:DL-500 DNA相对分子质量标准; 1:阳性对照(Min-A株);2:待检病料; 3:阴性对照M:DL-500 DNA marker; 1:Positive control (Min-A strain); 2: Diseased tissue; 3:Negative control

图2 病料组织中其他病原的PCR鉴定Fig.2 Identification of other pathogens in diseased tissue by PCRM:DL-500 DNA相对分子质量标准; 1:PPV; 2:PCV2;3:PRRSV; 4:JEV; 5:CSFVM:DL-500 DNA marker; 1:PPV;2:PCV2; 3:PRRSV; 4:JEV; 5:CSFV
2.2 病毒的分离与纯化 将处理过的病料组织接种至PK-15细胞,1~2 d后出现明显的细胞病变。用甲醛结晶紫溶液对病毒进行空斑染色,对空斑纯化后的病毒液进行PCR鉴定,扩增出1条约166 bp的特异性条带,如图3,与预期结果一致,成功分离到1株PRV毒株,命名为HNJY。

图3 空斑纯化细胞毒液PRV鉴定Fig.3 Identification of pathogens alter PRV cellsM:DL-500 DNA相对分子质量标准; 1:阳性对照; 2:空斑纯化后细胞上清; 3:正常细胞上清M:DL-500 DNA marker; 1:Positive control; 2:Cell supernatant inoculated with PRV; 3:Normal cell supernatant
2.3 分离毒株滴度测定 HNJY株病毒液连续10倍稀释,按100 μL/孔接种到96孔细胞培养板上,连续观察记录,10-1~10-8稀释全部出现CPE,10-9稀释有2个孔出现CPE,10-10稀释无细胞病变。采用Reed-Muench两氏法计算测得分离病毒的TCID50值为108.7/0.1 mL。
2.4 分离株HNJY对小鼠的致病性试验 TCID50为106.71/0.1 mL感染组小鼠在注射后46 h开始出现临床症状,52 h开始死亡,86 h内全部死亡;105.71/0.1 mL感染组121 h内死亡5只,其余存活;104.71/0.1 mL感染组在118 h内死亡2只,其余存活;103.71/0.1 mL、102.71/0.1 mL和对照组小鼠无死亡。具体情况见表1。采用Reed-Muench两氏法计算HNJY株对小鼠的LD50为105.31TCID50/0.1 mL。以上感染死亡小鼠均出现奇痒、脱毛、抓咬注射部位、注射部位溃烂等症状。

表1 HNJY株LD50的测定Table 1 Determination of LD50 of HNJY strain
2.5 分离株gE、gB、gC、gD和TK基因的扩增gE、gB、gC、gD和TK基因的扩增产物经琼脂糖凝胶电泳,结果如图4。分别得到约2 061、2 877、1 696、1 367 bp和1 139 bp的目的条带,与预期结果一致。

图4 PRV gE、gB、gC、gD及TK基因全长的扩增Fig.4 Full-length amplification of PRV gE、gB、gC、gD and TK gene M1:DL-5 000 DNA相对分子质量标准; M2:DL-2 000 DNA相对分子质量标准; A:gE; B:gB; C:gC; D:gD; E:TK; 1:HNJY株; 2:阳性对照(Min-A株)M1:DL-5 000 DNA marker; M2: DL-2 000 DNA marker; A:gE; B:gB; C:gC; D:gD; E:TK; 1: HNJY strain; 2: Positive control (Min-A strain)
2.6 分离株gE、gB、gC、gD、TK基因核苷酸及氨基酸序列同源性分析 分离株gE、gB、gC、gD、TK基因核苷酸及氨基酸与欧美毒株和国内分离毒株进行比较分析。结果显示:HNJY分离株的gE、gB、gD、gC基因与国内分离株同源性要高于欧美毒株,gC基因与2011年之后分离的国内变异株同源性更高一些,TK基因与国内外毒株同源性高,该基因保守性高,见表2、3。
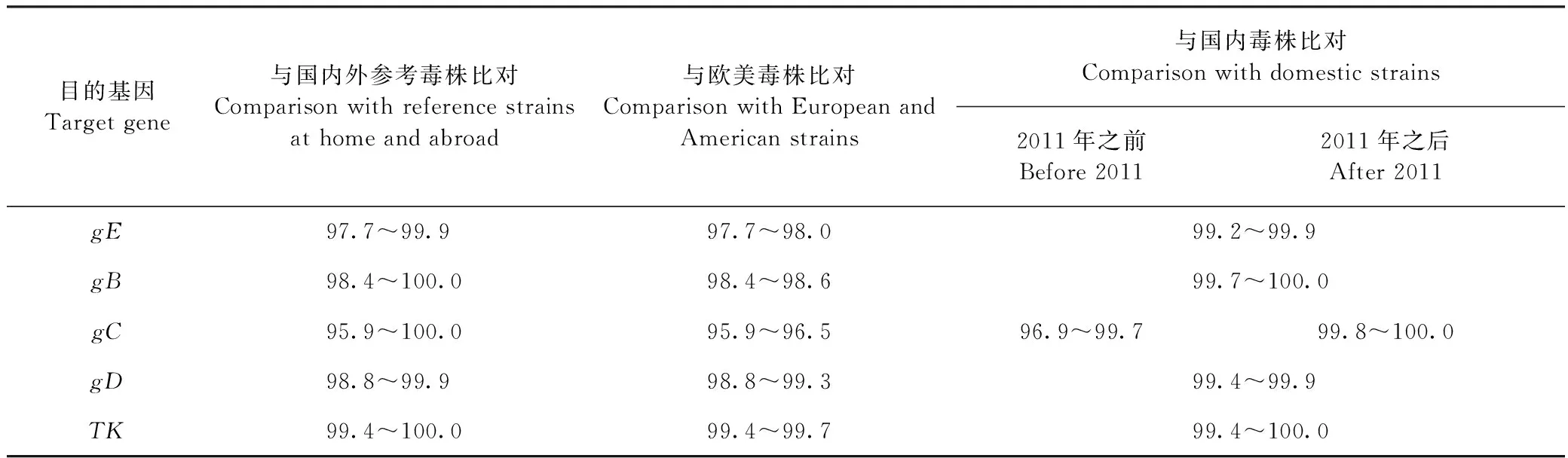
表2 HNJY株与参考毒株gE、gB、gC、gD、TK基因核苷酸序列同源性比对Table 2 HNJY strain and reference strains gE,gB,gC,gD,TK gene nucleotide sequence homology alignment (%)

表3 HNJY株与参考毒株gE、gB、gC、gD、TK基因氨基酸序列同源性比对Table 3 HNJY strain and reference strains gE,gB,gC,gD,TK gene amino acid sequence homology alignment (%)
2.7gE、gB、gC、gD、TK基因氨基酸遗传进化分析 根据GenBank中已发表的19株国内外参考毒株运用MEGA 7软件使用Neighbor-Joining方法进行氨基酸进化树分析。结果显示:HNJY株gE、gB、gC、gD基因与欧美毒株在不同的大分支,亲缘关系最远,与国内2011年以前分离的毒株同在1个大分支上,与2011年以后分离的毒株亲缘关系最近;TK基因与来自不同分离年代及地点的PRV分离株亲缘关系均较近,说明TK基因保守性高,见图5。

图5 gE、gB、gC、gD、TK基因氨基酸进化树Fig.5 Amino acid evolution tree of gE,gB,gC,gD and TK genesA:gE; B:gB; C:gC; D:gD; E:TK
2.8gE、gB、gC、gD基因氨基酸序列分析 分离株HNJY株与国内分离毒株氨基酸相比只有gD基因在256位由丙氨酸突变为苏氨酸,gE、gB、gC基因氨基酸与国内分离毒株没有变化。与欧美毒株比较gE氨基酸序列有14处差异,gB氨基酸序列有15处差异,gC基因氨基酸序列有6处差异,gD基因在344位由谷氨酰胺突变为脯氨酸,在348位由脯氨酸突变为苏氨酸。
3 讨论
本试验分离株HNJY株的TCID50为10﹣8.7/0.1 mL,刘正飞等[8]与陈焕春等[9]测定的国内毒株Min-A株和Ea株的TCID50分别为10﹣7.9/0.1 mL 和10﹣8.08/0.1 mL,说明HNJY株与经典毒株Ea株和Min-A株的TCID50相当,说明近些年PR的流行与PRV的毒力没有关系。通过腹股沟皮下注射小鼠测得LD50为105.31TCID50,Luo等[10]测得TJ株和SC株的LD50分别为102.3TCID50和103.3TCID50;向柯宇[11]测得HeN1株的LD50为102.37TCID50,说明分离株HNJY的致病力相对较弱。
HNJY株与国内外参考毒株序列同源性比对结果分析表明:HNJY株gE、gB、gC、gD基因与国内毒株的同源性均高于欧美毒株,且分离株HNJYgC基因与2011年之后的国内毒株同源性均高于2011年之前国内分离毒株,说明HNJY株属于近年来国内变异株。HNJY株与国内外参考毒株氨基酸序列分析结果显示:gE氨基酸在59、63、106、149、179、181、215、216、472、474、504、509、522、526位(以中国毒株位置为准)与欧美毒株有差异,与陈超[12]研究欧美毒株和亚洲毒株的氨基酸差异分析结果一致,说明这些差异可以作为鉴别PRV亚洲毒株和欧美毒株的标志。gE基因是PRV主要的毒力基因,氨基酸的差异对PRV毒力的影响,还需进一步的研究。gB氨基酸分析表明,中国毒株和欧美毒株在53、55、70、81、82、83、87、93、94、96、102、557、678、847、854、856、915、921位(以中国毒株位置为准)有差异,推断这些差异可以作为gB基因鉴定国内毒株和欧美毒株的标志。gB基因是PRV的重要保护性抗原基因之一[13],所以gB基因的氨基酸变化对其抗原性的影响如何,还待深入研究。gC氨基酸分析表明,亚洲毒株和欧美毒株在431、449、457、461、467、468位(以亚洲毒株位置为准)有差异,结果显示,氨基酸突变位点主要发生在431~468位。有研究表明,在436~470位氨基酸为gC蛋白跨膜区,其中含有α-螺旋结构的疏水区,这一区域作用是使PRV稳定附着在细胞表面[14]。但这一区域的氨基酸突变对PRV吸附的作用影响如何,还需进一步研究。gD氨基酸分析表明,国内分离株与5株欧美毒株相比,在344位由谷氨酰胺突变为脯氨酸,在348位由脯氨酸突变为苏氨酸。HNJY株与国内外参考毒株相比,在256位由丙氨酸突变为苏氨酸,但此氨基酸突变对PRV毒株生物学特性的影响还需进行深入研究。gE、gB、gC、gD、TK基因氨基酸进化树分析表明,gE、gB基因可以作为鉴别欧美毒株和亚洲毒株的标识基因,gC基因遗传距离与分离年代有一定联系,gD、TK基因遗传进化与分离年代没有关联。
