利福昔明软膏剂中药物含量检测方法的建立
2020-04-01蒋玲玉李秀波
查 娜 , 徐 飞 , 蒋玲玉 , 李秀波
(中国农业科学院饲料研究所 国家饲料药物基准实验室 , 北京 海淀 100081)
奶牛蹄病是奶牛业常见的重要疾病之一,该病轻则引起奶牛跛行,重则引起奶牛生产性能下降甚至淘汰。引起奶牛蹄炎的主要致病菌是链球菌、大肠埃希菌、沙门菌和酵母菌等病原菌[1],目前在临床上治疗方法主要是药物溶液浸泡或者肌内注射普鲁卡因青霉素等抗生素[2-4]。这些方法的弊端是只能改善牛的跛行症状,但不能从牛群中彻底消灭该病,此外药物浸泡的方法也会对土壤和水体造成污染。利福昔明[5](Rifaximin)属利福霉素类衍生物,是首个非氨基糖苷类半合成抗菌药,具有局部给药的独特优势:它口服不易吸收、安全、高效、低残留且抗菌谱广,对大多数环境菌有较好疗效。在奶牛乳房炎和奶牛子宫炎症的防治上具有较好的应用[6]。开发利福昔明局部给药制剂对治疗奶牛临床疾病具有非常明显的优势,同时也可以有效预防用药后耐药性的产生,以达到预防和治疗动物疾病,减少养殖业的经济损失的目的,具有非常广阔的应用前景。
本试验室开发了一种奶牛蹄病局部用利福昔明软膏剂。为了进一步评价该制剂的质量情况,本试验开发并建立了该利福昔明软膏剂中药物含量的检测方法,并应用于该制剂的稳定性试验评价中。
1 材料与方法
1.1 材料 高效液相色谱仪(Waters 2695),购自美国Waters公司;色谱柱:WondaSil C18-WR 250 mm×4.6 mm,5 μm,日本岛津公司;凡士林、丙三醇、羊毛脂,均购自国药集团;利福昔明软膏剂(15 g∶45 mg), 由中国农业科学院饲料研究所国家饲料药物基准实验室自主研发;利福昔明对照品(含量为95.7%,批次为130542-200601),购自中国药品生物制品检定所;利福昔明原料药(含量为98.1%,批次为80621-91-4),购自浙江思贤制药有限公司。
1.2 方法
1.2.1 利福昔明软膏剂的制备 将利福昔明无菌粉经超微粉碎得到利福昔明无菌微粉,按比例加入凡士林[7]、乳化剂以及防冻剂溶剂,35 ℃条件下150 r/min 持续搅拌0.5 h后,加入利福昔明药物,继续搅拌1 h得最终制剂。
1.2.2 利福昔明软膏剂中药物含量方法建立
1.2.2.1 色谱条件 流动相A为甲醇,流动相D为0.1%(v/v)甲酸水溶液。程序梯度见表1;柱温:40 ℃;进样量:20 μL;检测波长:276 nm。
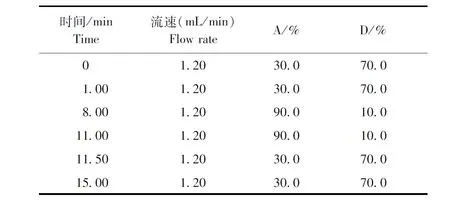
表1 利福昔明的流动相梯度及流速Table 1 Mobile phase gradient and flow rate of rifximine
1.2.2.2 对照品工作溶液配制 精密称取利福昔明对照品10.45 mg(相当于利福昔明10.00 mg),将称量的对照品用甲醇溶解稀释,再转移至100 mL容量瓶中,定容,最终制备成 100 μg/mL 的对照品工作液。分别取适量并用甲醇稀释为60 μg/mL的工作液,进样20 μL至液相色谱仪,记录色谱图,按外标法以峰面积计算。
1.2.2.3 样品前处理 精密称取利福昔明软膏剂1.0 g(相当于利福昔明3.0 mg)于50 mL离心管中,加入乙腈25 mL,涡旋5 min,置于25 ℃超声水浴中30 min,4 000 r/min离心5 min;将上清液转移至50 mL 容量瓶中,加乙腈稀释至刻度,摇匀,精密量取上层溶液20 μL,注入液相色谱仪,记录色谱图[8-9]。
1.2.2.4 系统适应性试验 参考《中国兽药典》(2015年版)附录66要求,将供试品储备液用流动相稀释成浓度为60 μg/mL的溶液,取20 μL注入高效液相色谱仪,记录对称因子、理论塔板数。将对照品储备液稀释成浓度为60 μg/mL的对照品溶液,取20 μL注入高效液相色谱仪,连续进样5针,考察重复性。
1.2.2.5 方法专属性 考察了空白流动相、空白辅料、对照品(60 μg/mL)及供试品(60 μg/mL)的方法色谱行为。
1.2.2.6 方法确证 通过检测限、定量限、准确度、精密度和线性范围共5个方面进行考察。采用逐步稀释的方法[10],按信噪比S/N≥3和S/N≥10计算检测限和定量限;将利福昔明软膏剂配方,配成高、中、低3个浓度的样品(15 g∶54 mg、15 g∶45 mg、15 g ∶36 mg),按照利福昔明软膏剂含量测定所示方法处理样品,日内测5次,共测5 d,通过计算回收率考察准确度;线性范围是将利福昔明对照品制备成不同浓度的工作溶液,浓度分别为40、50、80、100、120 μg /mL和160 μg /mL,按照HPLC(高效液相色谱)法进行检测[11],以峰面积对浓度作线性回归,求出回归方程及相关系数;精密度考察是将利福昔明软膏剂按照1.2.2.1的色谱条件和1.2.2.3的样品处理方法,配制成浓度为60 μg /mL的溶液进行测定,以利福昔明峰面积计算回收率及变异系数。
2 结果
2.1 方法专属性和系统适应性
2.1.1 方法专属性 取空白流动相20 μL注入液相色谱仪,结果表明,空白流动相对检测并无干扰。将凡士林、羊毛脂及丙三醇按照比例制成无药物添加的空白辅料,按照1.2.2.3方法处理后取20 μL进行检测,结果表明,空白辅料对药物峰无明显干扰。以1.2.2.2和1.2.2.3所述方法操作分别得到利福昔明标准品色谱图(图1)及利福昔明软膏剂药物主峰色谱图(图2)。从图中结果可见,利福昔明主成分峰与其他色谱峰完全分离,说明方法专属性良好。
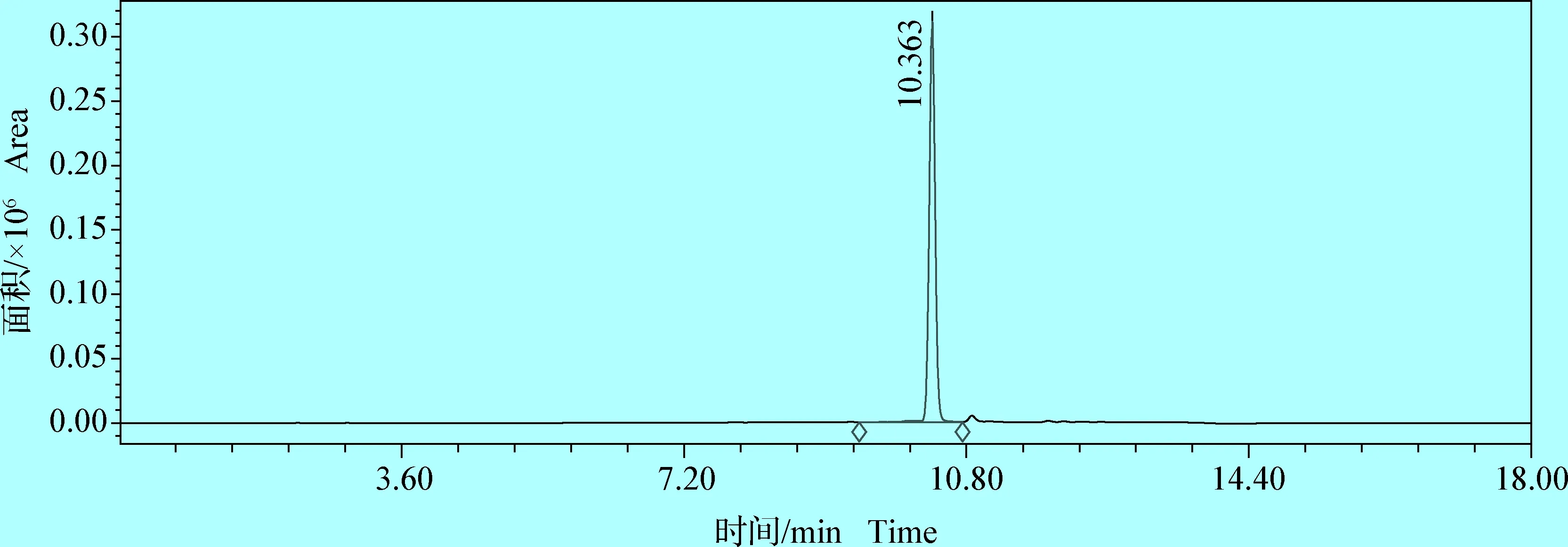
图1 利福昔明标准品溶液色谱图(60 μg/mL)Fig.1 Solution chromatogram of rifaximin standard(60 μg/mL)
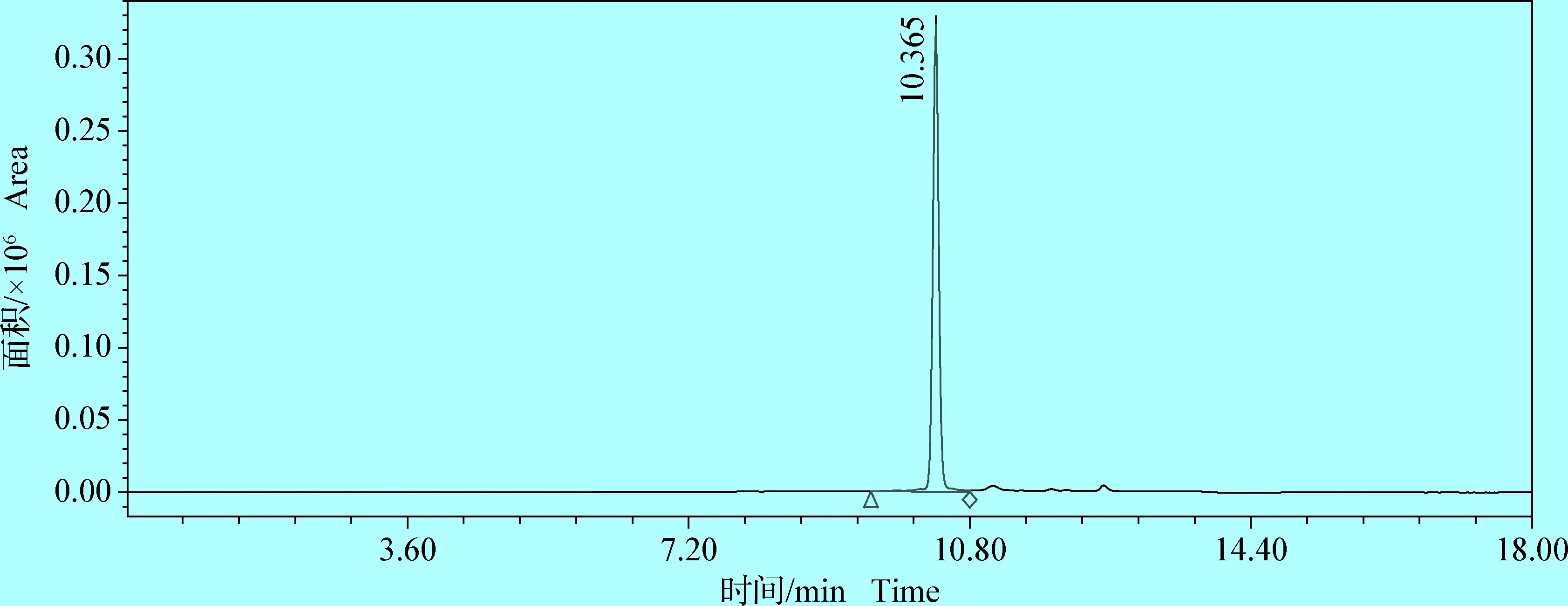
图2 利福昔明供试品溶液色谱图(60 μg/mL)Fig.2 Chromatogram of test product solution(60 μg/mL)
2.1.2 系统适应性 结果如表2所示,主峰出峰时间为10.308 min,峰面积为1 736 363,对称因子在0.9~1.1,连续进样5针,所得RSD为0.23%,该方法系统适应性良好。
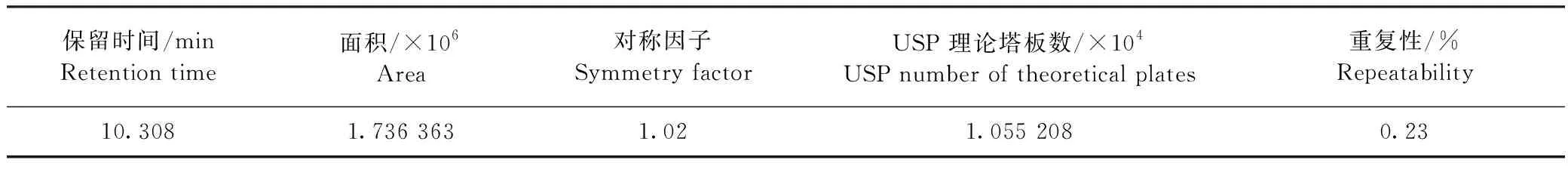
表2 系统适应性结果Table 2 Results of system adaptability
2.2 方法检测限与定量限 采用逐步稀释的方法,按信噪比S/N≥3计算,检测限LOD值为0.2 μg/g,按信噪比S/N≥10计算,定量限LOQ值为0.6 μg/g。
2.3 方法准确度与精密度 理论上分别称取原料药54、45、36 mg,配制成高、中、低3个浓度的样品,按照日内测5次,日间测5次的方法,所得平均回收率分别为100.12%、98.16%和95.94%,日间变异系数分别为3.10%、2.59%和3.93%,准确度和精密度试验结果如表3所示。
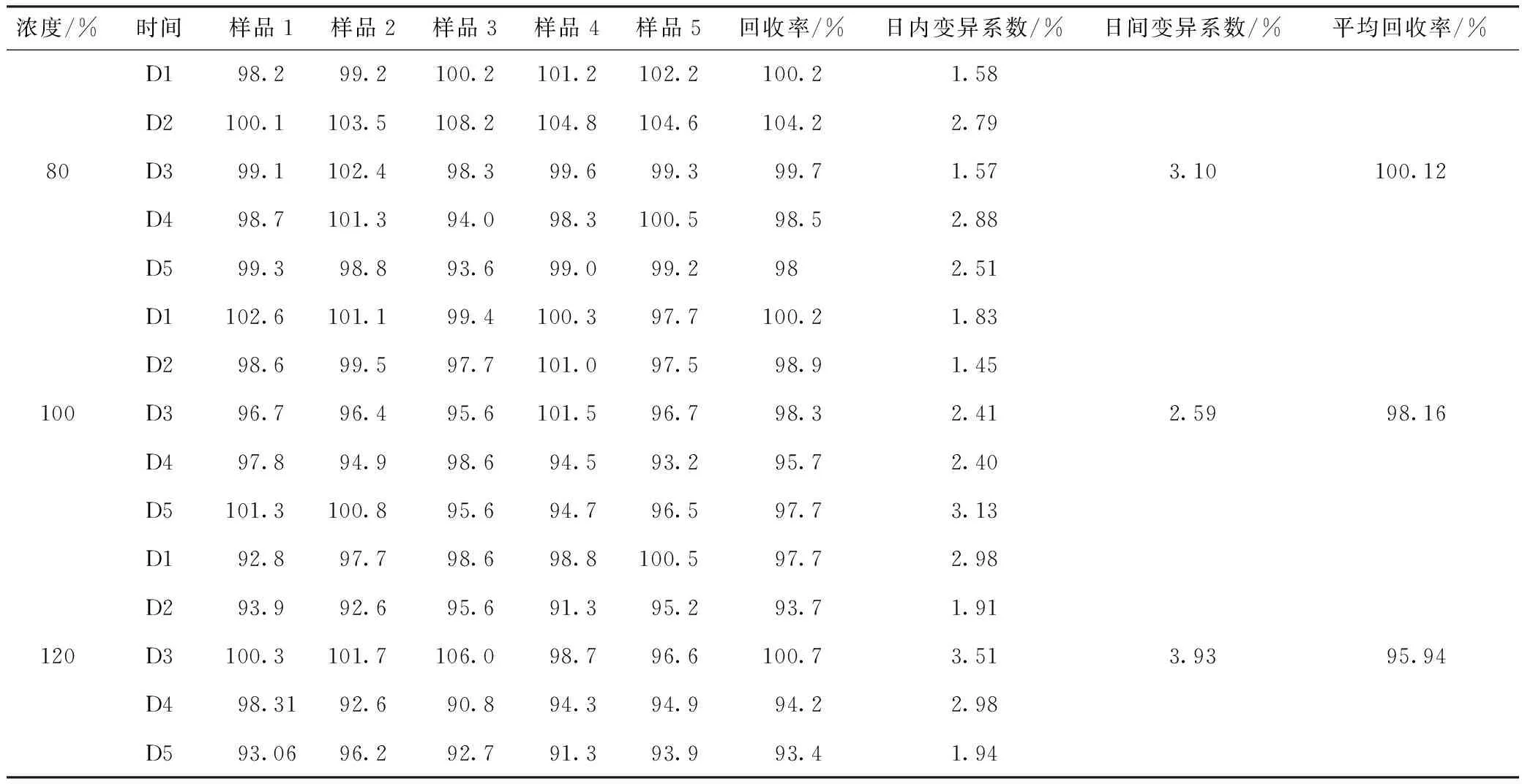
表3 准确度和精密度试验结果Table 3 Experimental results of accuracy and precision
2.4 方法的线性关系 按照HPLC法进行检测,以利福昔明峰面积对利福昔明浓度作线性回归,求出回归方程Y=-9 378.26X+24 821.86,相关系数r2=0.999。利福昔明软膏剂在40~160 μg /mL 浓度范围内线性关系良好,如图3。
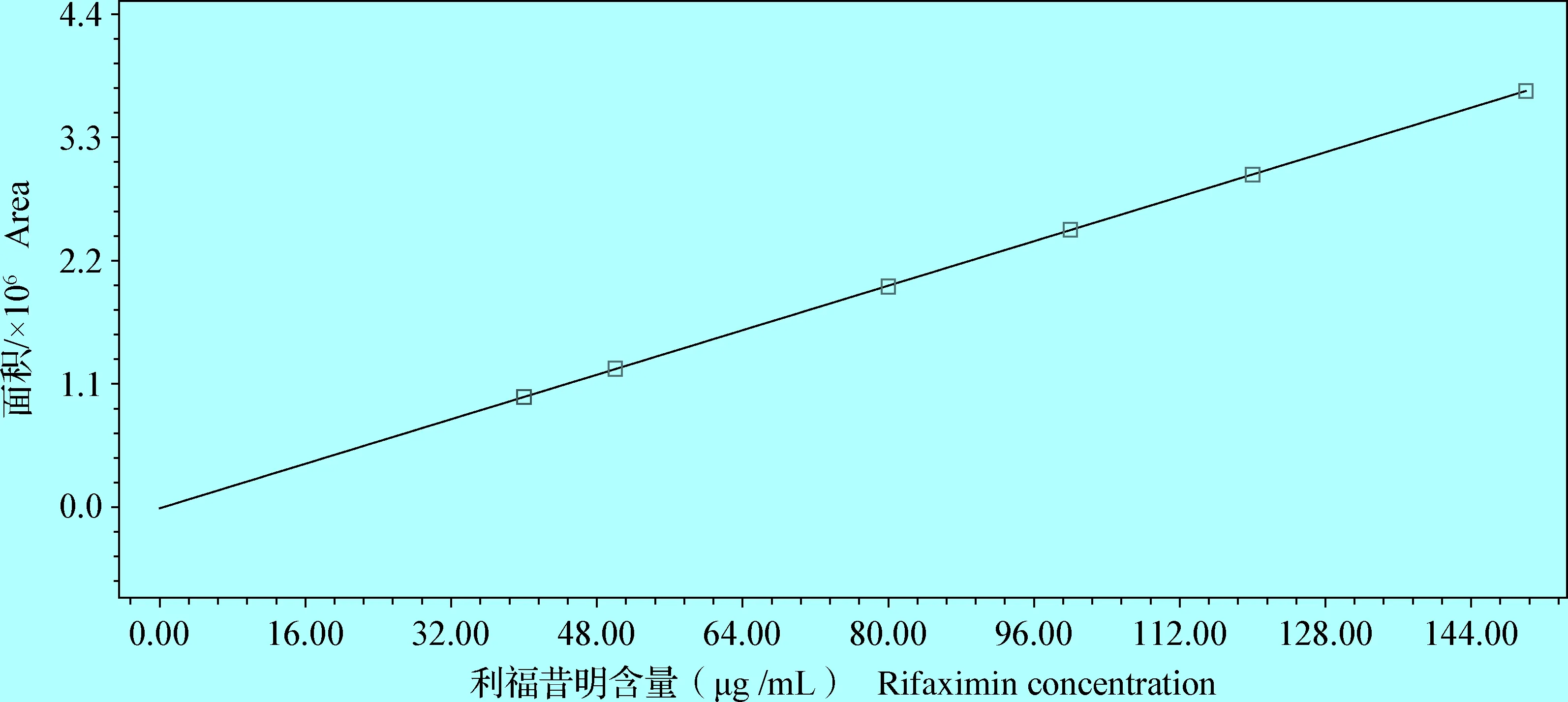
图3 利福昔明标准曲线Fig.3 Rifaximin standard curve
3 讨论
3.1 流动相的选择 利福昔明药物含量检测方法主要采用高效液相色谱法,目前采用较多的方法是欧洲药典EP 8.0[12],主要采用276 nm检测波长,甲酸铵甲醇等度洗脱条件。在试验中发现,由于其成分含盐,极易造成色谱柱堵塞[13],增加了仪器维护成本。因此,本试验优化了利福昔明检测方法,建立了一种不含盐的流动相体系,主要采用乙腈∶0.1%甲酸(v∶v),与EP 8.0方法相比,该方法的峰面积更大,峰高更高,响应更好,峰型较为尖锐。
3.2 检测波长的选择 本试验从190~400 nm进行全波长扫描,发现波长233.7~293 nm处检测响应较好,基于以上结果,分别选择了239 nm及276 nm作为检测波长,考察其对供试品及对照品的波形、响应、杂质的检测,结果表明,239 nm波长下的响应高于276 nm,但波形在14.00~20.00 min内出现基线漂移。故选择276 nm为本检测方法的检测波长。
3.3 结果 该HPLC法线性良好,在40~160 μg/mL浓度范围内,药物浓度与峰面积呈线性相关。高、中、低3个浓度的平均回收率分别为 100.12%、98.16%、95.94%,日间变异系数分别为 3.10%、2.59%、3.93%,表明该法的准确性和精密性良好,本文建立了检测利福昔明软膏剂含量的HPLC方法。该方法检测限为0.2 μg/g,定量限(LOQ)为0.6 μg/g,以 80、100、120 μg /mL 3个浓度水平进行添加回收,回收率在95.94%~100.12%,日内变异系数在1.45%~3.51%,日间变异系数<3.93%。
