东莨菪内酯在大鼠肝微粒体孵育体系中的代谢产物分析及其含药血清对大鼠肝星状细胞的影响
2020-03-30杨增艳陈少锋靳洪涛
杨增艳,张 颖,李 嘉,陈少锋,黄 鑫,靳洪涛
(1.广西国际壮医医院,南宁 530201; 2.广西壮族自治区中医药研究院,南宁 530022;3.中国医学科学院药物研究所,北京 100050)
黄根又名南山花、狗骨木,来源于茜草科植物三角瓣花(prismatomeris connata r.Z.Ruan)的根。黄根具有利湿退黄,强筋壮骨,凉血止血,祛瘀生新的功效。在广西壮族民间常用于风湿跌打、肝炎、矽肺等疾病的治疗。资料显示,黄根含有甲基异茜草素、β—各甾醇及蒽类、有机铝化合物、柚木醌、虎刺醛、萜类等成份。黄根提取物有抗肝纤维化、抗肺纤维化、抗菌消炎、祛瘀平喘、保肝等作用[1],课题组前期研究已发现黄根的乙酸乙酯部位有抗肝纤维化作用[2],并从该部位中首次分离得到了东莨菪内酯化合物[3]。
肝纤维化的形成和发展过程与肝中的实质细胞、非实质细胞及炎症细胞等密切相关,而肝星状细胞(HSC)作为肝的非实质细胞,它的激活被认为是肝纤维化发生发展的中心环节[4]。HSC可被多种致病因子激活,转化成肌成纤维细胞,并能产生肝绝大部分的细胞外基质。因此,抑制HSC活性和增殖,诱导HSC凋亡是逆转肝纤维化的主要策略[5]。课题组进一步通过动物实验发现,东莨菪内酯能保护肝纤维化大鼠肝,正向调控与肝纤维相关细胞因子的表达,降低肝细胞外基质的水平,改善大鼠肝纤维化病变程度,具有抗肝纤维化作用[6]。但体外细胞实验提示,东莨菪内酯对大鼠肝星状细胞增殖的抑制作用很弱,诱导大鼠肝星状细胞(HSC)发生凋亡的比例也比较低[7]。
大鼠肝微粒体孵育体系是采用大鼠肝微粒体进行药物体外谢研究的一种模型,近年来利用大鼠肝微粒体孵育体系的研究也非常广泛。为探究东莨菪内酯体内、体外抗肝纤维化作用存在差异的原因,课题组前期对肝纤维化大鼠血浆中东莨菪内酯的代谢产物进行测定,但未能检测出相关任何代谢成分。为进一步分析东莨菪内酯抗肝纤维化的作用机制与其代谢过程,我们提出以下研究思路:借助肝微粒体孵育体系摸拟体内环境,了解东莨菪内酯的代谢产物;以含药血清为研究对象,了解东莨菪内酯在体内代谢后对HSC的作用,以明确东莨菪内酯可能的代谢产物和体内外对大鼠肝星状细胞作用差异的原因。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
雄性Wistar大鼠,SPF级,体重180~200 g(误差不大于10%),60只,由北京维通利华实验动物技术有限公司提供 [SCXK(京)2012-0001]。动物实验是在北京市药品检验所进行[SYXK(京)2015-0033]。
1.1.2 细胞
受试细胞为北京市药品检验所提供的肝星状细胞系HSC-T6,其表型为活化的HSC。以含10%胎牛血清的DMEM培养液单层传代培养,选取对数生长期的细胞开展实验。
1.2 主要试剂与仪器
黄根(采自广西壮族自治区防城市);东莨菪内酯对照品(中国食品药品检定研究院,纯度大于98%);秋水仙碱(西双版纳药业有限责任公司,批号170305)。
甲醇、乙腈(色谱纯,美国Tedia公司);甲酸 (分析纯,南京化学试剂一厂);FITC-labeled Annexin V/PI凋亡检测试剂盒(碧云天生物技术研究所);胎牛血清(浙江天杭生物科技股份有限公司);DMEM培养基(Gibco公司);MTT(sigma公司);Trypsin(Gibco公司)。
CDX41倒置显微镜(日本Olympus公司);FlexStation 3微孔板检测系统(美国Molecular Devices公司)、;CJ820标准净化工作台(中国苏洁净化设备公司);二氧化碳培养箱(德国Binder公司);流式细胞仪(美国BD公司)。
1.3 实验方法
1.3.1 实验样品的制备
黄根药材药材经广西国际壮医医院兰日春副主任药师鉴定为茜草科植物南山花(prismatomeris connata r.Z.Ruan)的干燥根。黄根经95%乙醇回流提取,浓缩提取液后得到黄根醇提浸膏,加水充分混溶后。依次用石油醚、乙酸乙酯和正丁醇进行萃取,减压浓缩得石油醚部位、乙酸乙酯部位和正丁醇部位。乙酸乙酯部位经硅胶色谱柱分离,以石油醚-丙酮系统梯度洗脱,收集各流分。Fr.2-3再经硅胶柱色谱、Sephadex LH-20柱色谱分离纯化得化合物东莨菪内酯[3]。取东莨菪内酯21.5 mg,纯化水溶解后定容至体积95 mL,超声30 min,再稀释100倍为东莨菪内酯高剂量组用量(2.27×10-2mg/kg),东莨菪内酯低剂量浓度是高剂量的1/3。
秋水仙碱片0.1 mg,研磨成粉,纯水溶解,定溶至100 mL。
1.3.2 大鼠肝微粒体孵育体系及样品处理
1.3.3 给药血清的制备
60只大鼠随机平均分为4组分别为东莨菪内酯高剂量组、东莨菪内酯低剂量组、正常对照组和秋水仙碱组。除正常对照组外,其余三组均采用四氯化碳复合因素法造模,造模第四周后开始灌胃给药,其中东莨菪内酯高、低给药组每天分别灌胃给予东莨菪内酯2.27×10-5g/kg、7.56×10-6g/kg,正常对照组以等剂量生理盐水灌胃,秋水仙碱对照组按0.1 mg/kg体重给予秋水仙碱混悬液,每天1次,连续2周[6]。给药的同时继续造模,直至第6周给药结束。给药结束后,腹腔注射4%戊巴比妥钠,腹总动脉取血,并按照文献方法进行制备含药血清[8]。
1.3.4 Annexin V-APC单染法检测大鼠HSC凋亡
大鼠肝星状细胞株HSC-T6,接种6孔板中,每孔2 mL,细胞密度为4×104cell/mL,分别加入东莨菪内酯高、低剂量组、空白对照组和秋水仙碱组的含药血清,完全培养基共同孵育48 h后,经胰酶消化后收集受试细胞,参照凋亡检测试剂盒使用说明书进行检测。
1.3.5 MTT法检测HSC-T6细胞的增殖和抑制
大鼠肝星状细胞株HSC-T6,接种96孔板中,每孔100 μL,细胞密度为4×104cell/mL,分别加入空白对照组、秋水仙碱组、东莨菪内酯高剂量组和低剂量组的含药血清,设置本底孔。处理48 h后,每个复孔分别加10 μL MTT(5 mg/mL),充分混合后继续孵育4 h,弃去各孔中的上清液,再加入100 μL DMSO,平面震荡混匀10 min,待蓝紫色甲瓒沉淀完全溶解后,用酶标仪检测各孔的OD值。细胞增殖抑制率(IR)按下面公式计算:IR(%)=(1- ODtreated group/平均ODcontrol group)×100%。实验重复三次。
1.3.6 液相条件
Thermo Dionex Ultimate 3000 高效液相色谱仪 (包括二元溶剂输送泵,柱温箱,自动进样器);ACQUITY UPLC HSS T3色谱柱 (100×2.1 mm内径, 1.8 μm);柱温 40℃;流动相为水(含0.1%甲酸)与乙腈(含0.1%甲酸)梯度洗脱:0~1 min,1%~1%乙腈;1~2 min,1%~20%乙腈;2~3 min,20%~35%乙腈;3~4 min,35%~90%乙腈;4~5 min,90%~90%乙腈;5~6 min,90%~1%乙腈。流速0.3 mL/min;进样体积10 μL。
1.3.7 质谱条件
Q-Orbitrap质谱仪(Thermofeisher, Q-Exactive);ESI 离子源;负离子检测模式;离子源参数设置如下:喷雾电压 (spray voltage) 2.5 kV;喷雾温度 (vaporizer temperature), 200℃;鞘气流速(sheath gas), 40 unit;辅助气流速 (aux gas), 10 unit;毛细管温度 (capillary temperature) 250℃;碰撞气(collision gas, argon) 1.5 mTorr;质谱扫描模式dd-MS2;碰撞能量为25、35和40 eV;所有操作以及数据处理由Xcalibur (version 2.2)软件控制。
1.4 统计学方法
使用SPSS 3.1统计软件,P< 0.05表示组间差异显著。柱形图均使用GraphPad Prism 8绘制。
2 结果
2.1 大鼠肝微粒体孵育体系中东莨菪内酯代谢物的鉴定
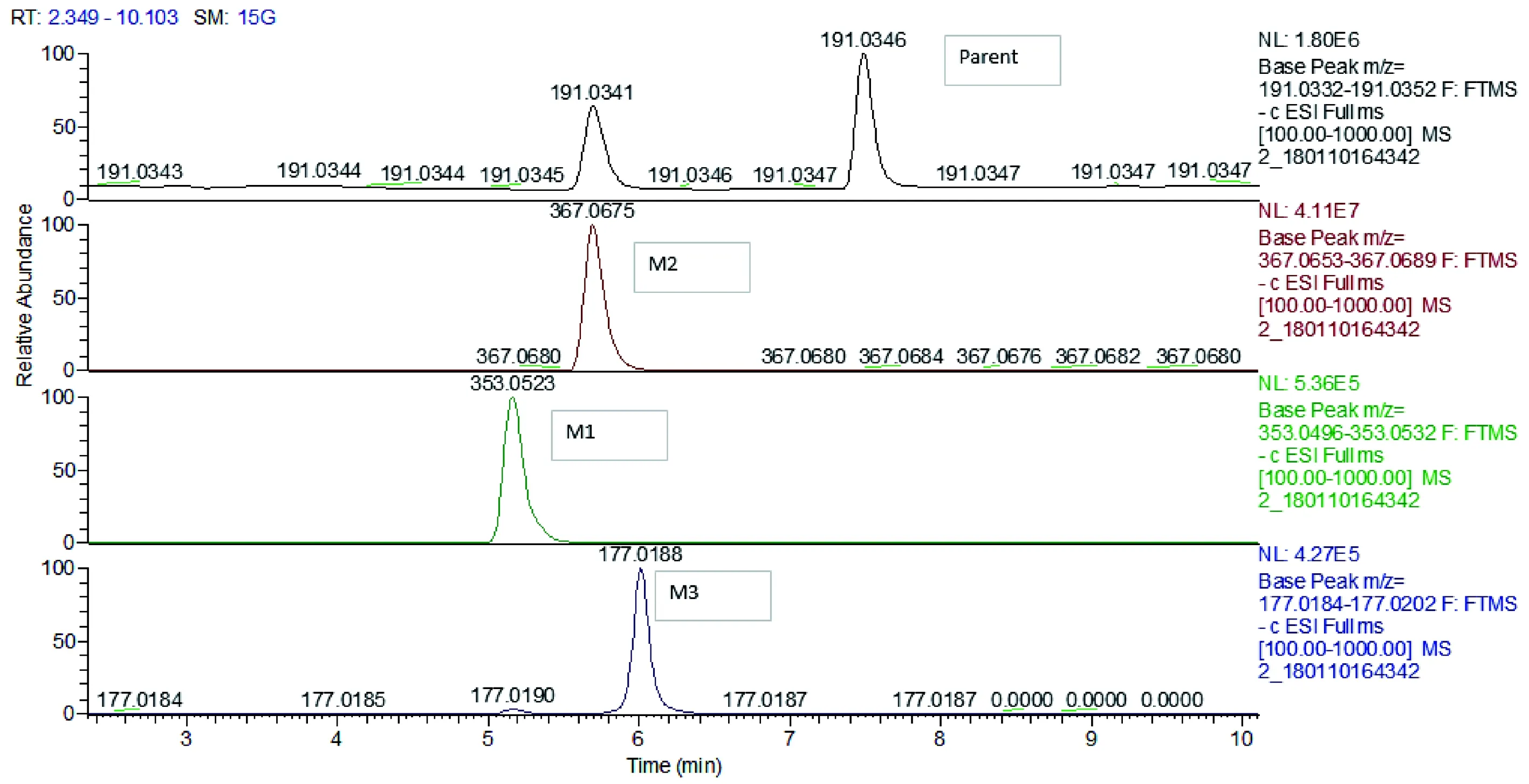
图1 大鼠肝微粒体孵育体系中东莨菪内酯及代谢物的色谱图Figure 1 Chromatogram of scopoletin and its metabolites in rat liver microsomal incubation system
大鼠肝微粒体孵育体系中研究人员发现东莨菪内酯产生3个代谢物峰,对其分别标注为M1、M2和M3(见图1)。在负离子模式下,东莨菪内酯的分子离子峰为m/z191.0350,分子式为C10H8O4(误差-0.5 ppm)。在M1的MS图谱中,产生了m/z353.0523的分子离子峰(C15H14O10,误差-0.27 ppm),而其 MS2谱图中产生m/z177.0182的分子离子峰(C9H6O4,误差-0.5 ppm),提示中性丢失176 Da,这是发生葡萄糖醛酸化代谢反应的结果;在M2的MS图谱中,产生了m/z367.0674的分子离子峰(C16H16O10,误差-0.25 ppm),而M2的MS2图谱中产生m/z191.0344的分子离子峰(C10H8O4,误差-0.5ppm),提示也是葡萄糖醛酸化代谢的结果。M3的MS谱图中产生m/z177.0218的分子离子峰(C9H6O4,误差-0.5 ppm)与原药分子离子相差CH2基团,则推断是原药脱甲基而产生的代谢产物。以上结果表明M3是东莨菪内酯脱甲基的产物,M1是M3的葡萄糖醛酸结合物,M2是东莨菪内酯的葡萄糖醛酸结合物(见图2)。
2.2 东莨菪内酯含药血清诱导大鼠HSC凋亡作用研究
与空白对照组比较,东莨菪内酯高剂量组的诱导凋亡率无明显差异(P>0.05),低剂量组有统计学差异,但作用强度明显低于秋水仙组提示东莨菪内酯含药血清有较弱的诱导大鼠HSC凋亡作用(见图3)。
2.3 东莨菪内酯含药血清对大鼠HSC增殖的抑制作用
各组含药血清对大鼠HSC均有较弱的抑制作用,其中,秋水仙碱组抑制HSC增殖的作用最强(平均抑制率为10.6%),给药低剂量组(平均抑制率为4.8%)比给药高剂量组(平均抑制率为1.2%)的平均抑制率要高。与空白对照组比较,低剂量组平均抑制率存在统计学差异(P<0.05)(见图4)。
3 讨论
肝纤维化可以发展为肝硬化和肝癌,早期进行抗肝纤维化治疗可以有效地缓解或者逆转这一过程,因此寻找有效的抗肝纤维化药物成为热点[9]。课题组前期通过系列研究,分别确定了黄根提取物中的乙酸乙酯部位,乙酸乙酯部位中单体成分东莨菪内酯有明显的抗肝纤维化作用[3,6]。同时采用肝大鼠肝星状细胞,观察了包括东莨菪内酯在内的系列单体对HSC的抗增值和诱导凋亡作用,发现东莨菪内酯的抗增值和诱导凋亡作用较弱,与体内作用符合度不高[7]。课题组还对东莨菪内酯在肝纤维化大鼠体内的代谢产物进行检测,但未能检测出相关代谢产物,分析其主要原因在于实验动物所给予的东莨菪内酯量较低(高剂量为2.27×10-5g/kg、低剂量为7.56×10-6g/kg),经动物代谢后的代谢产物浓度可能低于检测限,致使东莨菪内酯的体内代谢产物不能被检出。
为更好分析东莨菪内酯在体内的作用机制与靶点,课题组通过应用液相色谱高分辩串联质谱技术对东莨菪内酯在大鼠肝微粒体孵育体系中的代谢产物进行分析,对代谢产物鉴定的分析过程进行了完善,重点对高分辨质谱数据和二级质谱的高分辨质谱数据进行了整理和完善。高效液相色谱—高分辨质谱法结合了高效液相色谱的快速分离能力和高分辨质谱的高灵敏度、高质量精度、高专属性的检测能力,是中药化学成分及体内代谢过程研究的常用方法[10]。现有的结果提示东莨菪内酯在在大鼠肝微粒体孵育体系发生脱甲基、脱甲基葡萄糖醛酸化和葡萄糖醛酸化的代谢反应,可为真实体内代谢提供参考。并提示我们今后进行较高剂量的东莨菪内酯大鼠体内药代研究时,除了原性药物外,还应该检测上述三种代谢产物的浓度。

注:A:M1一级质谱图;B:M1二级质谱图;C:M2一级质谱图;D:M2二级质谱图;E:M3一级质谱图;F:M3二级质谱图;G:可能的代谢途径。图2 负离子模式下东莨菪内酯的多级质谱图Note. A, M1 Primary mass spectrum. B, M1 Secondary mass spectrum. C, M2 Primary mass spectrum.D, M2 Secondary mass spectrum. E, M3 Primary mass spectrum. F, M3 Secondary mass spectrum.G, Possible metabolic pathways.Figure 2 ESI-MS/MS sepectrum of Scopoletin in negative ion mode

注:与空白对照组相比,**P<0.01。图3 含药血清对大鼠HSC凋亡率的作用Note. Compared with the control group,**P<0.01.Figure 3 Effect of drug-containing serum on the apoptosis rate of HSC in rats
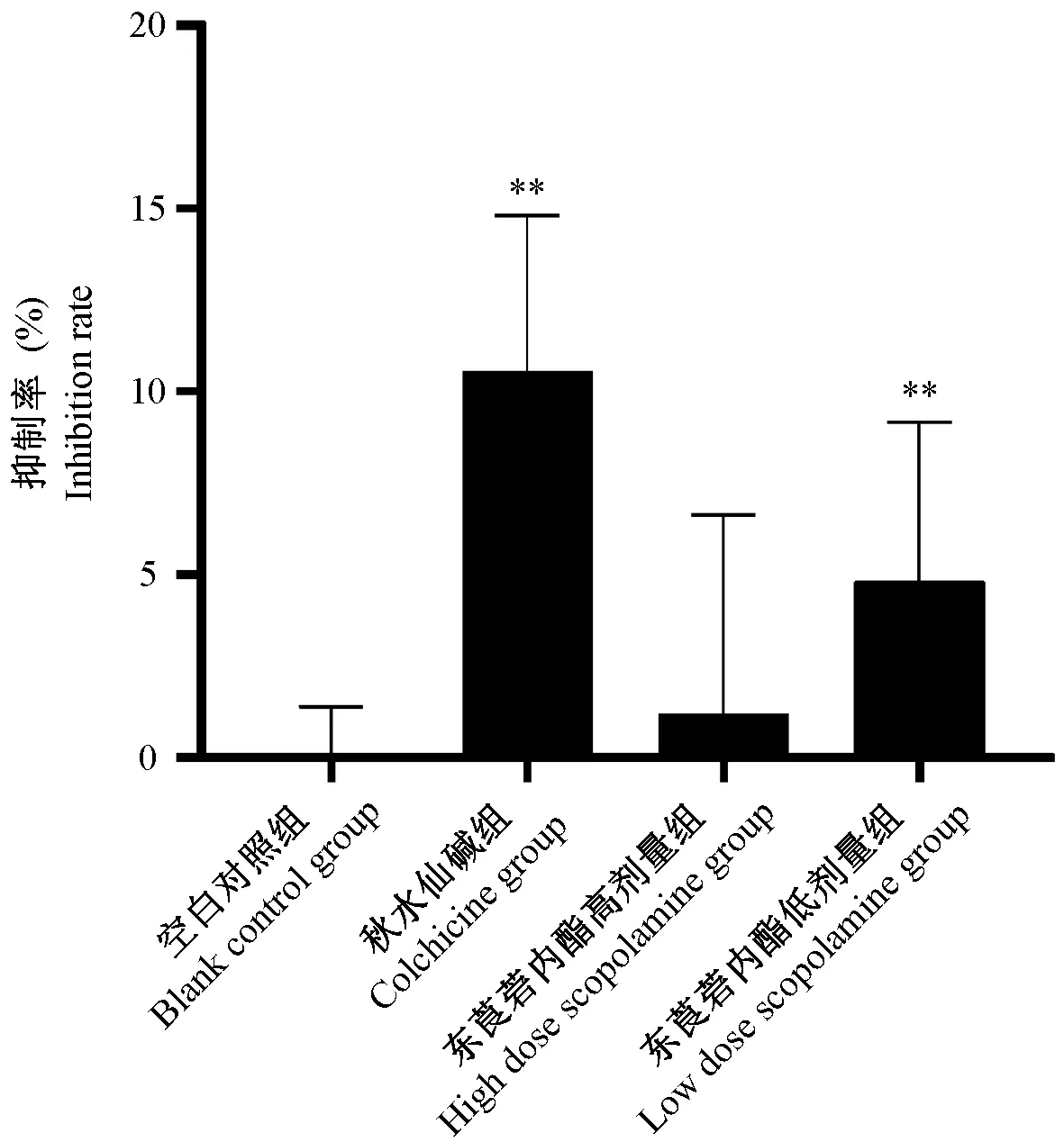
注:与空白对照组相比,**P<0.01。图4 含药血清对大鼠HSC增值的影响Note. Compared with the control group,**P<0.01.Figure 4 Effect of drug-containing serum on the inhibition rate of HSC in rats
HSC属于肝脏内的非实质细胞。在正常肝脏中,HSC位于窦周间隙。当肝脏受到损伤后,肝星状细胞由静止状态转化成激活状态,激活后的HSC慢慢向汇管区聚集,具有收缩性、增殖性和炎症性,并产生大量的肝细胞外间质(ECM)。随着损伤的持续进行,ECM的合成大于降解,肝脏的纤维化增生便开始形成。近年来的研究资料显示,肝纤维化发生的中心环节是肝星状细胞的的激活,许多抗肝纤维化的实验也主要围绕肝星状细胞进行。[11]。虽然HSC激活是肝纤维化发生发展的关键,但抗肝纤维化作用并非只取决于是否直接作用于HSC,还包括能否抑制细胞外基质的合成以及促进细胞外基质的降解。因为肝纤维化是个复杂的病理过程,多种因素(胶原、酶类、糖类、细胞因子等)参与其中,相互作用相互协同,最终左右肝纤维化的进程[12]。
课题组前期已检测东莨菪内酯单体体外诱导大鼠HSC凋亡和抑制其增殖的作用较弱[7],现又再次观测到东莨菪内酯含药血清对大鼠HSC的凋亡率和抑制作用与之相似,发现无论是东莨菪内酯的含药血清或其单体本身,对大鼠HSC并均未表现出较强的抑制作用和诱导其凋亡的作用。因此综合前期及本次实验结果,本研究分析莨菪内酯能在动物体内表现出较好的抗肝纤维化作用,其机理并非直接或通过代谢产物诱导大鼠HSC凋亡和抑制其增殖,其确切的作用机理值得进一步深入研究,重点应该在于其否抑制细胞外基质的合成以及促进细胞外基质的降解的相关探索。
