流式细胞仪在GLP体系下性能验证方法的建立
2020-03-30牟文波安会苹程红旭王凤华靳洪涛魏金锋
牟文波,李 慧,安会苹,程红旭,王凤华,靳洪涛,2*,魏金锋,2*
(1.北京协和建昊医药技术开发有限责任公司,北京 100176; 2.中国医学科学院药物研究所新药安全评价研究中心,北京 100050)
流式细胞仪(flow cytometer)主要应用于生命科学的基础医学研究,如免疫学、细胞生物学、分子生物学及微生物学等;在临床医学应用中,能辅助多种疾病诊断,尤其是白血病的诊断、分型和疗效评定;在药物安全性评价应用中,主要用于免疫细胞和细胞因子的检测,目前已经成为这些领域研究不可缺少的基本仪器。GLP体系是新药非临床安全性评价的一套标准质量规范,目的是保证数据的真实性、准确性和可靠性。根据《药物非临床研究质量管理规范》(国家食品药品监督管理总局令第34号)的规定,研究机构根据研究工作的需要配备相应仪器设备,同时应当进行相应的仪器性能验证。由于仪器性能验证是新提出来的要求,目前在GLP体系下还没有比较成熟的可参考方案,本研究以我国医药《YY/T 0588-2017流式细胞仪》[1]为依据,建立了流式细胞仪在GLP体系下性能验证的方法,主要解决GLP体系下流式细胞仪的验证问题,符合国内国际最新的要求,为流式细胞仪整体性能评价提供可靠、准确、稳定的依据。
1 材料和方法
1.1 实验动物
实验用SPF级SD大鼠雌雄各一只,雌性动物体重205 g,雄性动物体重261 g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006],动物饲养条件为实验动物设施持续保持屏障环境标准,主要环境指标的控制范围:室温20℃~26℃,相对湿度40%~70%,最小换气次数15次/小时,光照明:暗=12 h:12 h。普通级Beagle犬雌雄各一只,雌性动物体重7.8 kg,雄性动物体重8.1 kg,购自北京玛斯生物技术有限公司[SCXK(京)2016-0001];食蟹猴雌性动物体重3.3 kg,雄性动物体重3.6 kg,购自北京协尔鑫生物资源研究所有限责任公司[SCXK(京)2015-0011]。Beagle犬和食蟹猴动物饲养条件均为实验动物设施持续保持普通环境标准。主要环境指标的控制范围:室温16℃~26℃,相对湿度40%~70%,最小换气次数8次/小时,光照明:暗=12 h:12 h。动物实验均在北京协和建昊医药技术开发有限责任公司动物实验部屏障动物实验设施进行[SYXK(京)2015-0021]。实验期间按动物使用的3R原则给予人道主义关怀。
1.2 主要试剂与仪器
真空采血管购自北京积水创格公司;EDTA-K2抗凝管、柠檬酸钠抗凝管均购自北京协顺祥医疗科技有限公司。
流式细胞仪FACSVerseTM型,美国BD公司; T淋巴细胞亚群检测试剂盒、APC Anti-Rat CD3/PE Anti-Rat CD4/FITC Anti-Rat CD8a、APC Anti-Dog Pan T Cell/PE Anti-Dog CD4/FITC Anti-Dog CD8、PerCP-CyTM5.5 Mouse Anti-Human CD3/FITC Mouse Anti-Human CD4/PE MouseAnti-Human CD8、BD FACSuiteTM标准微球(CS&T Research Beads)均购自美国BD公司。
1.3 实验方法
1.3.1 样本采集
积水创格真空采血管,EDTA-K2抗凝管采血,用于前向角散射光(FSC)和侧向角散射光(SSC)分辨率验证实验,表面标志物重复性验证实验。柠檬酸钠抗凝管采血,用于FSC和SSC分辨率验证实验。采集的样本需是无溶血、无凝血、无脂血的新鲜血样本。
1.3.2 检测项目
CD3+T细胞、CD4+T细胞、CD8+T细胞共3个项目。
1.3.3 性能验证前准备
在开展验证实验前,每批检测前需要对仪器进行性能质控(performance QC)测定,确认检测结果在质控范围内才可以进行相应的性能验证[2]。样本处理要严格按照标准操作规程(SOP)进行,如果出现室内质控失控或影响检测结果的其它因素,需要弃去异常数据,重新进行检测。
1.3.4 前向角散射光(FSC)和侧向角散射光(SSC)分辨率
(1)移液器吸取5 μL柠檬酸钠抗凝Beagle犬雄性动物全血,加入到装有1 mL鞘液的试管中,充分混匀后上机检测。
技术要求:检查FSC和SSC图,可以分开血小板和红细胞[3-5]。
(2)移液器吸取100 μL EDTA-K2抗凝全血,溶解红细胞后上机检测。
技术要求:检查FSC和SSC图,可以分开外周血白细胞三群(包括淋巴细胞、单核细胞、粒细胞)[3-5]。
1.3.5 表面标志物重复性验证实验
SD大鼠、Beagle犬和食蟹猴的动物样品,雌雄各一只,移液器吸取100 μL EDTA抗凝全血,加入已标记好CD3+、CD4+、CD8+试剂,按照T淋巴细胞亚群样品处理的SOP进行样品处理,样品处理完成后进行表面标志物重复性的检测[6],每个样品重复测定10次,分别计算CD3+、CD4+、CD8+百分比结果的变异系数(CV)。
技术要求:阳性百分比结果的变异系数应符合:
(1)阳性百分比大于等于30%时,CV值应不大于8%。
(2)阳性百分比小于30%时,CV值应不大于15%。
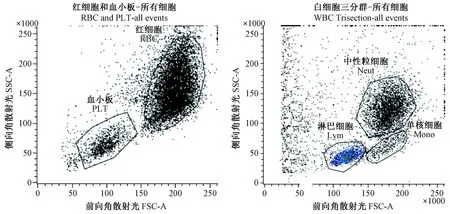
图1 前向角散射光和侧向角散射光分辨率检测结果Figure 1 Test results of the resolution power on FSC and SSC
1.3.6 携带污染率验证实验
取适量CS&T Research Bead微球,用1 mL鞘液稀释混匀后上机测试,连续测试3次,计算标定区域的颗粒数,分别记为Hi-1、Hi-2、Hi-3。再进行空白数量测试,连续测试3次,计算标定区域的颗粒数,分别记为Li-1、Li-2、Li-3。按照此操作循环3次,再计算携带污染率(Ci),取最大值。
式中:Ci是第i次循环的携带污染率值,i=1~3。
技术要求:携带污染率应不大于0.5%。
1.3.7 仪器稳定性验证实验
将适量CS&T Research Bead标准微球,加入1 mL PBS充分混匀后上机进行测试,测试完成后,计算标准微球的平均荧光强度(FL1);环境温度变化不超过设定温度的5%时,连续开机8 h后,在流式细胞仪的相同设置条件下重复步骤,得到标准微球的平均荧光强度(FL2),按公式计算FL1、FL2偏差值(B)[7-8]。
式中:
FL1∶0 h标准微球平均荧光强度值
FL2∶8 h后标准微球平均荧光强度值
技术要求:在8 h内检测FSC及所有荧光通道峰值平均荧光强度偏差值不超过±10%。
2 结果
2.1 FSC和SSC分辨率
FSC和SSC散点图中,血小板和红细胞可以分开,淋巴细胞、单核细胞、粒细胞也可以分开,见图1,同时均满足规定的技术要求。
2.2 表面标志物重复性检测
SD大鼠和Beagle犬动物样品表面标志物CD3+、CD4+、CD8+百分比重复性检测结果[9-10]、CV见表1,表2,表3,从表中可以看出,各动物样品的重复性均满足规定的技术要求。
2.3 携带污染率
流式细胞仪3次检测的携带污染率分别为0.06%,0.07%,0.09%,见表4均满足规定的技术要求。
2.4 仪器稳定性
2.4.1 环境温度
0 h条件下,环境温度为22.5℃。8 h条件下环境温度为22.0℃。
2.4.2 荧光峰值及偏差值
0 h和8 h检测FSC及所有荧光通道的峰值平均荧光强度偏差值,见表5和图2,均满足规定的技术要求。
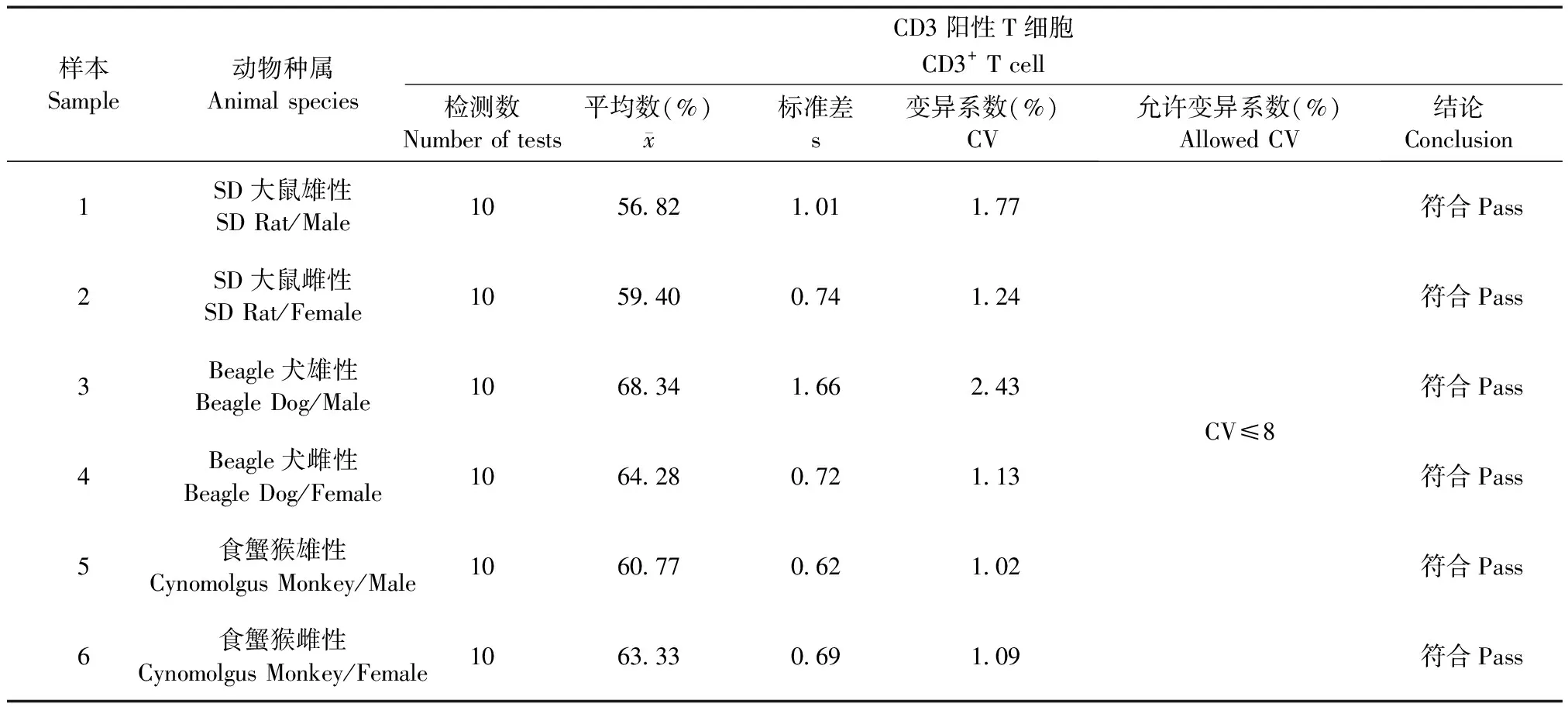
表1 表面标志物CD3+百分比重复性检测结果
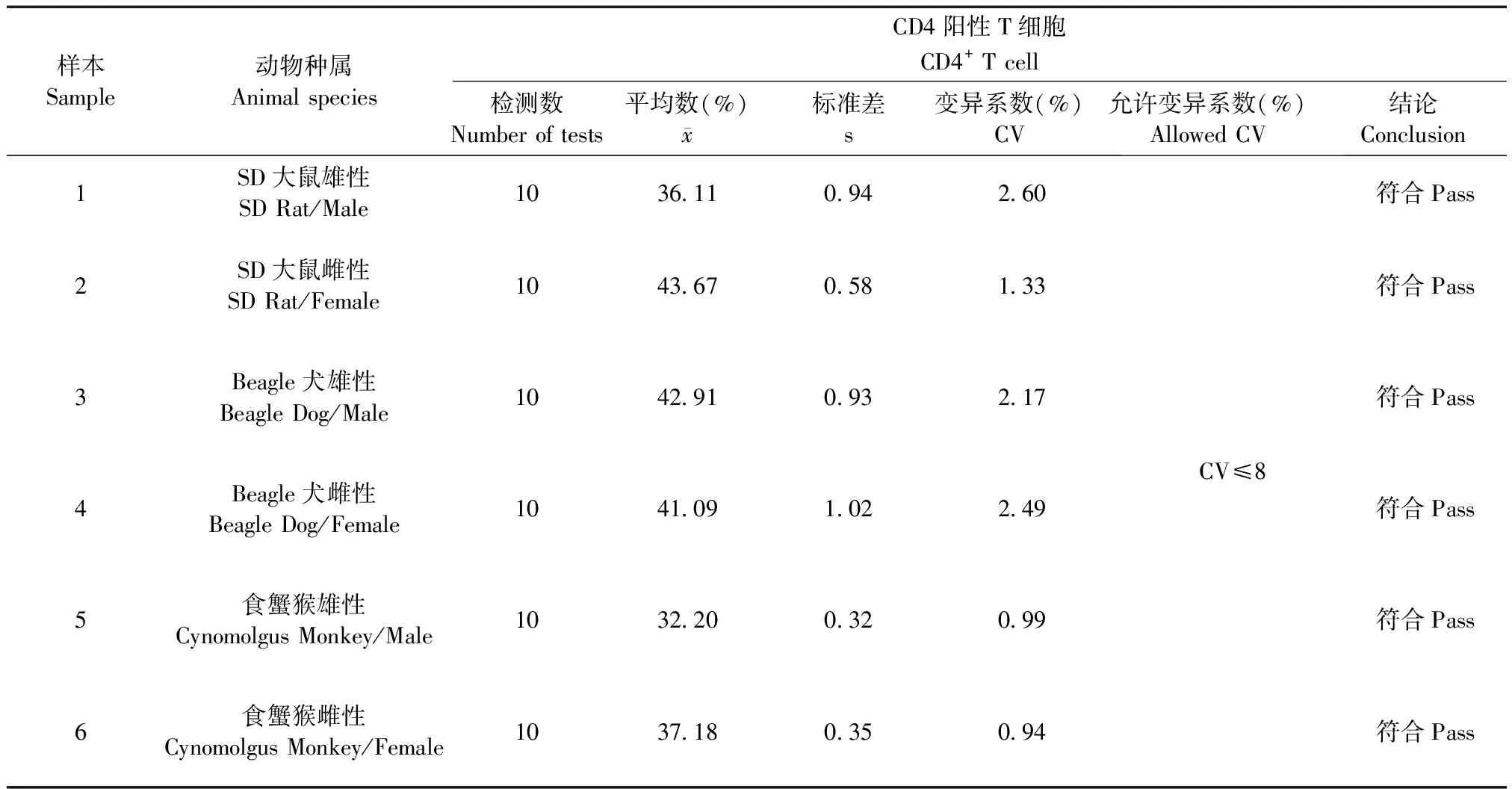
表2 表面标志物CD4+百分比重复性检测结果
2.5 评价与验证结论
2.5.1 评价
(1)本方法FSC和SSC散点图可以分开粒细胞、淋巴细胞、单核细胞,也可以分开红细胞和血小板,分辨率符合方法要求。
(2)本方法表面标志物CD3+、CD4+、CD8+百分比重复性检测,标准差、变异系数0.94%~4.09%,符合方法要求。
(3)本方法检测的携带污染率分别为0.06%,0.07%,0.09%,符合方法要求。
(4)本方法检测仪器稳定性,荧光偏差值-2.40%~0.23%,符合方法要求。
2.5.2 结论
通过对上述各项指标的验证,确认本实验室具备使用本方法开展检测的能力。

表3 表面标志物CD8+百分比重复性检测结果
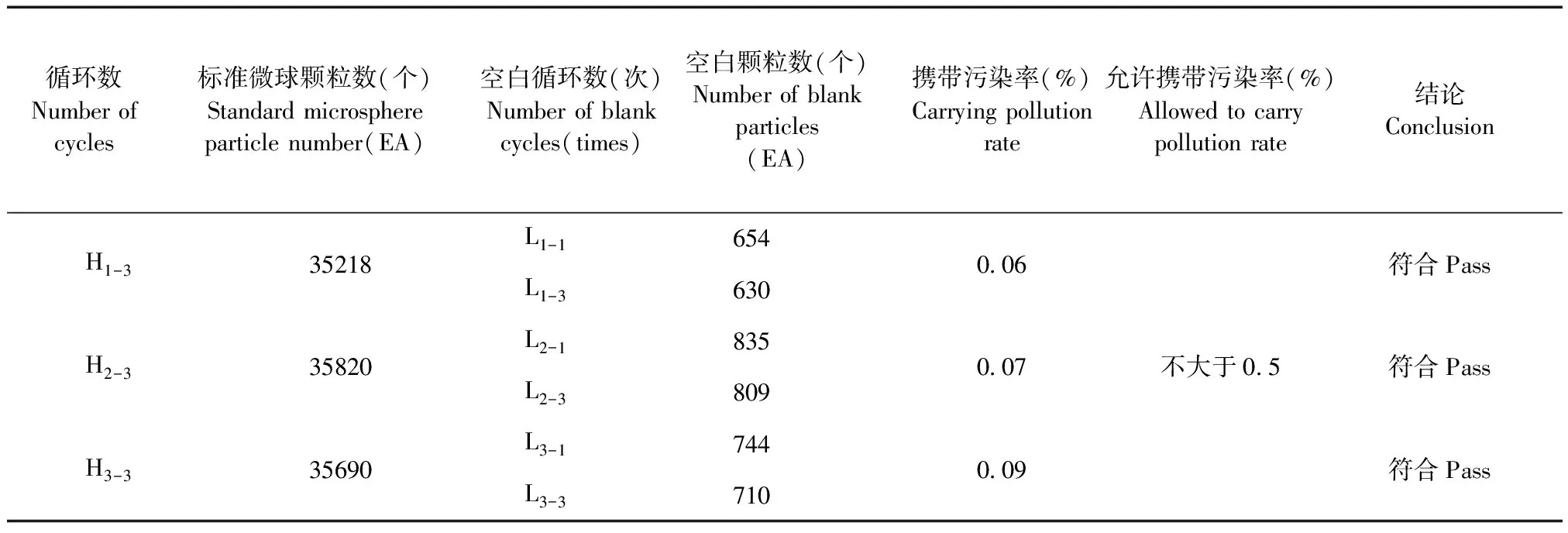
表4 流式细胞仪携带污染率

表5 FSC和各荧光通道0 h、8 h荧光峰值及偏差值
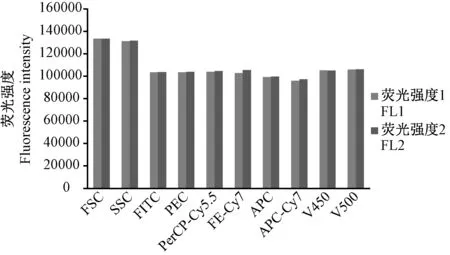
图2 FSC和各荧光通道0 h、8 h荧光峰值直方图Figure 2 FSC and histograms of fluorescence peaks at 0 h and 8 h in each fluorescent channel
3 讨论
流式细胞术的测定并不是新药非临床安全性评价中常规的项目,近年来,随着免疫治疗的增多,对于免疫细胞和细胞因子的测定项目不断增多,需要较多应用流式细胞仪,因此需要对它进行性能验证。在GLP体系下,对流式细胞仪的性能验证,查阅文献国内外并没有公认的现行统一的方法。国家食品药品监督管理局在2017年12月5日发布、2018年12月1日实施医药行业标准《YY/T 0588-2017流式细胞仪》,结合经济合作和发展组织良好实验室规范原则(OECD SERIES ON PRINCIPLES OF GOOD LABORATORY PRACTICE,OECD GLP)和英国药品和健康产品管理局(Medicines and Health care products Regulatory Agency, MHRA)对药物非临床安全性评价的实验要求[11-12],性能验证涵盖了仪器正常工作条件,仪器分辨率,样品表面标志物检测重复性,携带污染率,仪器稳定性等重要的性能指标。
根据药物非临床安全性评价的样本类型,在样本的选择上,采用SD大鼠、Beagle犬和食蟹猴的动物样品,建立适合在GLP体系下的流式细胞仪性能验证。在仪器的选择上,本实验中BD FACSVerseTM流式细胞仪是专为科研应用而设计的三激光八色流式细胞仪,光学设计可以将光在传输中的损失降到最低程度,为多色分析实验带来高质量的检测灵敏度和分辨率,保证了检测数据的可靠性和准确性。仪器操作人员通过规范化的培训,获得仪器授权资格,以排除人为的影响因素。流式细胞仪的性能验证周期,一般情况下一年进行一次。当仪器移机或出现故障后需重新进行性能验证,验证成功后仪器才可以使用。
综上所述,BD FACSVerseTM流式细胞仪检测性能良好,FSC和SSC分辨率、重复性、携带污染率、仪器稳定性均符合行业标准《YY/T 0588-2017流式细胞仪》中的技术要求。对检测系统的性能验证有助于规范GLP实验室的质量管理,提高流式细胞仪检测结果的可靠性、稳定性和准确性,为药物非临床安全性评价提供科学的参考依据,本方法可以为国内其他相关机构流式细胞仪的性能验证提供可以借鉴的范式。
