人脐带动脉旁、静脉旁与华通氏胶间充质干细胞的血管生成能力比较及移植安全性评价
2020-03-30杨嫣君丁利军盛小强孙海翔1
杨嫣君,余 飞,丁利军,盛小强,孙海翔1,
(1. 南京医科大学鼓楼临床医学院生殖医学中心,南京 210008;2. 常州市第一人民医院产科,江苏 常州 213000;3. 南京大学医学院附属鼓楼医院动物实验中心,南京 210008;4. 南京大学医学院附属鼓楼医院生殖医学中心,南京 210008;5. 南京大学医学院附属鼓楼医院临床干细胞研究中心,南京 210008)
干细胞在再生医学领域有巨大的应用潜能,通过干细胞移植、分化与组织再生,可发挥修复机体损伤的作用[1]。其中,间充质干细胞(mesenchyma stem cells, MSCs)具有自我更新和多系分化能力,在多种损伤性疾病治疗中具有较好的应用前景[2]。MSCs最早在骨髓中发现,现可从骨髓、外周血、脐带、胎盘、脂肪等多种组织中分离提取[3-4]。而脐带间充质干细胞(umbilical cord mesenchyma stem cells, UC-MSCs)来源于新生儿脐带,属于医疗废弃物,来源广泛,取材方便,具有较高安全性,低免疫原性,无伦理争议,体外增殖能力强等优势,在组织器官损伤修复应用方面有较好前景[5]。组织损伤后,MSCs可通过向病变部位迁移并增殖分化,直接参与损伤组织重建;其能旁分泌大量生长因子和细胞因子参与组织再生的调节;且其能刺激内皮细胞的分裂、迁移,有利于毛细血管内皮成熟及稳定,协调血管和神经生长,介导组织再生和重塑[6]。
脐带中有两条脐动脉(UCAs)和一条脐静脉(UCV),周围包裹华通氏胶。间充质干细胞可以从脐带的多个区域获得,包括脐带动脉旁干细胞(perivascular stem cells derived from umbilical arteries, UCA-PSCs)、脐带静脉旁干细胞(perivascular stem cells derived from umbilical vein, UCV-PSCs)和华通氏胶间充质干细胞(mesenchymal stem cells derived from Wharton’s jelly, WJ-MSCs)[7]。研究表明,大部分MSCs来源于组织的血管周围,血管周围分布有血管旁细胞(pericytes),其表达MSCs标记物且有多向分化潜能,是MSCs的祖细胞[8]。来自不同解剖位置的间充质干细胞群具有转录组学差异且体内分化潜力不同[9]。研究表明,WJ-MSCs移植小鼠未见明显毒性反应,异种移植安全可行[10],但未有UCA-PSCs与UCV-PSCs移植到小鼠体内的安全性研究。因此本研究旨在从脐带不同组分即脐动、静脉旁及华通氏胶中分离、培养间充质干细胞,并对其进行扩增、鉴定,比较三种干细胞的生物学特性及血管生成能力的差异,并通过尾静脉输注和腹股沟皮下注射,检测干细胞移植后小鼠的脏器是否成瘤探讨其安全性,为脐带间充质干细胞在组织损伤修复中的进一步临床应用及筛选最优质的种子细胞提供依据。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF级NOD-SCID雌鼠60只,鼠龄6周,体重18~22 g,购于北京维通利华实验动物技术有限公司[SCXK(京)2016-0006],饲养于鼓楼医院动物实验中心屏障环境[SYXK(苏)2014-0052]。采用12 h/12 h明/暗光照周期(06∶00~18∶00),温度22℃,自由饮水和摄食。无菌手术在屏障内实验室进行,操作遵守江苏省实验动物管理条例和动物福利伦理原则。伦理审批号(2018010016),并按实验动物使用的3R原则给予人道的关怀。
1.1.2 材料
脐带取自于南京鼓楼医院产科足月顺产新生儿废弃的脐带组织,产妇知情同意。伦理审批号(SC201800101)。
1.2 主要试剂与仪器
DMEM-LG、bFGF、FBS(美国Gibco公司);青链霉素、非必需氨基酸、全反式视黄酸(美国HyClone公司);成脂诱导培养基(Adipogenic Differentiation Kit,Gibco)、成骨分化培养基(Osteogenic Differentiation Kit,Gibco)、茜素红粉末(美国Gibco公司);油红O粉末、丙戊酸、丁羟基茴香醚、forskolin(德国Sigma公司);FITC-CD13抗体、FITC-CD29抗体、FITC-CD45抗体、FITC-CD90抗体、PE-CD105抗体、HLA-DR抗体(美国ebioscience公司);FITC-CD34抗体、FITC-CD73抗体、PE-CD146抗体(美国BD公司);NSE抗体、NF-M抗体(美国Santa Cruz Biotechnology公司);Matrigel基质胶(美国BD公司);CD146(ab24577)、PDGFRβ(ab32570)、NG2(ab139406)、α-SMA(ab5694)、荧光标记二抗Goat Anti-Mouse IgG H&L (Alexa Fluor® 488) (ab150113)和Goat Anti-Rabbit IgG H&L (Alexa Fluor® 594) (ab150088)(英国Abcam公司);苏木素及伊红(北京天合力恩化学试剂公司);CO2培养箱(美国Thermo 5400);流式细胞仪(美国BD FACS Calibur);荧光显微镜(德国 Leica DMR);倒置显微镜(德国Leica DMIL)。
1.3 实验方法
1.3.1 UCA-PSCs、UCV-PSCs与WJ-MSCs的原代分离与培养[11]
取新鲜人脐带7~8 cm,4 h内用PBS(含10%青链双抗)冰上运输,超净台内PBS冲洗,剪刀修齐两断面,沿脐带内血管长轴方向剪开脐带,用镊子钝性分离脐带动脉和静脉,仔细剔除血管外膜周围紧贴血管的华通氏胶组织。将脐带动脉、静脉、华通氏胶用PBS洗涤1次后,剪碎至1~2 mm3大小组织块,组织块接种于100 mm细胞培养皿,放置于37℃、5% CO2培养箱内4 h。然后缓慢加入5 mL DMEM-LG培养基至100 mm皿中,置于培养箱。第一周第3天和第7天各加DMEM-LG培养基3 mL、2 mL,之后第二周半量换液2次,之后第三周全量换液2次,期间观察贴壁细胞爬出情况。3周后细胞长到80%融合时去除组织块,0.05%胰酶消化,传代培养。取P3~P5代细胞用于实验。
1.3.2 细胞表面分子标记物鉴定
取P3代细胞,0.05%胰酶消化后制成单细胞悬液,1200 r/min,离心4 min后弃上清,PBS重悬。每100 μL细胞悬液中含1×105细胞,分别加入FITC标记和PE标记的CD13、CD29、CD34、CD45、CD73、CD90、CD105、CD146与HLA-DR抗体,避光孵育30 min。1200 r/min,离心4 min后弃上清,500 μL PBS重悬,流式细胞仪检测,Flowjo 10软件分析结果。
1.3.3 体外诱导分化
(1)成脂诱导
取P3代细胞以2.0×104/cm2密度接种于24孔板,每孔加500 μL DMEM-LG培养基,培养于37℃、5% CO2培养箱。细胞汇合后换液,对照组3孔换完全培养基,成脂诱导组3孔更换成脂诱导培养基,每3天换液,显微镜密切观察细胞生长情况及形态变化。第21天后细胞中可见脂肪滴,终止诱导并弃去培液,PBS洗3次,每次5 min。室温下4%多聚甲醛固定15 min,PBS洗3次,每次5 min,500 μL油红O染液孵育10 min。弃去油红O染色液,PBS洗3次,每次5 min,空气干燥,镜下观察拍照。
(2)成骨诱导
取质量分数0.1%明胶500 μL平铺于24孔板,静置30 min,弃去明胶后,取P3代细胞,以2.0×104/cm2密度接种于24孔板,每孔加入500 μL DMEM-LG培养基,置于37℃,体积分数5% CO2培养箱中培养。待细胞汇合后换液,对照组3孔换完全培养基,成骨诱导组3孔换成骨分化培养基,每3天换液,显微镜密切观察各孔中细胞的生长状态及形态学改变。3~4周后用茜素红染液染色,弃去培液,室温下4%多聚甲醛固定15 min,PBS洗3次,每次5 min,500 μL 2%茜素红染液孵育20 min。弃去茜素红染色液,PBS洗3次,每次5 min。空气干燥,镜下观察拍照。
(3)成神经诱导
P3代细胞以2.0×104/cm2的密度接种于24孔板中(预先放置经L-多聚赖氨酸处理过的无菌玻片)。添加成神经预诱导液500 μL,预诱导24 h后弃液,PBS洗2次,每次5 min,换成神经分化诱导液500 μL,24 h后加入ATRA(10-7M)和bFGF(10 ng/mL)以维持神经元诱导分化。镜下观察细胞生长状态及形态变化,第7天后出现明显细胞突触时,终止诱导,细胞免疫荧光鉴定神经元特异性标志物NSE、NF-M。弃去培液,每孔加预冷的PBS 500 μL清洗3次,每次5 min,吸尽残液。每孔加4%多聚甲醛500 μL室温固定20 min。每孔加PBS 1 mL清洗3次,每次5 min。每孔加含0.5% TRItonX-100的PBS 500 μL,室温孵育细胞5 min。每孔加含1% BSA的PBS 500 μL洗3次,每次5 min。每孔加含3% BSA、0.1% TRIton X-100的PBS 500 μL,37℃孵育45 min。按1∶100稀释一抗NSE(sc-292097,1∶100),NF-M(sc-16143,1∶100)抗体,阴性对照一抗为PBS,4℃孵育过夜,每孔加含1% BSA的PBS 500 μL清洗3次,每次5 min。1∶200稀释荧光二抗。每孔加入二抗稀释液200 μL,37℃避光孵育60 min。每孔加PBST(含0.1% Tween-20的PBS)500 μL避光洗3次,每次5 min。PBST按1∶10000稀释DAPI,每孔加入稀释后的DAPI 200 μL,室温避光孵育5 min。每孔加PBST 500 μL避光清洗3次,每次5 min。载玻片上滴加抗荧光淬灭剂,封片、固定,荧光显微镜镜下观察NSE和NF-M。
1.3.4 UCA-PSCs、UCV-PSCs与WJ-MSCs血管旁细胞标记物检测
取P3代的UCA-PSCs、UCV-PSCs与WJ-MSCs以2.0×104/cm2铺于24孔板中(预先放置L-多聚赖氨酸处理的无菌玻片),培养24 h后,细胞免疫荧光检测相关标志物。利用CD146(1∶1000)与PDGFRβ(1∶100),NG2 (1∶500),α-SMA(1∶500)双标记免疫荧光染色,4℃过夜后去除一抗,每孔加1% BSA的PBS 500 μL清洗3次,每次5 min。含1% BSA、0.1% TRItonX-100的PBS按1∶200稀释荧光二抗。每孔加入荧光标记二抗Goat Anti-Mouse IgG H&L (Alexa Fluor® 488) (1∶200),Goat Anti-Rabbit IgG H&L (Alexa Fluor® 594) (1∶200) 200 μL,37℃避光孵育60 min。荧光显微镜观察。
1.3.5 体外成环实验
96孔板中每孔加入50 μL Matrigel基质胶,放入培养箱中,静置30 min,等待凝胶凝结。取P3代的UCA-PSCs、UCV-PSCs与WJ-MSCs,每孔分别加5×103的相应干细胞与5×103的脐带静脉内皮细胞(HUVECs),共同接种于凝胶上培养。含0.3 nmol/L的VEGF作为阳性对照组。3 h后观察血管形成情况,每孔随机选取6个区域,计数形成的血管环数,分支点及管长度并拍照。
1.3.6 实验动物分组
60只小鼠称量体重,按体重大小排序从1到60号,由计算机随机产生60个随机数字,根据随机数字将小鼠分为阴性对照组、UCA-PSCs移植组、UCV-PSCs移植组、WJ-MSCs移植组和阳性对照组,每组12只。计数各组小鼠体重且体重均数间无统计学差异。干细胞移植组半数小鼠经尾静脉注射含5×106第三代相应干细胞的PBS悬液10 mL,半数小鼠腹股沟皮下注射含1×107第3代相应干细胞的PBS悬液10 mL,阴性对照组每次注射等同体积的PBS,阳性对照组腹股沟注射1×107的人胚胎干细胞。12周后经过病理检查,观察腹腔器官有无异常。取各脏器,石蜡包埋后切片,并做 H&E 染色。显微镜下观察组织病理变化以评估三种干细胞移植的生物安全性。
1.4 统计学方法

2 结果
2.1 脐带动脉旁、静脉旁和华通氏胶间充质干细胞形态学观察
脐带中有2条脐动脉,1条脐静脉,螺旋走行,之间环绕着华通氏胶(图1A)。将脐动脉、脐静脉、华通氏胶从脐带中机械分离,组织贴壁法分离UCA-PSCs、UCV-PSCs和WJ-MSCs,培养约7 d可见少量细胞呈放射状从贴壁组织块爬出,呈长梭形且增殖迅速(图1B-J)。

注:A:人脐带大体示意图;B-D:脐动脉、脐静脉、华通氏胶组织块;E-G:人脐带动脉旁、静脉旁、华通氏胶间充质干细胞从组织块中爬出;H-J:人脐带动脉旁、静脉旁、华通氏胶间充质干细胞呈梭形,螺旋状生长。图1 分离培养人脐带动脉旁、静脉旁、华通氏胶间充质干细胞Note. A, Human umbilical cord (UC). B-D, Human umbilical cord arteries (UCA), umbilical cord vein (UCV) and Wharton’s jelly (WJ). E-G, Isolation of umbilical cord artery perivascular stem cells (UCA-PSCs), umbilical cord vein perivascular stem cells (UCV-PSCs) and Wharton’s jelly mesenchymal stem cells (WJ-MSCs). H-J, Cells at the third passage showed fibroblastic morphology.Figure 1 Isolation and culture of UCA-PSCs, UCV-PSCs and WJ-MSCs
2.2 脐带动脉旁、静脉旁和华通氏胶间充质干细胞表面标记物鉴定
取P3代人UCA-PSCs、UCV-PSCs和WJ-MSCs流式分析其表面标记物,如图2,UCA-PSCs、UCV-PSCs和WJ-MSCs均高表达CD13、CD29、CD73、CD90、CD105,不表达或低表达CD34、CD45、HLA-DR。其中CD13、CD29、CD90、CD44、CD105都是间充质干细胞特异性的表面标记,而CD34、CD45是淋巴细胞和造血干细胞的表面标记分子[12]。CD146在UCA-PSCs中表达最高,其次是UCV-PSCs,在WJ-MSCs中表达最少(图2A-Z’)。
2.3 脐带动脉旁、静脉旁和华通氏胶间充质干细胞的体外诱导分化
已有文献报道,脐带间充质干细胞可分化为成骨细胞、脂肪细胞和类神经元细胞[13]。为了探讨分离的细胞具有多向分化潜能,取第3代UCA-PSCs、UCV-PSCs和WJ-MSCs,进行体外诱导分化为骨细胞、脂肪细胞以及类神经元细胞。成脂诱导后,细胞形态由长梭形变成圆形,在诱导第12天,UCA-PSCs、UCV-PSCs和WJ-MSCs细胞内开始出现圆形脂滴,有的相互融合,形成较大的脂滴。在诱导第14天,油红O染色显示大小不等的红色脂滴(图3A-C)。细胞经成骨诱导后由长梭形变成片状结构,细胞外基质开始沉积。诱导10 d后,细胞中出现骨性结节,至第21天左右时,细胞形态以多角形为主,中央可见类似结节状结构。茜素红染色后,可见细胞中间有钙化结节出现(图3D-F)。预诱导液诱导后,少数细胞可见隆状突起。24 h后更换为成神经诱导液,诱导1 h后部分细胞开始凋亡,可见细胞形态逐渐成为星状,互相连接,形态具有神经样特征,折光性增强。细胞免疫荧光结果显示:UCA-PSCs、UCV-PSCs和WJ-MSCs经诱导后表达神经元特异性烯醇化酶NSE(图3G-I)以及神经丝NF-M(图3J-L),表现神经样细胞的特征。诱导分化结果表明UCA-PSCs、UCV-PSCs和WJ-MSCs均具有多向分化潜能。
2.4 脐带动脉旁干细胞中PDGFRβ、NG2、α-SMA与CD146的表达情况
通过双重标记CD146、PDGFRβ、NG2与α-SMA的方法标记血管旁细胞[14],本研究中,UCA-PSCs、UCV-PSCs与WJ-MSCs在体外扩增后,通过免疫荧光双重标记CD146与PDGFRβ,可观察到UCA-PSCs在体外扩增后能表达CD146与PDGFRβ,而UCV-PSCs也能表达较弱的CD146与PDGF-Rβ信号,但是WJ-MSCs基本不表达CD146与PDGFRβ(图4A-C),而CD146与NG2,CD146与α-SMA荧光双重标记结果也表明UCA-PSCs表达更多的血管旁细胞的标记物(图4D-I)。

注:A-Z’: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞均高表达CD13、CD29、CD73、CD90、CD105,不表达或低表达CD34、CD45、HLA-DR,CD146在脐带动脉旁干细胞中表达最高,其次是脐带静脉旁干细胞,在华通氏胶间充质干细胞中表达最少。图2 流式分析检测脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞的细胞表面标志物Note. A-Z’, UCA-PSCs, UCV-PSCs, and WJ-MSCs were positive for CD13, CD29, CD73, CD90, CD105, negative for CD34, CD45 and HLA-DR. The expression of CD146 in UCA-PSCs was higher than UCV-PSCs and WJ-MSCs.Figure 2 Flow cytometry analysis of UCA-PSCs, UCV-PSCs, and WJ-MSCs surface markers

注:A-C: UCA-PSCs、UCV-PSCs与WJ-MSCs成脂肪诱导后可见圆形脂滴,油红O染色示细胞内红色脂滴;D-F: UCA-PSCs、UCV-PSCs与WJ-MSCs成骨诱导后,光镜下可见钙沉积呈类结节状,茜素红染色后可见钙沉积;G-I: UCA-PSCs、UCV-PSCs与WJ-MSCs成神经诱导后细胞形成突起,表达神经丝NSE;J-L: UCA-PSCs、UCV-PSCs与WJ-MSCs成神经诱导后细胞形成突起,表达神经丝NF-M。图3 人脐带动脉旁、静脉旁、华通氏胶间充质干细胞体外诱导分化为脂肪细胞、成骨细胞和类神经元细胞Note. A-C, For adipogenic differentiation, UCA-PSCs, UCV-PSCs and WJ-MSCs were cultured in adipogenic induction medium for 14 d. The formation of lipid droplets was confirmed by Oil Red O staining. D-F, UCA-PSCs, UCV-PSCs and WJ-MSCs were cultured in osteogenic supplemented (OS) medium for 28 d. Calcium deposition was confirmed by Alizarin red staining. G-L, Differentiation of UCA-PSCs, UCV-PSCs and WJ-MSCs to neuronal lineage after 24 h pre-induction and 36 h induction was confirmed by immunofluorescence staining of neuron-specific enolase and neurofilament medium polypeptide.Figure 3 The differentiation of UCA-PSCs, UCV-PSCs and WJ-MSCs
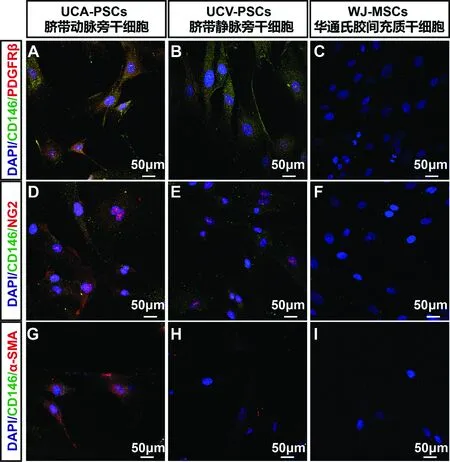
注:A-C:人脐带动脉旁、静脉旁、华通氏胶间充质干细胞的CD146与PDGFRβ的表达情况;D-F:人脐带动脉旁、静脉旁、华通氏胶间充质干细胞的CD146与NG2的表达情况;G-I:人脐带动脉旁、静脉旁、华通氏胶间充质干细胞的CD146与α-SMA的表达情况。图4 人脐带动脉旁、静脉旁、华通氏胶间充质干细胞的血管旁标记物检测Note. A-C, Representative images of co-staining for the CD146/PDGF-Rβ in UCA-PSCs, UCV-PSCs and WJ-MSCs. D-F, Representative images of co-staining for the CD146/NG2 in UCA-PSCs, UCV-PSCs and WJ-MSCs. G-I, Representative images of co-staining for the CD146/α-SMA in UCA-PSCs, UCV-PSCs and WJ-MSCs.Figure 4 The perivascular markers of UCA-PSCs, UCV-PSCs and WJ-MSCs
2.5 脐带动脉旁干细胞体外血管形成能力较强
体外成环实验显示:UCA-PSCs与HUVEC共培养,种植于matrigel基质胶3 h后成环形成大量树枝状的血管环数,多于UCV-PSCs组的血管成环数目,WJ-MSCs组HUVEC体外成环稀少(图5A-C)。随机选取6个高倍镜(100倍)量化血管环数,结果显示,UCA-PSCs+HUVEC组(17.5 ± 1.48,n=6)环状结构数目多于UCV-PSCs+HUVEC组(13.83 ± 0.70,n=6,P<0.05),显著多于WJ-MSCs+HUVEC组(8 ± 1.29,n=6,P<0.001)。分支点数统计结果显示,UCA-PSCs+HUVEC组(15 ± 1.16,n=6)显著多于WJ-MSCs+HUVEC组(7 ± 1.73,n=6,P<0.05),较UCV-PSCs+HUVEC组(11.33 ± 1.86,n=6,P>0.05)未明显增加。与WJ-MSCs+HUVEC组[(100 ± 0)%,n=6]相比,UCA-PSCs+HUVEC组[(185 ± 7.64)%,n=6,P<0.01]与UCV-PSCs+HUVEC组[(146.3 ± 12.81)%,n=6,P<0.05]管长度显著增加(图5D-F)。以上结果提示,脐带动脉旁、静脉旁干细胞尤其是前者的血管形成能力明显优于华通氏胶间充质干细胞。
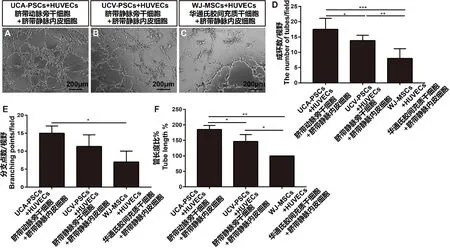
注:A-C: 人脐带动脉旁、静脉旁、华通氏胶间充质干细胞与HUVEC共培养3 h促成环图;D-F: 人脐带动脉旁、静脉旁、华通氏胶间充质干细胞的血管环数,分支点与管长度统计。***P< 0.001,**P< 0.01,*P< 0.05。图5 人脐带动脉旁、静脉旁、华通氏胶间充质干细胞的体外成环实验Note. A-C, UCA-PSCs, UCV-PSCs and WJ-MSCs were cultured with HUVEC plating on Matrigel in 96-well tissue culture plates. D-F, The number of tubes, branching point per field and the total length of tubes per field were quantified 3 h after treatment by counting 6 random fields/well under the microscope.***P< 0.001,**P< 0.01,*P< 0.05.Figure 5 In vitro matrigel tube formation assay of UCA-MSCs, UCV-PSCs and WJ-MSCs

注:A-C: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞组的心肌H&E染色;D-F: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞组的肝H&E染色;G-I: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞组的脾H&E染色;J-L: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞组的肺H&E染色;M-O: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞组的肾H&E染色;P-R: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞组的肌肉H&E染色。图6 NOD-SCID小鼠静脉输注干细胞后器官 H&E染色Note. A-C, The H&E staining of heart showed no significant pathologic changes in UCA-PSCs, UCV-PSCs and WJ-MSCs groups. D-F, The H&E staining of liver showed no significant pathologic changes in UCA-PSCs, UCV-PSCs and WJ-MSCs groups. G-I, The H&E staining of spleen showed no significant pathologic changes in UCA-PSCs, UCV-PSCs and WJ-MSCs groups. J-L, The H&E staining of lung showed no significant pathologic changes in UCA-PSCs, UCV-PSCs and WJ-MSCs groups. M-O, The H&E staining of kidney showed no significant pathologic changes in UCA-PSCs, UCV-PSCs and WJ-MSCs groups. P-R, The H&E staining of muscle showed no significant pathologic changes in UCA-PSCs, UCV-PSCs and WJ-MSCs groups.Figure 6 The H&E staining of organs in NOD-SCID mice with intravenous injection of cells

注:A-C: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞组的心肌H&E染色;D-F: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞组的肝H&E染色;G-I: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞组的脾H&E染色;J-L: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞组的肺H&E染色;M-O: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞组的肾H&E染色;P-R: 脐带动脉旁干细胞、脐带静脉旁干细胞与华通氏胶间充质干细胞组的肌肉H&E染色。图7 NOD-SCID小鼠腹股沟皮下移植干细胞后器官 H&E染色Note. A-C, The H&E staining of heart showed no significant pathologic changes in UCA-PSCs, UCV-PSCs and WJ-MSCs groups. D-F, The H&E staining of liver showed no significant pathologic changes in UCA-PSCs, UCV-PSCs and WJ-MSCs groups. G-I, The H&E staining of spleen showed no significant pathologic changes in UCA-PSCs, UCV-PSCs and WJ-MSCs groups. J-L, The H&E staining of lung showed no significant pathologic changes in UCA-PSCs, UCV-PSCs and WJ-MSCs groups. M-O, The H&E staining of kidney showed no significant pathologic changes in UCA-PSCs, UCV-PSCs and WJ-MSCs groups. P-R, The H&E staining of muscle showed no significant pathologic changes in UCA-PSCs, UCV-PSCs and WJ-MSCs groups.Figure 7 The H&E staining of organs in NOD-SCID mice with transplantation of cells through the skin in the inguinal region

注:A-B: 人胚胎干细胞移植入NOD-SCID小鼠腹股沟观察成瘤;C-D:病理观察可见内胚层的腺管和腔上皮;E: 病理观察可见外胚层的神经组织;F: 病理观察可见中胚层的软骨组织。图8 人胚胎干细胞腹股沟皮下移植NOD-SCID小鼠成瘤实验Note. A-B, The transplantation of human embryonic stem cells generated tumor in NOD-SCID mice. C-F, there were three embryonic tissue layers in NOD-SCID mice.Figure 8 The transplantation of human embryonic stem cells to NOD-SCID mice
2.6 脐带动脉旁、静脉旁和华通氏胶间充质干细胞移植后脏器形态学观察
NOD-SCID小鼠经UCA-PSCs、UCV-PSCs和WJ-MSCs静脉输注和腹股沟移植12周后,进行病理检查,解剖大体观,均未发生结节或肿瘤形成,心、肝、脾、肺、肾、肌肉等脏器均未见明显异常,HE染色均未见明显淋巴细胞浸润、坏死现象(图6A-R)(图7A-R)。阳性对照组NOD-SCID小鼠经胚胎干细胞腹股沟移植后可见直径约1 cm大小的畸胎瘤形成(图8A-B),以及三胚层细胞分化(图8C-F)。
3 讨论
本研究发现UCA-PSCs较UCV-PSCs和WJ-MSCs具有更强的促血管生成能力,且UCA-PSCs、UCV-PSCs与WJ-MSCs华通氏胶间充质干细胞移植入NOD-SCID小鼠安全可靠,提示其可进一步应用于间充质干细胞移植修复。间充质干细胞移植在组织损伤及随后的再生修复相关的多种疾病具有治疗价值[15]。研究表明,MSCs移植在脊髓损伤、心肌缺血和糖尿病视网膜病变中有较佳的疗效[16-18]。MSCs通过分泌各种免疫调节细胞因子,干扰T细胞和树突细胞功能,局部免疫抑制,发挥修复作用[19]。此外,MSCs通过分泌促血管生成因子促进血管生成,胎盘绒毛膜间充质干细胞具有分泌血管生成因子能力,包括血管内皮生长因子(VEGF)和肝细胞生长因子(HGF),可改善小鼠缺血下肢的功能[20];临床研究也表明,MSCs移植入缺血梗死心肌后,心肌功能得到改善[21];这些研究提示MSCs分泌的促血管生成因子可以刺激血管生成并增加局部灌注,有利于组织再生。
研究表明,起源于不同组织和位置的MSCs具有不同的功能特性,间充质祖细胞可从血管周围分离,具有血管旁细胞定位和分子标记物表达鉴定[22]。最新研究表明血管周围的血管旁细胞(pericyte)是MSCs的前体,维持血管的结构完整性和发育及组织稳态[23]。血管生成的速度与质量是损伤修复关键因素,损伤组织必须从血液供应中获取足够的养分及氧气,保证细胞迁移、增殖和分化[24]。血管由内皮细胞和外部的血管旁细胞组成[25]。多种来源的MSCs除了分化为内皮细胞外,还可通过旁分泌血管生成因子,与内皮细胞相互作用以促进血管生成[26]。以往的研究报道人脐带华通氏胶间充质细胞处于缺乏毛细血管的疏松结缔组织中,旁分泌血管生成因子较少,血管生成能力低下[27]。在本研究中,通过体外血管环化实验和细胞迁移侵袭实验发现UCA-PSCs、UCV-PSCs和WJ-MSCs促进体外血管生成能力不同。UCA-PSCs促HUVEC成环和迁移能力皆优于UCV-PSCs和WJ-MSCs。通过双重标记CD146、PDGF-Rβ、NG2与α-SMA的方法从组织定位血管旁细胞[14],本研究中,UCA-PSCs在体外扩增后仍能表达特定的血管旁细胞表面标记物CD146、PDGF-Rβ、NG2与α-SMA,表明UCA-PSCs具有更强的体外血管生成能力。
间充质干细胞的应用涉及体外扩增培养和体内注射治疗两个阶段,其作为组织修复的巨大潜能种子细胞已应用于多项临床试验,但其安全性引起了极大重视。有研究表明,体外扩增的MSCs在移植后可能会发生不良性转化,存在肿瘤发生的潜在风险。人脂肪间充质干细胞(adipose tissue-derived mesenchymal stem cells, Ad-MSCs)在体外长期培养8-10周后,端粒酶活性及细胞周期相关基因失去调节,发生少量染色体畸变[28];小鼠骨髓间充质干细胞(Bone marrow mesenchymal stem cells, BM-MSCs)在体外长期培养后,c-Myc表达增加,且端粒酶活性上调[29]。分化能力检测是MSCs特异性的分析方法,随着体外培养时间增加,MSCs分化能力降低,分化成组织细胞种类减少,分化成特定组织细胞的比例降低[30]。本研究中,UCA-PSCs、UCV-PSCs与WJ-MSCs从脐带中分离获得足量细胞,体外传代3~5次应用于实验,以避免长期培养导致的潜在染色体异常,且其体外具有多向分化潜能,分化能力正常。尽管MSCs显示出正常的形态学特征和表面标志物,但其在体内注射时可能发生染色体异常并发生不良性转化,所以体内成瘤实验是检测MSCs发生不良性转化的可靠方法[31]。研究表明,利用WJ-MSCs移植入动物体内可治疗多种动物疾病模型,且移植方法安全有效。猪慢性缺血性心肌病模型经冠状动脉移植WJ-MSCs后无冠状动脉栓塞等风险,促进心肌再生,改善心功能[32]。兔慢性输卵管炎模型经静脉注射WJ-MSCs后,其迁移至受损输卵管,促进输卵管上皮细胞再生[33]。WJ-MSCs移植入裸鼠体内安全有效[34],但尚无脐带多种来源间充质干细胞的安全性评价研究,因此为了评估UCA-PSCs、UCV-PSCs与WJ-MSCs的移植安全性问题,我们使用NOD-SCID小鼠进行了干细胞体内移植实验,将P3代UCA-PSCs、UCV-PSCs与WJ-MSCs经腹股沟移植或尾静脉注射的方式移植入小鼠体内,移植后三个月未观察到肿瘤形成,多器官组织病理学未发现显著的病理变化。
我们的研究发现,UCA-PSCs、UCV-PSCs与WJ-MSCs经静脉注射和腹股沟移植都是安全可行的,经静脉注射MSCs可通过外周免疫调节作用且在炎症信号引导下经血流迁移到受损区域,减少了迁移至受损区域的细胞数量[35]。而干细胞皮下移植将其可能的免疫调节和营养作用直接集中在受损部位上,而不会产生全身性副作用[36]。但何种移植方式对于干细胞治疗疾病更有效尚需讨论。
