多囊卵巢综合征动物模型数据挖掘及分析
2020-03-30苗晋鑫李秀敏苗明三
苗晋鑫,李秀敏,苗明三*
(1.河南中医药大学,中医药科学院,郑州 450000; 2.纽约医学院,微生物与免疫学系,耳鼻喉系,纽约 10595)
多囊卵巢综合征是育龄妇女代谢和内分泌紊乱疾病,其临床主要特征是多囊卵巢、少或不排卵、高雄激素血症和不育等,是引起妇科癌症、糖尿病和心脑血管疾病的重要因素[1]。其病因和发病机制尚未明确,缺乏有效治疗手段。因此,通过大小鼠、恒河猴、绵羊和牛等动物模型来评估PCOS病因和病理生理。本文通过CNKI数据库以“PCOS+动物模型”和PubMed数据库以“Polycystic ovary syndrome +animal model”为主题,统计1989-2018年用于PCOS动物包括啮齿类、非人灵长类和反刍动物模型的研究性文献。列举PCOS模型常用方法,总结不同模型与人PCOS的异同及应用范围,为PCOS的实验研究提供参考。
1 PCOS啮齿动物模型
1.1 类固醇诱导PCOS模型
1.1.1 产前雄激素(prenatal androgen, PA)诱导PCOS模型
在小鼠妊娠第16~18 天给予250 μg二氢睾酮(dihydrotestosterone, DHT)或大鼠妊娠15~19 d每天给予0.5 mg/kg丙酸睾丸酮(testosterone propionate, TP)处理,导致子代雌性小鼠和大鼠性成熟后生殖系统形态功能和代谢紊乱[2-3]。PA诱导的PCOS模型用来阐明PCOS的病因和发病机理及相关疾病的研究,但不适合下丘脑-垂体-卵巢轴的相关研究。
1.1.2 青春期前雄激素诱导PCOS模型
将19日龄的小鼠连续90 d缓释给予2.5 mg的DHT,导致小鼠出现类似人PCOS生殖和代谢症状相似[4],但此模型胰岛素敏感性下降和血脂紊乱等尚未报道[5]。张娟等[6]在23日龄SD大鼠每日皮下注射0.6 mg/kg的脱氢表雄酮(dehydroepiandrosterone, DHEA)20 d诱导大鼠PCOS模型,该大鼠模型卵泡闭锁和囊状扩张,与临床PCOS卵巢病变相似,但胰岛素抵抗尚未明确[7]。邱树卫等[8]将21日龄大鼠连续28 d皮下注射25 mg/mL的TP,诱导出高雄激素、无排卵和卵巢多囊等症状。TP诱导青春期前雄激素模型无排卵、卵巢多囊化、血清激素水平符合人 PCOS生殖方面特征,但缺少代谢方面研究数据。
1.1.3 青春期后雄激素诱导PCOS模型
Ergenoglu等[9]利用DHT诱导青春期(8~12周)大鼠PCOS模型,发现白藜芦醇可以使卵巢形态回复正在、卵泡数量增加、抗苗勒氏管激素和胰岛素样生长因子1水平降低。啮齿动物诱导PCOS症状是该模型应用的主要限制因素。
1.1.4 来曲唑诱导PCOS模型
来曲唑是一种非甾体芳香酶抑制剂,通过抑制雄激素向雌激素转化使内源性雄激素水平升高[10]。在小鼠PCOS模型中,从21日龄开始,用8 mg来曲唑包埋缓释处理连续90 d,可以导致小鼠性周期紊乱,稀发排卵,卵巢多囊化和非典型出血性囊肿,但小鼠没有出现代谢方面特征[2]。另一研究中,用来曲唑对青春期雌性C57BL/6N小鼠处理5周,导致睾酮(testosterone, T)血清水平增加,雌二醇(estradiol, E2)正常激素水平表达,黄体缺少,卵巢囊性化,出现类似人PCOS的生殖特征。同时出现PCOS代谢紊乱特征,小鼠重量增加、腹部肥胖和脂肪细胞大小增加、糖耐量降低等[11]。来曲唑诱导动物模型表现为PCOS生殖和代谢两方面症状,但停止来曲唑诱导后,小鼠生殖功能恢复。同时,该模型不适合研究雌激素高的多囊卵巢综合征。
1.1.5 雌激素诱导PCOS模型
部分临床PCOS患者的雌激素水平升高,多数研究为戊酸雌二醇(EV)诱导PCOS模型。通过对成年大鼠皮下注射EV诱导PCOS大鼠模型,两个月后大鼠出现卵巢多囊化、T和E2水平升高[12]。雌激素诱导的 PCOS小鼠模型,通过5~7日龄小鼠每天皮下注射20 μg的雌激素,小鼠成年后表现出卵巢多囊化和黄体缺少[13]。虽然EV诱导啮齿动物PCOS模型中卵巢的生理学和解剖学与人类相似,但未见人类典型代谢异常数据,该模型不适合下丘脑-卵巢轴相关研究。此外,雌激素模型的性激素特征和卵巢形态特征也不一致。
1.1.6 糖皮质激素诱导PCOS模型
用糖皮质激素进行产前处理的小鼠表现出与PCOS患者相似的代谢紊乱[14],该模型用于评估PCOS氧化应激对肾脏中线粒体功能的影响。另一个小鼠模型用于评估PCOS的排卵功能障碍和胰岛素抵抗研究。小鼠给予1 mg/kg 的地塞米松后出现卵巢排卵率、T和E2水平升高,糖耐量减少,胰岛素抵抗[15]。
1.1.7 孕激素(Progesterone, P)联合人绒毛膜促性腺激素(hCG)诱导PCOS模型
将炔诺酮硅胶棒埋于23日龄大鼠背部皮下,3 d后皮下注射2.5 IU hCG,每日两次[16]。结果发现类似人的PCOS特征,卵巢重量增加、体积增大,卵巢囊性扩张卵泡,卵巢原始卵泡和颗粒细胞层数减少,T和胰岛素(Insulin, INS)血清水平增加。桂文武等[17]研究发现大鼠卵巢多囊化,颗粒细胞层减少,黄体化激素(LH)和T血清水平升高。该动物模型实验周期短、重复性好,且卵巢与PCOS患者病理形态学和血浆激素水平相似。但该模型对下丘脑-垂体-卵巢轴相关的PCOS的病因分析具有局限性。
1.2 INS联合hCG诱导PCOS模型
INS联合hCG诱导大鼠PCOS首先由Poretsky建立,将成熟的SD大鼠每天皮下注射INS,连续 10 d,从0.5 U递增至6.0 U,再持续给药12 d,同时每天2次皮下注射1.5 U hCG,连续9 d[18]。该模型卵巢组织学改变与人PCOS相似,卵巢多囊化、无排卵,大鼠体内持续LH样作用,出现高胰岛素血症和高雄激素血症。尽管该模型的研究数量不如雄激素模型那么多,但该模型呈典型PCOS特征与临床症状高度相似。该模型与人PCOS患者多个小卵泡囊状扩张和排卵障碍的病变特征存在差异。
1.3 转基因PCOS模型
现代研究发现PCOS具有一定的遗传特性,表现为多基因的相关性。转基因动物是研究疾病发生发展及机制研究的重要研究手段,可以提供研究PCOS复杂的病因学信息。现在已开发多种转基因小鼠模型,显示了人PCOS的一些特征(表1)。雄激素受体(androgen receptor, AR)基因敲除(knockout, KO)小鼠在性成熟后,性周期延长、卵巢多囊化、黄体数目逐渐减少、排卵率和卵泡成熟率下降、产仔数量也减少[19]。AR基因KO小鼠整体缺失AR后,引起雄激素不敏感综合征,影响雄激素在生殖内分泌方面研究。LH转基因小鼠模型表现为LH过表达,卵巢体积增大、卵巢形成囊肿,卵泡和颗粒细胞层数减少、稀发排卵、睾酮和E2水平增加[20]。该模型在LH水平持续升高同时产生了与PCOS无关的特征,如卵巢肿瘤、黄体细胞过多而扩张的卵巢。

表1 PCOS转基因小鼠模型与人PCOS相似性比较
注:+:结构改变;-:正常;ND:未检测;↑:升高或增加;↓:降低或减少;*:延长或紊乱或中断;#:下降或不育。
Note. +, structural change. -, normal. ND: not detected. ↑, increased. ↓, decreased. *, prolonged or disordered or interrupted. #, decreased or infertile.
1.4 持续光照诱导PCOS模型
啮齿动物发情周期与昼夜系统相关,光暗周期可以控制动物促性腺激素和排卵情况。研究者通过将大鼠置于连续光照下诱导PCOS,发现持续光照大鼠性周期紊乱、卵巢多囊化、卵巢包膜、间质细胞增生[33]。同时卵巢内膜和间质细胞发生酶促反应引起高雄激素血症和高雌激素血症[34]。持续光照PCOS模型在无激素条件下可诱导PCOS,但该模型转至正常光照周期环境,PCOS特征可恢复正常。因此,需要进一步评估该模型在PCOS病因和发病机制与PCOS患者的相似性。
1.5 其他诱导PCOS模型
通过DHEA联合INS诱导42日龄大鼠,发现大鼠性周期紊乱,卵巢重量增加和体积增大,卵巢多囊化、无排卵、高雄激素血症等PCOS典型特征[35]。该模型缺乏稳定性和持久性,不利于研究PCOS长期及并发症的研究。大鼠皮下注射20 IU孕马血清促性腺激素(pregnant horse serum gonadotropin, PMSG),然后分别在16 h和40 h后连续两次皮下注射2 mg米非司酮(RU486),同时在PMSG注射48 h后注射20 IU hCG,结果显示破坏的卵巢透明质酸结合蛋白1和相关基质金属蛋白酶过度活化导致异常卵泡成熟的PCOS大鼠模型[36]。RU486是诱导高丙酸血症特定模型。周越等[37]通过D-半乳糖诱导20周龄ICR小鼠,发现小鼠发情周期紊乱,卵巢多囊化,卵巢闭锁增多和颗粒细胞层数减少,睾酮、胰岛素和E2水平升高,促卵泡生长激素水平下降。将妊娠期大鼠置于慢性冷应激状态(4℃,3 h/d),结果发现新生大鼠卵巢中原始卵泡、发育卵泡和健康卵泡比例降低,孕酮、T和E2水平升高,显示出多囊卵巢特征[38]。该模型常用于交感神经活动影响生殖功能的卵巢病变中作用。
2 PCOS非人灵长类动物模型PA诱导PCOS模型
通过PA诱导猴子生殖和多种代谢异常,表现高度类似人PCOS特征的动物模型。研究者在雌性恒河猴妊娠第40~44 天,每天皮下注射10 mg TP,连续15~35 d[39]。结果发现类似于PCOS患者,恒河猴卵巢多囊和排卵功能障碍,高雄激素血症,腹部脂肪增多[40]。早期PA诱导恒河猴表现出与人类PCOS类似的代谢紊乱,主要是腹部肥胖和胰岛素-葡萄糖代谢受损,这可能与胰腺B细胞功能障碍有关[41-42]。
3 PCOS反刍动物模型
3.1 PA诱导PCOS模型
多项研究证明母羊子宫内过量的雄激素导致促性腺激素分泌不可逆缺陷,最终导致PCOS。妊娠母羊肌肉注射TP(100 mg,每两周一次),在147 d妊娠期内的第30天和第90天之间注射60 d[43]。结果显示卵巢中卵泡发育受阻、滤泡囊肿增加这与人PCOS一致。PA处理母羊出生的子代内分泌激素异常,表现为LH浓度增加[44]。产前雄激素化的母羊是研究子宫内PA处理的有益模型,以及对下丘脑-垂体-卵巢轴的影响,但对心脏代谢研究有限制。
3.2 糖皮质激素诱导的PCOS模型
常用牛作为单卵动物被用于糖皮质激素诱导PCOS动物模型。研究者利用地塞米松诱导奶牛胰岛素抵抗,发现奶牛葡萄糖和胰岛素增加、无排卵和E2减少等PCOS特征[45]。由于奶牛具有与人类相似的单卵,必须经历卵泡选择过程,该模型将有利于研究卵泡生长、偏离和排卵变化及生殖激素等。
4 小结
各种类型的PCOS动物模型已被用于不同研究。在啮齿类、非人灵长类和反刍动物中类固醇诱导的模型应用最多,尤其是PA诱导的产前或产后不同发育阶段的PCOS动物模型。来曲唑模型可用于研究PCOS各个方面。转基因小鼠的PCOS模型为我们理解某一基因在PCOS病理机制中发挥重要作用。目前常用方法建立的大部分PCOS动物模型都具有卵巢多囊样变的特点,有的还有内分泌和代谢异常(表2)。动物模型的研究结果可以为人类PCOS的生理学和病理学提供新的见解,为开发治疗和预防女性PCOS提供帮助。
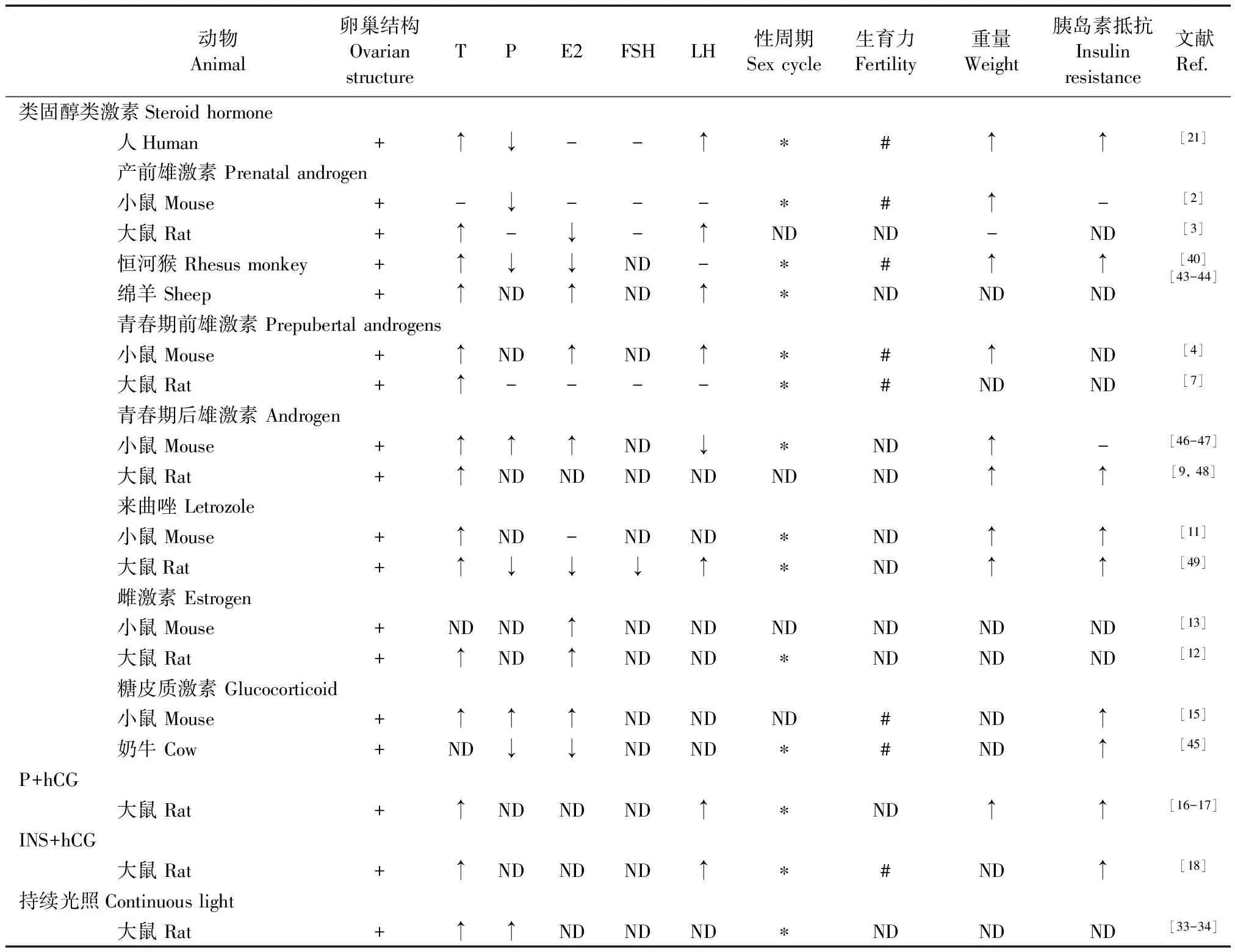
表2 PCOS动物模型与人PCOS相似性比较
注:+:结构改变;-:正常;ND:未检测;↑:升高或增加;↓:降低或减少;*:延长或紊乱或中断;#:下降或不育。
Note. +, structural change. -, normal. ND, not detected. ↑, increased. ↓, decreased. *, prolonged or disordered or interrupted. #, decreased or infertile.
