稳定高表达人GPC3的SK-Hep-1细胞系的构建
2020-03-30何琦琳郎巧利葛良鹏
何琦琳,郎巧利,余 琳,黄 楠,杨 希,葛良鹏
(重庆市畜牧科学院,重庆市医用动物资源开发与利用工程技术研究中心,重庆 402460)
磷脂酰肌醇蛋白聚糖3(glypican-3,GPC3)是一种表达于细胞表面的硫酸乙酰肝素蛋白类聚糖,通过细胞膜上的糖基磷脂酰肌醇(glycosyl-phosphatidylinositol,GPI)锚定连接于细胞表面[1-2]。人GPC3基因位于人染色体Xq26上,编码580个氨基酸,核心蛋白约70×103,在第358位和359位氨基酸之间,可被弗林蛋白酶裂解成一个与膜结合的大小为30×103羧基端蛋白和一个大小为40×103的氨基末端蛋白[3-4]。GPC3与多种癌症的发生发展有密切关系,特别是肝癌,GPC3常在肝癌患者中高表达(72%~81%),GPC3是原发性肝细胞肝癌(hepatocellular carcinoma,HCC)细胞表面特异性膜蛋白,可作为肝癌肿瘤抗原的理想靶点[5-12]。目前已开发有多个GPC3治疗性抗体[13-17],发现GPC3治疗性抗体对HCC有明显的抑制作用,但进入临床以后的效果良莠不齐,研究和开发GPC3治疗性抗体任重而道远。目前,在GPC3治疗性抗体的研发中,需要能稳定高表达GPC3蛋白的肝癌细胞对抗体进行功能性验证。其中能够表达GPC3蛋白的肝癌细胞系有HepG2、Hep3B、HT17、HuH6、HuH7及PLC/PRF/5[18],但大多表达量不高不能满足研究的要求。因此,本研究将利用电穿孔法将pcDNA3.1-GPC3载体转染至SK-Hep-1肝癌细胞中,构建稳定高表达人GPC3的SK-Hep-1细胞系,为进一步开发GPC3治疗性抗体奠定基础。
1 材料和方法
1.1 实验材料
SK-Hep-1细胞购自美国ATCC。
1.2 主要试剂与仪器
AmaxaTMCell Line NucleofectorTMKit V转染试剂购自瑞士LONZA;载体质粒pcDNA3.1(+)购买自美国invitrogen公司;细胞培养试剂DMEM、青链霉素、G418及PBS均购自美国Gibco公司;胎牛血清购自以色列Biological Industries;0.25%胰酶购自武汉Procell;EasyPureHipure Plasmid Maxiprep Kit试剂盒购自北京全式金;Tween20和细胞裂解液均购自上海碧云天;Anti-Glypican 3 antibody、Goat Anti-Mouse IgG H&L(HRP)、Goat Anti-Mouse IgG H&L(Alexa Fluor®488)抗体均购自英国abcam公司。
细胞CO2培养箱(eppendrof公司,德国);Lonza电转化仪(Lonza公司,德国);超净工作台(北京哈东联);FACSVerseTM流式细胞仪(BD,美国);Odyssey CLx双红外激光成像系统(LICOR公司,美国);CloneSelect Imager细胞生长分析系统(molecular devices公司,美国)。
1.3 实验方法
1.3.1 pcDNA3.1-GPC3质粒构建与鉴定
以GenBank中人的GPC3基因序列(Gene ID:2719)为参考模板,构建人GPC3 cDNA序列至真核表达质粒pcDNA3.1(+)中,重组质粒构建及测序由金唯智公司完成。将构建的含重组质粒pcDNA3.1-GPC3的大肠杆菌接种至LB培养基中,扩大培养过夜,提取质粒DNA用NheI和XbaI双酶切鉴定。重组质粒pcDNA3.1-GPC3表达的GPC3蛋白不带任何标签。
1.3.2 SK-Hep-1细胞最佳G418筛选浓度的确定
取生长良好的SK-Hep-1细胞,消化后制备成细胞悬液,按1×104/孔接种入24孔板中,24 h后开始G418加压。分别用含0 μg/mL、200 μg/mL、300 μg/mL、400 μg/mL、500 μg/mL、600 μg/mL、700 μg/mL、800 μg/mL、900 μg/mL、1000 μg/mL的G418筛选培养基进行筛选,每个梯度做3个重复,10~20 d后选择能够使所有细胞死亡的最小G418浓度即为最佳筛选浓度。
1.3.3 SK-Hep-1细胞电转及筛选
转染前一天将细胞传代至75 cm2培养瓶中培养,待贴壁细胞长至70%~90%时转染。配制转染液1管100 μL(81 μL Nucleafeceor solution,19 μL supplement)轻轻混匀,室温放置30 min。将细胞从培养箱取出,弃掉液体,用PBS洗2遍,加入0.25%胰酶消化细胞后加入预热的培养基终止重悬,吸至15 mL离心管1500 r/min离心5 min,弃上清,PBS洗涤一次后用1 mL PBS重悬计数,取1×104cell加至1.5 mL离心管中,1500 r/min离心5 min。吸干液体,加入100 μL转染混合液重悬细胞沉淀。再加入总量为2 μg的质粒混合后加至电转杯中,放入电转染仪中转染10 s。电转完后立即取出电转杯,加入预热的培养基0.5 mL至电转杯中,将细胞吸取至含有0.5 mL培养基的24孔板中,放入37℃培养箱中培养,并设置转染pcDNA3.1(+)空载体的SK-Hep-1细胞作空白对照。转染48 h后更换含有筛选浓度G418的培养基进行筛选培养。16 d后,将筛选获得的阳性细胞扩大培养,扩大培养后使用含筛选浓度一半的G418培养基维持培养并保存。取10代以内的稳定转染细胞进行后续试验。
1.3.4 Western blot检测GPC3蛋白表达情况
收集筛选获得的稳转细胞SK-Hep-1-GPC3,加入细胞裂解液,用枪反复吹打后孵育3 min裂解细胞。取裂解后细胞上清,向样品中加入上样缓冲液及还原剂,沸水煮5 min后进行SDS-PAGE电泳,再电转至PVDF膜上。用5%脱脂奶粉封闭PVDF膜1 h,再anti-Glypican-3 antibody(稀释比例为1∶3000)4℃孵育过夜。PBST洗3次后,加入Goat Anti-Mouse IgG H&L(HRP)(稀释比例为1∶8000)室温孵育1 h,PBST洗3次后,用Odyssey CLx仪器进行扫描成像。
1.3.5 流式检测细胞表面GPC3表达情况
将生长良好的SK-Hep-1-GPC3细胞消化后,用PBS(含有2% FBS)稀释成5×105/mL的细胞悬液,800 r/min 4℃离心5 min。加入Anti-Glypican-3 antibody抗体,4℃孵育30 min,PBS洗细胞2次后加入Goat Anti-Mouse IgG H&L(Alexa Fluor®488),PBS洗细胞2次,再加入500 μL的PBS重悬,用BD FACSVerseTM进行流式检测。
2 结果
2.1 GPC3的合成及表达载体构建
本实验根据NCBI中公布的GPC3序列(Gene ID: 2719)合成了GPC3基因序列并插入到真核表达载体pcDNA3.1(+)中,构建pcDNA3.1-GPC3重组质粒。经测序检测证明插入序列与公布的GPC3序列一致(部分测序图见图1)。
图1 部分测序图Figure 1 Part of the sequencing map
2.2 重组真核表达质粒鉴定
重组的pcDNA3.1-GPC3质粒提取后,经NheI和XbaI双酶切后,获得两条片段,与预期条带大小一致(见图2)。

注:1:质粒pcDNA3.1-GPC3;2:双酶切重组质粒;3:DL5000 marker。图2 pcDNA3.1-GPC3重组质粒双酶切鉴定Note. 1, pcDNA3.1- GPC3; 2, Double enzymes digestion of pcDNA3.1-GPC3; 3, DL5000 marker.Figure 2 Identification of pcDNA3.1-GPC3 digested by NheI and XbaⅠ
2.3 SK-Hep-1细胞最佳G418筛选浓度确定
G418筛选7 d后细胞开始大量死亡(图3A),筛选后第15天,700 μg/mL组细胞死亡80%(图3B),第20天细胞全部死亡的最小G418浓度为700 μg/mL(图3C),未转染细胞生长状态良好(图3D)。故SK-Hep-1 G418最佳筛选浓度为700 μg/mL。

注:A:第7天(G418浓度为700 μg/mL组);B:第15天(G418浓度为700 μg/mL组);C:第20天(G418浓度为700 μg/mL组);D:对照细胞(未加G418)。图3 最佳G418筛选浓度的确定Note. A, Culture at the seventh day (700 μg/mL group). B, Culture at the 15th day (700 μg/mL group). C, Culture at the twentieth day (700 μg/mL group). D, Control cells (0 μg/mL group).Figure 3 Determination of the optimal screening concentration of G418
2.4 Western blot检测GPC3的表达
Western blot检测稳定转染细胞GPC3的表达,同时与HepG2细胞的GPC3蛋白表达量进行比较,结果显示SK-Hep-1细胞不能表达GPC3蛋白,而稳定转染细胞SK-Hep-1-GPC3能够表达GPC3蛋白,并且表达量显著高于HepG2细胞(见图4)。
2.5 流式细胞检测稳定转染细胞表面GPC3的表达
利用流式细胞术检测稳定转染细胞系SK-Hep-1-GPC3细胞表面GPC3的表达,同时用正常的未转染SK-Hep-1细胞作对照,结果获得细胞表明GPC3蛋白阳性率为100%的稳定细胞系(见图5)。
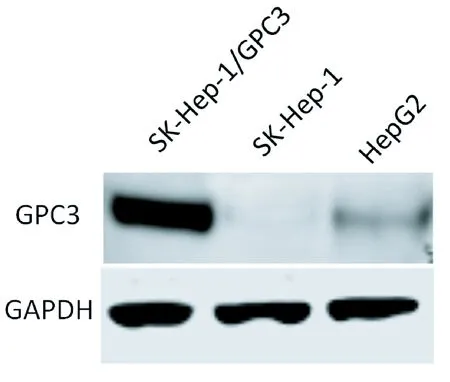
图4 Western blotFigure 4 Western blot

图5 流式细胞术Figure 5 Flow cytometry
3 讨论
癌症一直以来给人类生命健康造成了巨大的危害,在我国癌症已经位居主要疾病死亡率的首位。其中我国肝癌(主要是原发性肝细胞癌)的病例数占全球的46.7%,成为我国第二大癌症,其发病率和死亡率均呈现逐年上升的趋势[19-21]。因此,肝癌研究在中国意义重大,越来越多的中国专家学者开展了相关研究[22-26]。由于大部分肝癌发现时已处于晚期,采取靶向治疗和免疫治疗的研究越来越多,出现了许多分子靶向药物和治疗性抗体来靶向治疗肝细胞癌[27]。研究与开发肝癌特异性靶点药物具有十分重要意义。GPC3在肝细胞瘤组织中高表达,而在正常肝组织中几乎不表达,其是HCC病理诊断的肿瘤标志物[28-30],也是肝癌治疗性抗体研发的新靶点。能否获得靶蛋白高效表达稳定转染细胞系是抗体药物开发的关键。然而,目前可购买的野生型肝癌细胞中,细胞表面GPC3表达量均相对较低。本研究根据NCBI中报道的GPC3序列,成功构建了真核表达载体pcDNA3.1-GPC3,酶切鉴定结果与预期相符(图2)。通过电穿孔法成功将pcDNA3.1-GPC3转染至SK-Hep-1,并通过G418筛选获得稳定表达GPC3的SK-Hep-1-GPC3细胞系。Western bolt和流式鉴定细胞表面GPC3表达情况(图4和图5),表明SK-Hep-1-GPC3细胞系能在细胞表面稳定表达GPC3蛋白,且其表达量较能天然表达GPC3的HepG2细胞更高。
本研究采用电穿孔转染方法将pcDNA3.1-GPC3转染至SK-Hep-1细胞,并筛选获得了稳定高表达GPC3的SK-Hep-1-GPC3的稳转细胞系,为进一步研究与开发治疗性GPC3抗体奠定了基础。
