复方蒲公英制剂幼龄大鼠重复给药毒性研究
2020-03-30张城达宋翼升白海波黄敏聪陈云祥郑高利张立将
张城达,宋翼升,扈 荣,白海波,谢 锋,黄敏聪,陈云祥,郑高利,张立将*
(1.浙江省医学科学院安全性评价研究中心,杭州 310053; 2.杭州华东医药集团新药研究院有限公司,杭州 310005)
急性扁桃体炎是由细菌或病毒引起腭扁桃体的急性非特异性炎症,是小儿内科的多发病[1]。临床上常以对症处理为主,使用大量抗生素,但副作用大,易发生耐药、反复发作而成为慢性扁桃体炎[2]。复方蒲公英制剂为中药复方制剂,以蒲公英(TaraxacummongolicumHand-Mazz)等4种具有清热解毒作用或清肺利咽功效的中药材经水煎提取而成,临床拟联合抗生素治疗儿童急性扁桃体炎、咽炎,达到减轻症状、缩短病程、增强疗效的目的。
复方蒲公英制剂中的蒲公英等4味中药已在临床上大量使用,已有丰富的临床使用数据,但专门针对6岁以上儿科人群的复方蒲公英制剂是一种创新药,且没有前期的动物和临床安全性数据,不能确定对儿童发育中器官系统是否有潜在安全性担忧。根据国际人用药品注册技术协调会(ICH)《S11:Nonclinical safety testing in support of development of paediatric medicines(Draft)》指导原则中证据权重法(WoE)要求以及我国原国家食品药品监督管理总局药品审评中心(CDE)《儿科用药非临床安全性研究技术指导原则(征求意见稿)》和CDE对中药儿科用药非临床安全性评价的考虑共识,复方蒲公英制剂临床试验申请前需要进行幼龄动物毒性试验(Juvenile Animal Study, JAS)[3-6]。JAS没有一个标准的设计,药品监管部门对此无统一要求,原则上基于研究目的和科学原理做逐案处理,具体情况具体分析,以支持相应年龄段的儿科人群进行临床试验[7-8]。对于儿科专用/先是儿科药物,由于没有成年动物/成人研究的支持,应该采用类似于成年动物毒理学实验的筛选式JAS设计[4,7]。
根据上述指导原则要求,本研究考察幼龄SD大鼠连续4周(Postnatal Day(PND)27~ PND54)经口给予“复方蒲公英制剂”(给药结束恢复4周)可能产生的一般毒性以及对幼龄动物发育毒性的影响,确定未观察到不良反应剂量(NOAEL),为临床试验提供参考依据。同时通过本试验探索合适的幼龄动物毒性评价指标,为中药的JAS提供可行的评价体系供参考。
1 材料和方法
1.1 实验动物
SPF级SD大鼠,21日龄(PND21),144只,雌雄各半,雄鼠体重42~61 g,雌鼠体重37~59 g。购自浙江维通利华实验动物有限公司[SCXK(浙)2018-0001],动物饲养于浙江省医学科学院安全性评价研究中心屏障系统动物房[SYXK(浙)2017-0010],每笼饲养同性别动物不多于5只,自由饮水摄食,室温20.5℃~23.5℃,相对湿度50%~69%,12 h明、12 h暗。本实验由浙江省医学科学院安全性评价研究中心实验动物管理和使用委员会(Institutional Animal Care and Use Committee,IACUC)审核动物伦理,动物伦理审批号:GLP-A-020,本试验过程中严格遵守动物使用的3R原则。
1.2 主要试剂与仪器
复方蒲公英制剂(批号:171001),由杭州华东医药集团新药研究院有限公司生产提供,每克浸膏粉相当于生药5.4 g;棕黄色至棕褐色粉末,气微,微苦,溶于水。受试物临用前用纯水配制成所需浓度。
血液学检查试剂(Siemens);生化学检查试剂(德国 DiaSys);Anti-rat CD3 FITC、Anti-rat CD45RA PE、Anti-rat CD8a PE、Anti-rat CD4 APC(BD公司);大鼠免疫球蛋白A(IgA)、补体4(C4)、骨钙素(BGP)、睾酮(T)、雌二醇(E2)、类胰岛素生长因子-1(IGF-1)、类胰岛素生长因子结合蛋白-3(IGFBp-3)、生长激素(GH) ELISA试剂盒(R&D公司)。
ADVIA2120全自动血细胞分析仪(美国 Bayer);7100全自动生化分析仪(日本 日立);CA-1500全自动血凝分析仪(日本 Sysmex);N-600尿液分析仪(长春 迪瑞);Top Scan动物行为分析系统(CSI 公司);BD FACS Calibur流式细胞仪(美国 BD);Synergy HT酶标仪(Bio Tek);Discovery-Wi骨密度仪(Hologic);Welch Allyn 12500双目间接检眼镜(美国伟伦);80i显微镜(日本尼康)。
1.3 实验方法
1.3.1 动物分组及剂量设计
144只幼龄SD大鼠(雌雄各半),按体重随机分为4组(即溶媒对照组、低剂量组、中剂量组和高剂量组),每组36只(雌雄各半),分别每天灌胃(ig)给予纯水、复方蒲公英制剂1.2、3.8、12 g/kg,给药体积均为1 mL/100 g,每天2次(给药间隔2~3 h),连续给药4周(28 d)。
1.3.2 剂量设计依据
低剂量相当于幼龄大鼠等效剂量;高剂量为最大可行剂量(MFD),即以最大浓度、幼龄大鼠最大给药体积给药;中剂量等比设置。
1.3.3 起始给药年龄和给药期限
受试物拟使用人群为6岁以上儿童(6~12岁),根据人和大鼠对应的发育阶段[9],本试验从PND27开始给药,经口灌胃(ig),连续给药28 d(PND27 ~ PND54,覆盖儿童期初期至青少年期),可以支持6岁以上儿童的疗程为1周的临床试验及临床应用。
1.3.4 检测指标
试验期间每天观察动物的临床症状;大鼠的体重和摄食量在给药期每周各称量2次,恢复期每周各称量1次;雄鼠于PND31 ~ PND50、雌鼠于PND24 ~ PND37每天进行性征发育观察(龟头包皮分离情况/阴道张开情况);所有大鼠每周检查1次顶臀长;给药中期、给药结束检查和恢复期结束检查分别对全部存活大鼠进行一般行为学检查;给药结束检查、恢复期结束检查对各组同批大鼠(5或6只/性别/组)进行水迷宫试验。给药结束检查和恢复期结束检查分别随机抽样80只(每组20只,♀♂各半)和64只(每组16只,♀♂各半)进行常规重复给药毒性指标以及发育毒性相关指标检查。具体指标,见表1。
1.4 统计学方法

2 结果
2.1 临床症状、体重、摄食量
各动物组均未出现动物死亡或濒死。高剂量组大鼠仅在给药后出现一过性流涎(持续约10~20 min左右恢复),未见其他异常;中、低剂量组未见任何异常。主要高剂量组雄鼠体重和摄食量有一定降低影响,具体表现为:高剂量组雄鼠在给药期第12、19、25、28天的体重显著低于溶媒对照组(P<0.05),其余各组雌雄大鼠体重未见明显变化(P>0.05);高剂量雄鼠给药期第5、8、12天的摄食量明显低于溶媒对照组(P<0.05或P<0.01),其余各组大鼠摄食量未见明显变化(P>0.05)。恢复期间,各组体重、摄食量均未见明显异常,见图1和图2。
2.2 血液学
仅高剂量组雌雄大鼠给药结束检查部分血液学指标有一定的异常影响,低、中剂量组给药结束检查及各剂量组恢复期结束检查雌雄大鼠血液学指标均未见明显异常和毒性影响。主要表现为给药结束检查时高剂量组雌雄大鼠RBC、HGB、HCT显著降低(P<0.05或P<0.01),#RETIC、%RETIC、RDW显著升高(P<0.05或P<0.01),这些指标变化与造血功能影响相关,但给药结束4周后恢复期结束检查时上述指标均恢复正常,见表2。

表1 复方蒲公英制剂对幼龄大鼠毒性检测指标
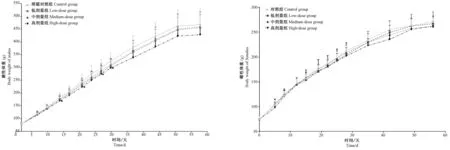
注:与溶媒对照组比较,*P<0.05。图1 雄性/雌性大鼠体重增长曲线Note. Compared with the control group,*P<0.05.Figure 1 Weight curve of male/female rats

注:与溶媒对照组比较,*P<0.05,**P<0.01。图2 雄性/雌性大鼠摄食量曲线Note. Compared with the control group,*P<0.05,**P<0.01.Figure 2 Feed intake curve of male/female rats
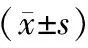
表2 复方蒲公英制剂对幼龄SD大鼠血液学的影响
注:与溶媒对照组比较:*P<0.05,**P<0.01。
Note. Compared with the control group,*P<0.05,**P<0.01.
2.3 生化学
复方蒲公英制剂主要对高剂量组雌雄大鼠给药结束检查时血清生化学部分脂代谢、糖代谢、电解质相关指标有一定的异常影响,低、中剂量组给药结束检查及各剂量组恢复期结束检查雌雄大鼠血液学指标均未见明显异常。具体主要表现有:给药结束检查时雄性大鼠高剂量组T.CHO、TG、GLU、Na+,中剂量组T.CHO显著降低(P<0.05或P<0.01),高剂量组K+显著升高(P<0.05);雌性大鼠高剂量组TG、Na+显著下降(P<0.05或P<0.01),K+显著升高(P<0.05),其余指标未见明显异常,见表3。
2.4 尿液、眼科及骨髓细胞形态学
给药结束检查时,高剂量组大鼠酮体、蛋白质、白细胞、比重、pH、微白蛋白升高(P<0.05或P<0.01);中剂量组雄性大鼠pH、微白蛋白升高(P<0.05),雌性大鼠比重升高(P<0.01)。各组其余尿液指标未见明显异常。恢复期结束时,各剂量组上述异常均恢复,见表4。
眼科检查、骨髓细胞形态学指标均未见明显异常和毒性影响。
2.5 生长发育、性激素及骨骼系统发育
复方蒲公英制剂主要对高剂量组大鼠顶臀长有短暂的可逆性的减小影响,主要表现为高剂量组雄鼠给药期第28天、雌鼠给药期第22天的顶臀长短于溶媒对照组(P<0.01);给药期中、低剂量组及恢复期各组大鼠的顶臀长与溶媒对照组均无显著性差异(P>0.05)。各剂量组幼龄雄鼠的龟皮分离出现时间、幼龄雌鼠的阴道张开出现时间,睾酮(T)、雌二醇(E2)、股骨骨密度、股骨长、血清骨钙素水平均与溶媒对照组无显著性差异(P>0.05)。各剂量组雄鼠的GH、IGFBp-3、IGF-1水平均与溶媒对照组无显著性差异(P>0.05);给药结束检查,各组雌鼠中剂量组GH显著升高(P<0.01),其余各组雌鼠IGFBp-3、IGF-1水平与对照组未见明显差异(P>0.05);恢复期结束检查,雌鼠高、低剂量组GH和高、中、低剂量组IGF-1显著降低(P<0.05或P<0.01),各组雌鼠IGFBp-3与对照组未见明显差异(P>0.05);见表5。鉴于给药结束时各剂量组GH、IGF-1均未见明显异常(仅中剂量GH出现无剂量-时效关系的小幅波动),各剂量组恢复期间顶臀长、骨骼系统发育其他指标(长骨长、骨密度、骨钙素等)也均未见明显异常,见表6,且上述异常的GH、IGF-1数值波动幅度较小,综合考虑无明显毒理学意义。

表3 复方蒲公英制剂对幼龄SD大鼠血清生化学影响(给药结束检查,
注:与溶媒对照组比较:*P<0.05,**P<0.01。
Note. Compared with the control group,*P<0.05,**P<0.01.

表4 复方蒲公英制剂对幼龄SD大鼠尿液指标的影响(给药结束检查)
注:整组(各分类/等级水平)总体与溶媒对照组比较:*P<0.05,**P<0.01。
Note. Compared with the control group,*P<0.05,**P<0.01.

表5 复方蒲公英制剂对雌性幼龄SD大鼠生长发育相关激素的影响
注:与溶媒对照组比较:*P<0.05,**P<0.01。
Note. Compared with the control group,*P<0.05,**P<0.01.
2.6 行为记忆
改良Irwin’s行为学评价:复方蒲公英制剂仅对中、高剂量组幼龄大鼠的应激情绪反应类指标(应激性发声、转移唤醒异常、触摸逃避异常等)发生率略有升高影响(P<0.05或P<0.01),见表7。这些异常可能与大鼠反复被抓取并给予中药受试物所产生的应激条件反射或应激性心理情绪有关。
Morris水迷宫试验:复方蒲公英制剂对雌雄大鼠水迷宫训练期间的潜伏期时间和空间探索测定时到达平台的相关指标,均未见明显影响。
2.7 免疫学指标检查
给药结束检查时,大鼠脾重量和脏器系数有升高趋势,其中雌性高剂量显著高于溶媒对照组P<0.05或P<0.01);雄性大鼠高剂量组IgG明显升高(P<0.05),其余各组指标未见明显异常;恢复期结束检查时未见异常,见表8。
2.8 脏器重量及系数及组织病理学检查
除给药结束检查无毒理学意义的个别肝系数、肾系数升高波动外,各脏器重量级系数未见显著性差异。镜检主要发现,给药结束检查时高剂量组大鼠出现脾、肝轻度/轻微髓外造血和骨髓红系造血细胞轻度增生,恢复期结束均恢复,其他脏器组织未见明显病理学改变,见图3。

表6 复方蒲公英制剂对幼龄SD大鼠骨骼发育的影响(给药结束检查,
注:整组(各分类/等级水平)总体与溶媒对照组比较:*P<0.05,**P<0.01。
Note. Compared with the control group,*P<0.05,**P<0.01.

表8 给药结束检查复方蒲公英制剂对幼龄大鼠免疫指标的影响
注:与溶媒对照组比较:*P<0.05,**P<0.01。
Note. Compared with the control group,*P<0.05,**P<0.01.
3 讨论
我国缺乏专门的儿科药物,临床上常采用在成人剂量基础上进行减量来解决儿童专用药短缺问题。但是由于儿科人群的特殊性,儿童不等于小的成人,因为儿童在生理、心理和发育方面与成人不同,这就导致了预期药物的毒性与成人间存在差异[6,10]。所以美国食品药品管理局(FDA)、欧盟药监局(EMA)要求除了仿制药、生物类似物、指定罕用适应证/孤儿药、失去专利保护的药物和已经被广泛使用的产品,其它药物研发必须包含儿科研究计划(Pediatric Study Plan, PSP; Pediatric Investigation Plan, PIP),必须开展儿科用药临床前安全性评价,提交幼龄动物安全性数据[11]。然而我国对于儿科用药尤其是儿科中药的非临床安全性评价研究尚属于起步阶段,评价技术体系还有待完善。
自2006年起,FDA、EMA、日本厚生劳动省(JMHLW)、ICH等机构相继颁布了儿科用药非临床安全性研究技术指导原则(或草案)来规范、促进儿科药物的研发[3,12-14]。但上述指导原则主要涉及化学药和生物制品,并未涉及中药。2017年我国CDE起草公布的《儿科用药非临床安全性研究技术指导原则》(征求意见稿),推进了我国儿科用药监管要求与国际技术要求的进一步接轨,且明确适用于中药。
复方蒲公英制剂是一种中药复方新药,临床拟用人群为6岁以上儿童(6~12岁)。本研究结果显示,幼龄SD大鼠连续4周(PND27 ~ PND54,每天给药2次)重复经口灌胃给予复方蒲公英制剂1.2、3.8、12 g/kg剂量,高剂量组出现一定异常或毒性反应,而中、低剂量组未见明显的毒性影响。给药期间,高剂量组大鼠出现流涎、体重和摄食量减轻,给药结束后即可恢复,可能与幼龄大鼠经口给予大体积高浓度中药有关。而高剂量组顶臀长的增长减缓与体重变化呈正相关。给药结束检查时,高剂量组大鼠网织红细胞的增多考虑为由于红细胞减少而引起代偿性的骨髓生成的幼红细胞的增加;而组织病理学发现的脾、肝轻度/轻微髓外造血和骨髓红系造血细胞轻度增生(给药结束后即可恢复正常),可能也与给药后大鼠出现的贫血倾向(红细胞、血红蛋白降低,网织红细胞升高等)相关的代偿性影响有关。然而,给药结束检查时骨髓细胞形态学并未出现明显与粒、红细胞系相关的异常,可能因为上述贫血症状及其代偿性造血程度较轻,尚未能引起骨髓细胞各分类比例的明显变化。综合考虑,上述红细胞系指标异常可能为药物相关的可逆的溶血性贫血,给药结束即可恢复,与受试物的药物作用有一定关系,提示血液红细胞可能为本受试物的毒性靶组织,临床上要注意监测红细胞指标的变化。给药结束检查时中剂量组雄鼠、高剂量雌雄大鼠在给药结束检查时T.CHO、TG、GLU水平均低于溶媒对照组,提示本品在体内对脂肪代谢及糖代谢有一定作用。这一作用可能与复方中所含的一味药材的降糖降脂药理学作用(降糖降脂)有关,可能为药理作用的延伸或放大。给药结束检查时,高剂量组雌雄大鼠均有Na+↓、K+↑,其中K+↑考虑可能与红细胞减少及溶血性贫血相关。
给药结束检查时,复方蒲公英制剂对高剂量组雌雄大鼠部分尿液指标(酮体↑、蛋白质↑、白细胞↑、比重↑、pH值↑、微白蛋白↑)以及中剂量组部分尿液指标(雄鼠pH↑、微白蛋白↑,雌鼠比重↑)有一定影响,上述异常在恢复期结束时基本恢复正常。酮体为脂肪氧化物产生的中间代谢产物,这与血脂降低(脂肪代谢增加)有关联性;以上尿液指标有一定的剂量-反应关系,给药结束后可恢复,故考虑也可能与给予大体积高浓度的中药后通过尿液排泄出的药物原型或代谢产物的理化性质有关。但结合肾功能相关血清指标并无异常、肾脏并未见明显组织病理学异常,且上述尿液异常波动幅度较小,故综合考虑无明显的毒理学/临床意义。
复方蒲公英制剂其中一味药材有报道称其提取物可以明显提高小鼠机体的免疫功能,如增强杀伤性T细胞的细胞毒活性(细胞免疫)、刺激B细胞的抗体产生(体液免疫)、增强单核巨噬细胞的吞噬作用(非特异性免疫),并增高脾脏系数。故本研究给药结束检查时高剂量组大鼠IgG、脾重量和系数升高等免疫功能增强作用可能为受试物有效成分的药理作用的延伸或放大。综合生殖器官的脏器重量、脏器系数及组织病理学检查,性激素水平以及性征发育等结果,复方蒲公英制剂对幼龄大鼠生殖系统发育未见明显毒性影响。
综上所述,幼龄SD大鼠连续4周(PND27 ~ PND54,每天给药2次)重复经口给药毒性实验中,复方蒲公英制剂高剂量(12 g/kg)对幼龄大鼠有一定的毒性影响,主要毒性靶组织为血液红细胞;NOAEL为3.8 g/kg(相当于80 g幼龄大鼠等效剂量的3.2倍,相当于200 g大鼠等效剂量的4.2倍)。
本研究在实验设计上除了常规重复给药毒理指标,又针对幼龄动物发育相关的特定担忧进行了各系统发育相关的终点检测,选择的研究方法和指标可以满足中药幼龄动物毒性评价需求,对中药JAS试验设计进行了初步探索,为进一步完善JAS在儿科中药非临床评价领域的发展提供了科学参考。
