黄芪、苦参、皂角刺抗肝癌作用的比较研究
2020-03-30张乔李静张琦崔闻宇王赫李廷利
张乔,李静,张琦,崔闻宇,王赫,李廷利
(1.哈尔滨商业大学,黑龙江 哈尔滨 150076;2.哈尔滨医科大学附属肿瘤医院,黑龙江 哈尔滨 150040;3.黑龙江中医药大学,黑龙江 哈尔滨 150040)
肝癌为“以气血亏虚为本,邪毒内侵集聚于肝”所致。《难经》中记载:“肝之积名曰肥气,在左胁下,如覆杯。”临床可见患者右胸下有痛感,体型明显消瘦甚至枯瘦[1-3]。现代医学对肝癌的经典治疗方法常伴有临床治疗指征的限定[4-5],以及姑息治疗中带来的毒副作用对机体整体免疫功能的影响[6-7]。中药对肝癌的治疗主要在于扶正益气、疏肝健脾,对于癌症中晚期患者也可改善其身体状态,包括提高其生活质量,延长生命周期[8-10]。近年来采用中医药治疗肝癌备受关注[11],本课题在查阅大量中药抗肝癌文献基础上,以及中医中药临床应用有效性的探索中,拟进行传统中药黄芪、苦参和皂角刺的体内和体外抗肝癌作用比较研究,以期探究中药抗肝癌的药效学作用,为临床中医中药开展个体化治疗和中药研发提供依据。
1 实验材料
1.1 实验动物及细胞
KM小鼠:清洁级,体质量18~20 g,雄性,购自哈尔滨医大二院实验动物中心,批号为20171025。H22肝癌瘤株、HepG2肝癌细胞均由抗肿瘤天然药物教育部工程研究中心(哈尔滨商业大学药学院所辖)提供。
1.2 实验药物
黄芪药材由哈尔滨商业大学药学院中药教研室鉴定为豆科植物膜荚黄芪[Astragalusmembranaceus(Fisch.)Bge.]的干燥根。于三棵树药材市场皖北药房购买。
苦参药材由哈尔滨商业大学药学院中药教研室鉴定为豆科植物苦参(SophoraflavescensAit.)的干燥根。于三棵树药材市场皖北药房购买。
皂角刺药材由哈尔滨商业大学药学院中药教研室鉴定为豆科植物皂荚(GleditsiasinensisLam.)的干燥棘刺。于三棵树药材市场皖北药房购买。
1.3 主要实验试剂
顺铂注射液(批号:180704,江苏豪森药业);RPMI-1640[批号:AD17321268,美国HyClone(上海)代理公司];青链霉素混合液[批号:20180607,美国Solarbio(北京)经销公司];胰蛋白酶(批号:20180122,北京Biotopped公司);小牛血清(批号:18060505,杭州四季青生化试剂公司)
1.4 仪器
KD-TS6A组织脱水机(金华KEDEE生化仪器公司);KD-BM生物组织包埋机(金华KEDEE生化仪器公司);KD-202石蜡切片机(金华KEDEE生化仪器公司);KD-TH生物组织摊烤片机(金华KEDEE生化仪器公司);CX41显微数码成像系统[日本OLYMPUS(深圳)代理厂];Infinite F50酶标仪[瑞士TECAN(上海)贸易公司]。
2 实验方法
首先在小鼠体内构建H22肝癌细胞皮下移植瘤模型并进行评价;其次探究由黄芪、苦参、皂角刺单味药对H22肝癌细胞荷瘤小鼠的药效学作用比较;最后进行体外实验探究上述单味药有效成分的抗肝癌作用比较研究。
2.1 H22肝癌荷瘤小鼠模型建立和观察指标
2.1.1 H22肝癌荷瘤小鼠模型的建立
将H22瘤源置于标准实验室传代培养后,腹腔接种,制作小鼠腹水模型。将KM小鼠50只随机分成5组(模型组1~模型组5),每组10只,抽取腹部饱满瘤源小鼠腹水,接种于KM小鼠右前肢腋下[12-14],每只0.2 mL。
2.1.2 移植瘤体积指数
观察记录荷瘤小鼠皮下移植瘤形成状况,用带表卡尺隔日测量长径与横径,按如下公式计算移植瘤体积并绘制折线图。
V=(ab)2/2
a为长径,b横径
2.1.3 HE染色
切取约0.8 mm3体积肿瘤组织切片,经反复染色、洗涤后,过缸脱水、封片、烘干。病理图象分析系统照相,观察病理改变。
2.2 对H22荷瘤小鼠体内抗肝癌作用的比较实验
2.2.1 药液的制备
分别称取黄芪、苦参和皂角刺,经乙醇回流提取,浓缩得浸膏,加水调整浓度,分别制得黄芪、苦参、皂角刺浓缩液均为0.12 g/mL。
2.2.2 给药方案
建立肝癌细胞小鼠移植模型1 d后,连续给药21 d。3味中药分别按2 400、1 200、600 mg/kg进行高、中、低剂量组灌胃给药;空白组、模型组给予同等剂量生理盐水,每日1次;阳性药组按4 mg/kg腹腔注射顺铂注射液,每5日1次。
2.2.3 对基本体征的影响
逐日观察并记录动物以下基本情况:1)摄食饮水;2)体毛、精神状态;3)排泄物与分泌物;4)行为表现;5)体表、肌肤完整度;6)死亡情况。
2.2.4 对体质量的影响
每5日上午8:30在给药前,进行实验动物称重。
2.2.5 对移植瘤生长的影响
于每日固定时间观察荷瘤小鼠皮下移植瘤形成状况,用带表卡尺隔日测量长径与横径,按公式V=(ab)2/2(a为长径,b横径)计算移植瘤体积并绘制折线图。
2.2.6 对免疫器官重量及免疫器官重量指数的影响
连续给药21 d后停药,隔日取材。处死小鼠后快速剥取胸腺及脾脏,称湿重,记录并计算免疫器官指数。
免疫器官指数=(免疫器官鲜重/动物体质量)×100%
2.2.7 对主要脏器重量及主要脏器重量指数的影响
取材日处死小鼠后快速剥取心、肝、双肾,称湿重,记录并计算脏器指数。
脏器指数=(脏器鲜重/动物体质量)×100%
2.2.8 对瘤重及抑瘤率的影响
取材日处死小鼠后,快速钝性剥离瘤组织,观察,称重,记录并计算抑瘤率。
抑瘤率=(1-治疗组平均瘤重/模型组平均瘤重)×100%
2.3 各单味药有效成分体外抗肝癌作用的比较实验
分别配制黄芪多糖、苦参碱、槲皮素各5个梯度浓度即1 mg/mL、0.5 mg/mL、250 μg/mL、125 μg/mL、62.5 μg/mL作为受试浓度,进行MTT实验。
用酶标仪在490 nm下测吸光度。计算细胞增殖抑制率和IC50。
3 实验结果
3.1 H22肝癌荷瘤小鼠模型评价
3.1.1 移植瘤生长情况
皮下接种H22细胞腹水后第5天,于小鼠接种部位以指腹可触及较硬凸起小块即为皮下移植瘤。隔日测量荷瘤小鼠皮下移植瘤体积结果见表1。隔日测量各组皮下瘤块体积相近,无显著差异,接种分组后第21天肿瘤体积均在1 000 mm3以上。
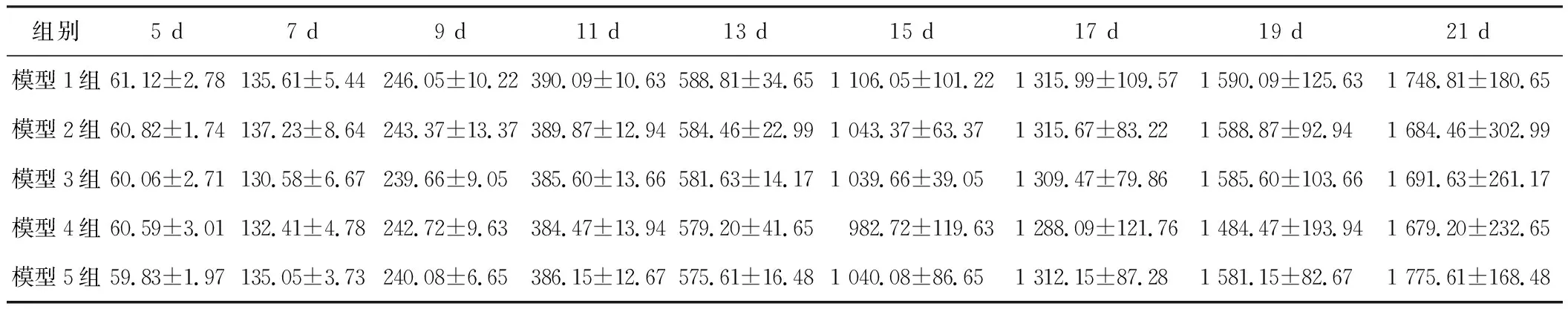
组别5 d7 d9 d11 d13 d15 d17 d19 d21 d模型1组61.12±2.78135.61±5.44246.05±10.22390.09±10.63588.81±34.651 106.05±101.221 315.99±109.571 590.09±125.631 748.81±180.65模型2组60.82±1.74137.23±8.64243.37±13.37389.87±12.94584.46±22.991 043.37±63.371 315.67±83.221 588.87±92.941 684.46±302.99模型3组60.06±2.71130.58±6.67239.66±9.05385.60±13.66581.63±14.171 039.66±39.051 309.47±79.861 585.60±103.661 691.63±261.17模型4组60.59±3.01132.41±4.78242.72±9.63384.47±13.94579.20±41.65982.72±119.631 288.09±121.761 484.47±193.941 679.20±232.65模型5组59.83±1.97135.05±3.73240.08±6.65386.15±12.67575.61±16.481 040.08±86.651 312.15±87.281 581.15±82.671 775.61±168.48
荷瘤小鼠瘤体生长曲线见图1,表明各曲线重合度良好,各组移植瘤生长趋势无明显差异。可见此造膜方法可行,模型复制率高。

图1 荷瘤小鼠皮下移植瘤均数生长曲线
3.1.2 HE染色
皮下移植瘤组织的病理改变见图2。低倍镜下样本均可见部分粉色成片坏死细胞碎片,约占20%~45%;高倍镜下细胞多呈卵圆形;核深染,细胞质较少,核质比例失常。组间细胞形态均无明显差异。可见,此造膜方法可行,模型复制率高。
3.2 对H22荷瘤小鼠体内抗肝癌作用的比较实验结果
3.2.1 对荷瘤小鼠基本体征的影响
阳性药组:小鼠平均摄食差,体型较小,脂肪明显少,皮肤松弛,活动度低,多体形消瘦,精神状态欠佳。
模型组:小鼠摄食状况一般,瘤体积较大,右前肢行动不便,接种部位外表皮多出现伤口。
黄芪组:与阳性药组相比,小鼠摄食状况良好;与模型组相比,伤口愈合状况良好。
苦参和皂角刺组:与模型组相比,小鼠瘤体积较小。
3.2.2 对体质量的影响
实验各组小鼠体质量变化结果见表2。接种分组后第1天,各组体质量较均衡,无显著差异。第11天,与模型组相比,阳性药组体质量降低(P<0.05)。第15天,与空白组相比,模型组体质量减少量超过10%。第15天以后,与阳性药组相比,各组体质量均显著升高(P<0.01);与模型组相比,黄芪高剂量组体质量较大(P<0.05)。
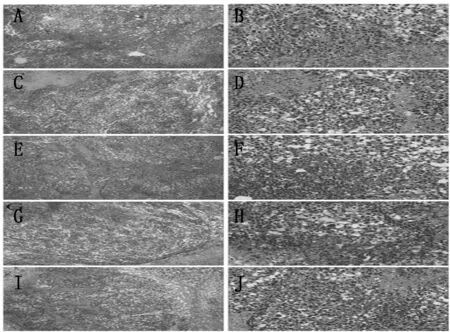
注:A:模型1组(100×);B:模型1组(400×);C:模型2组(100×);D:模型2组(400×);E:模型3组(100×);F:模型3组(400×);G:模型4组(100×);H:模型4组(400×);I:模型5组(100×);J:模型5组(400×)图2 各组移植瘤组织病理情况观察结果(HE)
3.2.3 对移植瘤生长的影响
荷瘤小鼠瘤体体积生长状况见表3。接种后第5天~第21天9次测量结果表明,与模型组相比,阳性药组皮下移植瘤体积显著减小(P<0.01);第17天~第21天,与模型组相比,苦参、皂刺高剂量组皮下移植瘤体积显著减小(P<0.01)。瘤体生长曲线见图3。模型组与其他中药低剂量组瘤体积生长曲线较为陡峭且融合,只有阳性药组的生长曲线与其他组完全分离,且趋势更为平缓。

图3 荷瘤小鼠皮下移植瘤均数生长曲线
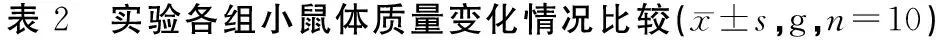

组别1 d5 d11 d15 d21 d空白组18.82±2.1124.36±2.1429.84±1.64**##33.33±1.16**##40.15±2.20**##模型组18.24±1.4823.55±1.3326.89±1.4729.53±2.25##36.06±2.95##阳性药组19.46±1.3223.66±1.1024.09±2.35*26.05±2.34**28.30±2.06**黄芪高剂量组18.72±1.9424.92±2.3227.25±2.00##31.78±1.93*##38.13±1.75*##黄芪中剂量组19.43±1.7324.30±1.9327.42±2.04##30.05±2.10##36.55±2.34##黄芪低剂量组18.90±2.2523.94±2.3425.67±2.1029.40±2.48##36.34±2.86##苦参高剂量组18.88±1.5623.54±1.8827.60±2.32##30.98±2.60##37.01±3.55##苦参中剂量组19.65±1.8224.67±1.8026.31±2.0829.55±3.75##36.48±2.97##苦参低剂量组19.25±2.0623.72±2.4925.99±3.4829.78±2.98##35.98±2.51##皂刺高剂量组19.33±1.6724.73±1.7226.86±1.30##29.97±3.60##36.75±3.93##皂刺中剂量组19.20±1.5624.34±1.3126.60±1.7229.44±2.18##35.64±2.60##皂刺低剂量组19.42±1.7824.25±2.6426.32±2.7228.99±3.19##36.20±3.28##
注:与模型组比较,*P<0.05,**P<0.01;与阳性药组比较,#P<0.05,##P<0.01
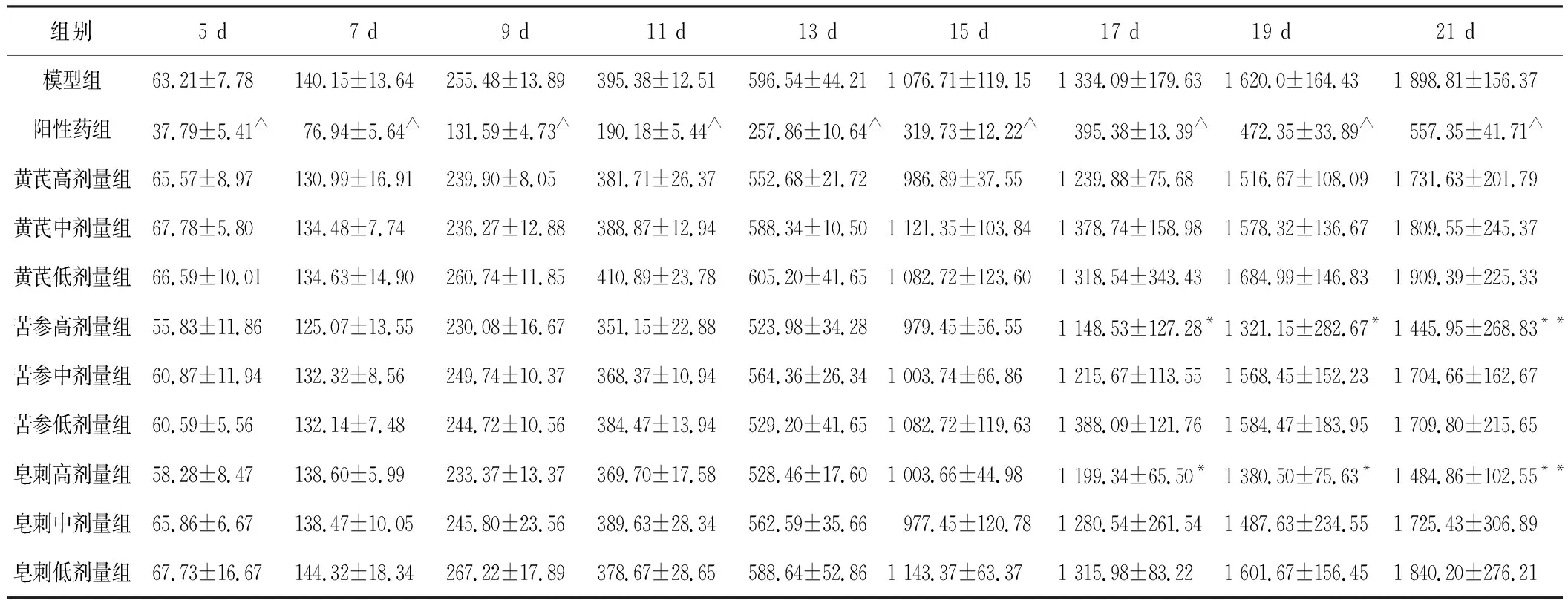
组别5 d7 d9 d11 d13 d15 d17 d19 d21 d模型组63.21±7.78 140.15±13.64 255.48±13.89 395.38±12.51 596.54±44.21 1 076.71±119.15 1 334.09±179.63 1 620.0±164.43 1 898.81±156.37阳性药组37.79±5.41△76.94±5.64△131.59±4.73△190.18±5.44△257.86±10.64△319.73±12.22△395.38±13.39△472.35±33.89△557.35±41.71△黄芪高剂量组65.57±8.97130.99±16.91239.90±8.05381.71±26.37552.68±21.72986.89±37.551 239.88±75.681 516.67±108.091 731.63±201.79黄芪中剂量组67.78±5.80134.48±7.74236.27±12.88388.87±12.94588.34±10.501 121.35±103.841 378.74±158.981 578.32±136.671 809.55±245.37黄芪低剂量组66.59±10.01134.63±14.90260.74±11.85410.89±23.78605.20±41.651 082.72±123.601 318.54±343.431 684.99±146.831 909.39±225.33苦参高剂量组55.83±11.86125.07±13.55230.08±16.67351.15±22.88523.98±34.28979.45±56.551 148.53±127.28*1 321.15±282.67*1 445.95±268.83**苦参中剂量组60.87±11.94132.32±8.56249.74±10.37368.37±10.94564.36±26.341 003.74±66.861 215.67±113.551 568.45±152.231 704.66±162.67苦参低剂量组60.59±5.56132.14±7.48244.72±10.56384.47±13.94529.20±41.651 082.72±119.631 388.09±121.761 584.47±183.951 709.80±215.65皂刺高剂量组58.28±8.47138.60±5.99233.37±13.37369.70±17.58528.46±17.601 003.66±44.981 199.34±65.50*1 380.50±75.63*1 484.86±102.55**皂刺中剂量组65.86±6.67138.47±10.05245.80±23.56389.63±28.34562.59±35.66977.45±120.781 280.54±261.541 487.63±234.551 725.43±306.89皂刺低剂量组67.73±16.67144.32±18.34267.22±17.89378.67±28.65588.64±52.861 143.37±63.371 315.98±83.221 601.67±156.451 840.20±276.21
注:与模型组比较,*P<0.05,△P<0.01
3.2.4 对免疫器官重量及免疫器官指数的影响
免疫器官湿重及免疫器官指数结果见表4。与模型组相比,阳性药组胸腺重量减小(P<0.05),黄芪高剂量组显著增大(P<0.01);与模型组相比,阳性药组胸腺重量显著降低(P<0.01)黄芪高剂量组显著升高(P<0.01)。空白组脾脏重量明显高于其他组,阳性药组显著低于模型组,但考虑自身体质量影响忽略;除空白组与其他组有明显差异外,并无其他组间差异。
3.2.5 主要器官的脏器指数比较
主要器官脏器指数结果见表5。空白组与阳性药组肝脏指数最低且显著低于其他各组(P<0.01);中药给药组中苦参高剂量组、皂刺高剂量组显著低于模型组(P<0.05),心脏、肺脏、双肾的脏器指数组间无统计学差异并且无明显规律。
3.2.6 对瘤重与抑瘤率的影响
瘤体湿重与抑制瘤率结果见表6。阳性药组平均瘤重最低且明显低于其他组;与模型组相比苦参和皂刺高、中剂量组平均瘤重显著降低(P<0.01)。观察抑制率数据结果,阳性药组肿瘤抑制率最高,为89.39%;中药给药组中肿瘤抑制率高于40%的有两组,为苦参高剂量组和皂刺高剂量组,两组肿瘤抑制率分别为51.89%、46.21%;黄芪低剂量组肿瘤抑制率最低,且与苦参、黄芪各剂量组的数据综合比较,黄芪各剂量组肿瘤抑制率低。

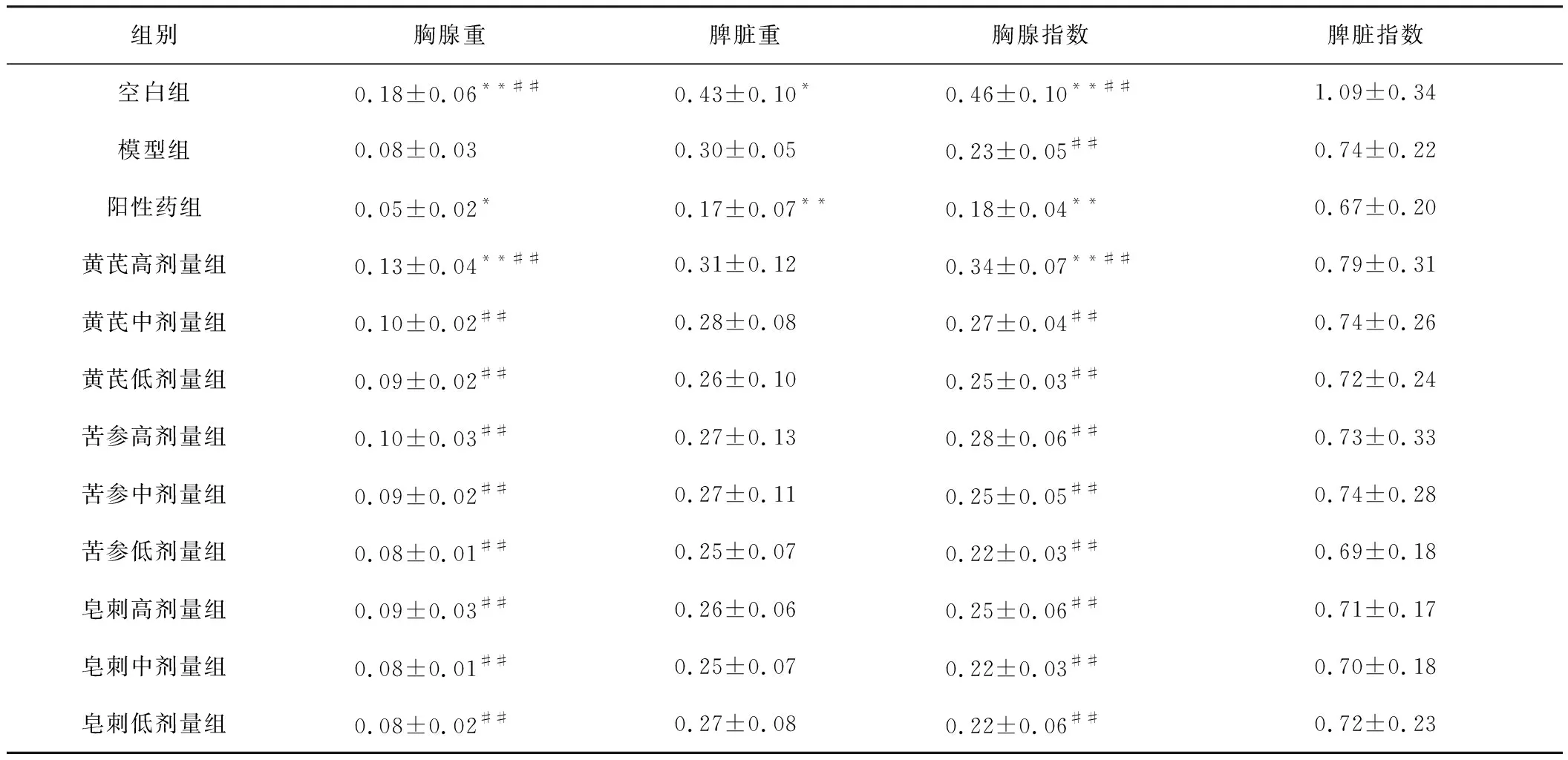
组别胸腺重脾脏重胸腺指数脾脏指数空白组0.18±0.06**##0.43±0.10*0.46±0.10**##1.09±0.34模型组0.08±0.030.30±0.050.23±0.05##0.74±0.22阳性药组0.05±0.02*0.17±0.07**0.18±0.04**0.67±0.20黄芪高剂量组0.13±0.04**##0.31±0.120.34±0.07**##0.79±0.31黄芪中剂量组0.10±0.02##0.28±0.080.27±0.04##0.74±0.26黄芪低剂量组0.09±0.02##0.26±0.100.25±0.03##0.72±0.24苦参高剂量组0.10±0.03##0.27±0.130.28±0.06##0.73±0.33苦参中剂量组0.09±0.02##0.27±0.110.25±0.05##0.74±0.28苦参低剂量组0.08±0.01##0.25±0.070.22±0.03##0.69±0.18皂刺高剂量组0.09±0.03##0.26±0.060.25±0.06##0.71±0.17皂刺中剂量组0.08±0.01##0.25±0.070.22±0.03##0.70±0.18皂刺低剂量组0.08±0.02##0.27±0.080.22±0.06##0.72±0.23
注:与模型组比较,*P<0.05,**P<0.01;与阳性药组比较,#P<0.05,##P<0.01
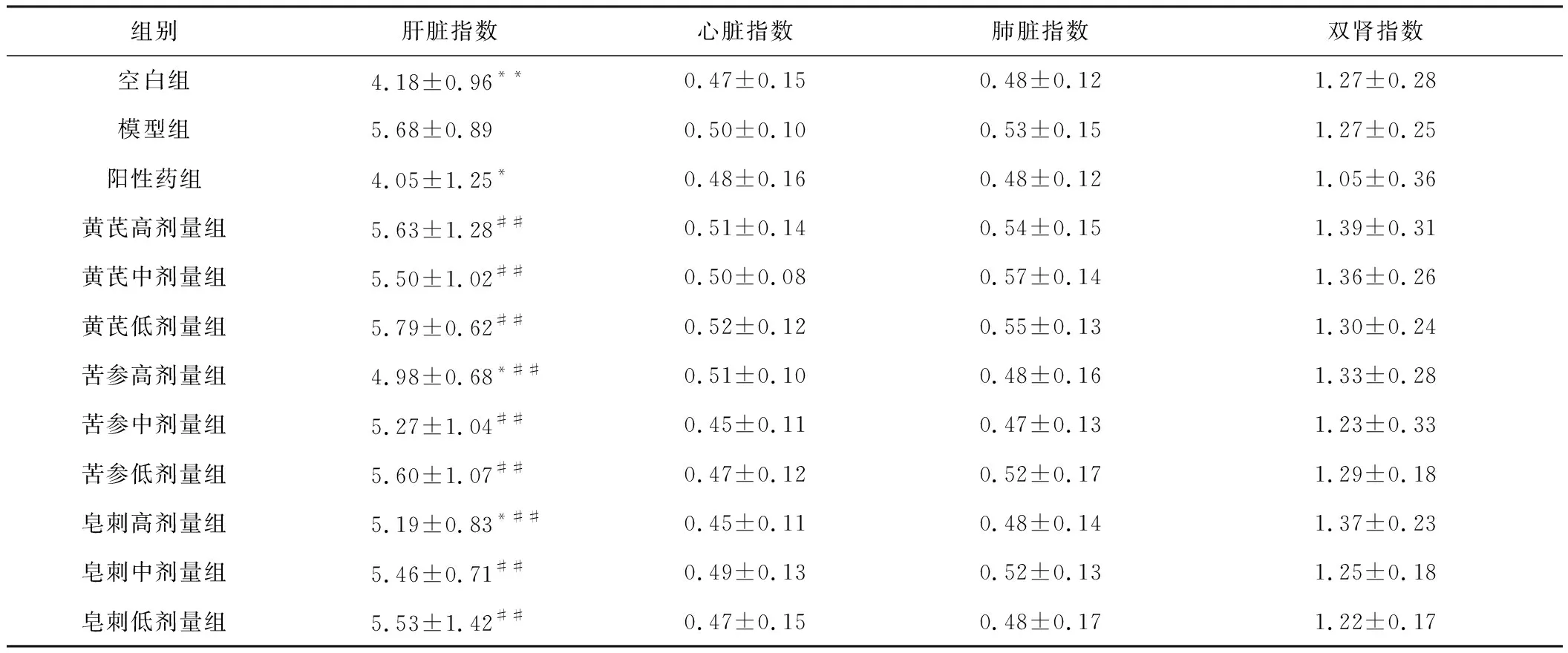
组别肝脏指数心脏指数肺脏指数双肾指数空白组4.18±0.96**0.47±0.150.48±0.121.27±0.28模型组5.68±0.890.50±0.100.53±0.151.27±0.25阳性药组4.05±1.25*0.48±0.160.48±0.121.05±0.36黄芪高剂量组5.63±1.28##0.51±0.140.54±0.151.39±0.31黄芪中剂量组5.50±1.02##0.50±0.080.57±0.141.36±0.26黄芪低剂量组5.79±0.62##0.52±0.120.55±0.131.30±0.24苦参高剂量组4.98±0.68*##0.51±0.100.48±0.161.33±0.28苦参中剂量组5.27±1.04##0.45±0.110.47±0.131.23±0.33苦参低剂量组5.60±1.07##0.47±0.120.52±0.171.29±0.18皂刺高剂量组5.19±0.83*##0.45±0.110.48±0.141.37±0.23皂刺中剂量组5.46±0.71##0.49±0.130.52±0.131.25±0.18皂刺低剂量组5.53±1.42##0.47±0.150.48±0.171.22±0.17
注:与模型组比较,*P<0.05,**P<0.01;与阳性药组比较,#P<0.05,##P<0.01
表6 各组瘤体湿重(g)与抑瘤率情况比较
注:与模型组比较,*P<0.05,**P<0.01
3.3 各单味药有效成分体外抗肝癌作用的比较
3.3.1 黄芪多糖对HepG2细胞增殖的影响
黄芪多糖各浓度组OD值与抑制率结果见表7。与空白组相比,顺铂组、黄芪多糖1 mg/mL、0.5 mg/mL、250 μg/mL组OD值均显著降低(P<0.01)。按照改良寇式法计算黄芪多糖IC50为486.56 μg/mL。

表7 黄芪多糖对HepG2细胞增殖的影响
注:与空白组比较,※P<0.05,※※P<0.01
3.3.2 苦参碱对HepG2细胞增殖的影响
苦参碱各浓度组OD值与抑制率结果见表8。与空白组相比,顺铂组、苦参碱1 000 g/mL、500 mg/mL、250 μg/mL、125 μg/mL组OD值显著降低(P<0.01)。按照改良寇式法计算苦参碱IC50为326.31 μg/mL。

表8 苦参碱对HepG2细胞增殖的影响
注:与空白组比较,※P<0.05,※※P<0.01
3.3.3 槲皮素对HepG2细胞增殖的影响
苦参碱各浓度组OD值与抑制率结果见表9。与空白组相比,顺铂组、槲皮素200 μg/mL、100 μg/mL、50 μg/mL、25 μg/mL、12.25 μg/mL组OD值显著降低(P<0.01)。按照改良寇式法计算槲皮素IC50为69.72 μg/mL。

表9 槲皮素对HepG2细胞增殖的影响
注:与空白组比较,※P<0.05,※※P<0.01
4 讨论
目前西药抗肿瘤药的研制取得突破性进展,具有作用靶点明确、疗效可靠的优势,但同时产生的毒副作用等劣势日渐明显,造成临床肿瘤患者的死因往往不是因为癌症扩散和转移,而是由于化疗药物的毒副作用引起[15]。基于此,中药在治疗肿瘤患者发挥增效减毒的治疗优势突显[16-18]。上述实验结果表明,黄芪、苦参和皂角刺均可提高机体基本指征、免疫器官指数等,由此提示三者均可提高小鼠的免疫功能,其中尤以黄芪在提高荷瘤小鼠的免疫功能方面具有突出表现;另外,三者均具有抗肝癌细胞和抑制肿瘤生长的药理作用,但黄芪抗肝癌的药效学作用不及与苦参、皂角刺显著。
苦参和皂角刺在中医学中都可作为外用药用来治疗外科疮疡肿毒,均具有清热解毒、杀虫、托毒外出的作用。这与现代药理学研究表明二者具有抗肿瘤活性不谋而合。而黄芪作为传统中药的补气药材,具有益气固表、消毒敛疮的功效。因此,在抗肿瘤的同时,现代药理学研究表明黄芪还可以通过改善荷瘤小鼠的胸腺状况,提高小鼠自身免疫力,同时缓解食欲低下,并改善体质量降低的肝癌恶病质情形。因此,黄芪、苦参和皂角刺在具有抗肝癌药效的同时,还具有提高免疫的功能。通过本课题研究表明,黄芪抗肝癌的作用稍逊于苦参和皂角刺,但可明显改善机体综合免疫器官指数和基本生命体征,从而提示其具有提高免疫功能的作用。
