IL-33和ST2在急慢性布鲁氏菌病中的变迁
2020-03-27李智伟蔺志强丁剑冰张峰波
李智伟, 沙 桐, 蔺志强, 周 延, 丁剑冰, 张峰波
(1新疆维吾尔自治区人民医院临床检验中心, 乌鲁木齐 830001; 2新疆医科大学基础医学院免疫学教研室, 乌鲁木齐 830011;3新疆维吾尔自治区第六人民医院检验科, 乌鲁木齐 830013; 4新疆医科大学第一附属医院检验科, 乌鲁木齐 830054)
布鲁氏菌病是由布鲁氏菌感染引起的一种人畜共患病。布鲁氏菌病在世界范围流行,全球每年新发布鲁氏菌病约50万例[1],我国新疆为流行区域,以羊种布鲁氏菌病为主[2]。布鲁氏菌造成多关节脏器损害,且病程长易反复[3],引起这一现象的原因尚不明确。白细胞介素-33(Interleukin-33,IL-33)是新近发现的一种内源性的细胞损伤的报警因子,ST2 (suppression of tumorigenicity 2 receptor)是IL-33的配体,IL-33/ST2通路可以对多种免疫细胞进行调控[4],参与了感染、肿瘤、自身免疫性疾病等多种疾病的发展和转归[5]。本研究通过分析IL-33和ST2在布鲁氏菌病患者中表达变化,以明确IL-33/ST2在布鲁氏菌病中的变化特点,为布鲁氏菌病的慢性化的免疫机制提供新的研究方向。
1 材料与方法
1.1 研究对象收集2018年6月-2019年4月在新疆维吾尔自治区人民医院就诊的布鲁氏菌病急性患者45例为急性病例组,年龄18~57岁,平均年龄(45.77±15.54)岁。慢性患者41例为慢性病例组,年龄18~61岁,平均年龄(48.32±17.13)岁。病例组纳入标准:诊断符合2012 年中国颁布的《布鲁氏菌病诊疗指南(试行)》标准,临床表现有发热、骨关节痛、全身乏力等,虎红平板凝集试验(RBPT)进行初筛阳性,试管凝集试验(SAT)检测血清中抗布鲁氏菌特异性抗体,滴度≥1∶100以上或病程持续1年以上仍有症状者,滴度为1∶50及以上者,血液、骨髓培养鉴定出布鲁氏菌的患者。病程在6个月以内的为急性期,6个月以上为慢性期。选择同期体检的健康人群48例为健康对照组,年龄18~60岁,平均年龄(46.12±13.25)岁。两组人群排除肿瘤、伤寒、风湿热、结核、自身免疫病和其他各种感染等疾病的人员。本研究经过新疆维吾尔自治区人民医院医学伦理学委员会批准(批准号:KY2018011864)并获得所有患者知情同意书。
1.2 仪器和试剂美国BD公司FACS CantoII Plus流式细胞仪,IL-33,ST2,γ干扰素(interferonγ,IFN-γ),IL-4的检测试剂盒均使用北京AimPlex流式高通量多因子检测试剂盒(T1C329432)。
1.3 方法
1.3.1 样本处理 采集急性病例组、慢性病例组患者和健康对照组人群的外周血2管。其中1管用抗凝剂的采血管采集5 mL,3 500 r/min离心20 min,取血清冻入-80℃保存。
1.3.2 AimPlex法检测细胞因子 取出-80℃下储存的样本进行解冻后,将样本在4℃下以12 000 rpm/min离心5 min后吸取上清液,依照说明书步骤进行操作。通过基于AimPlex bead-based的免疫测定法测定IL-33、ST2、IFN-γ、IL-4。使用FACS Canto II流式细胞仪分析所有样本,用BD DIVA软件收集数据,再用FCAP Array v3.0软件分析检测后的数据。

2 结果
2.1 3组人群血清IL-33和ST2细胞因子水平与健康对照组相比,IL-33水平在急性病例组和慢性病例组中均明显升高(P<0.01)(图1A);与健康对照组相比,ST2水平在急性病例组中显著升高(P<0.01),在慢性病例组中则下降(P=0.02)(图1B);与急性病例组相比,慢性病例组血清中IL-33水平升高更明显(P<0.01)(图1A),ST2水平则明显回落(P<0.01)(图1B)。
2.2 3组人群血清IFN-γ和IL-4细胞因子水平IFN-γ水平在急性病例组中显著升高(P<0.01),在慢性病例组中轻度升高(P=0.03)(图2A);IL-4水平在急性病例组中轻度升高(P=0.02),在慢性病例组中则显著升高(P<0.01)(图2B)。与急性病例组相比,慢性病例组血清中IL-4水平均显著升高(P<0.01)(图2A)。IFN-γ水平则明显回落(P<0.01)(图2B)(表1)。

表1 3组人群血清中细胞因子的浓度
注:与健康对照组比较,*P<0.05,**P<0.01; 与急性病例组比较,△P<0.01。
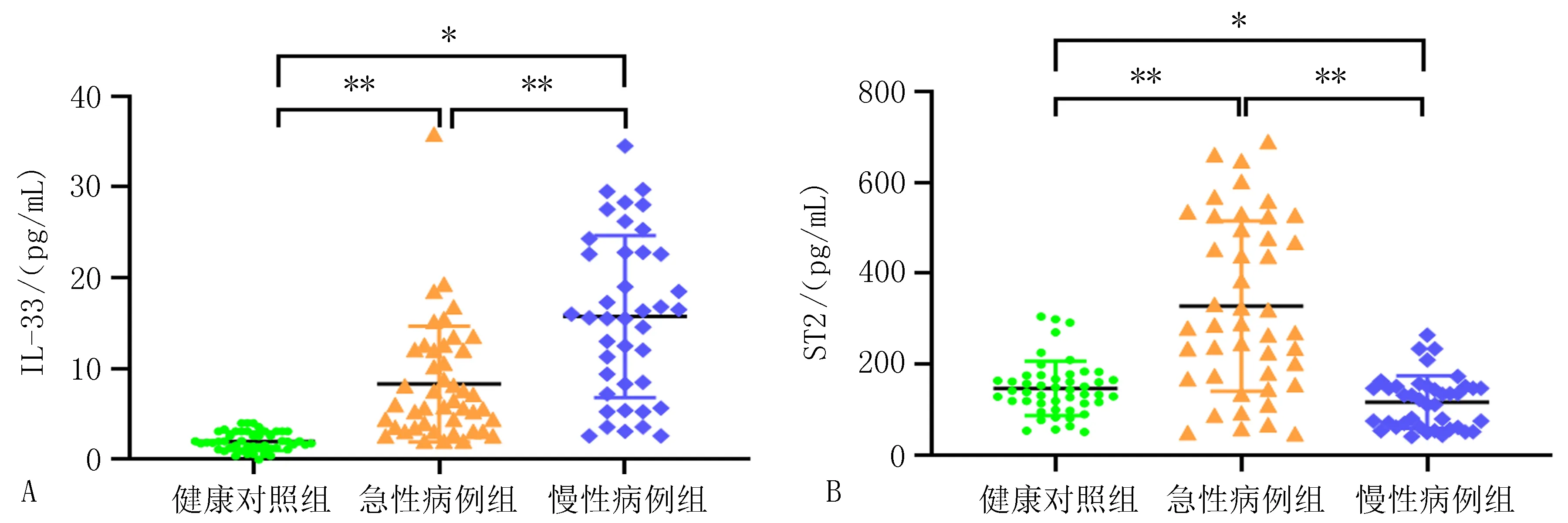
注: A, IL-33血清水平; B, ST2血清水平。
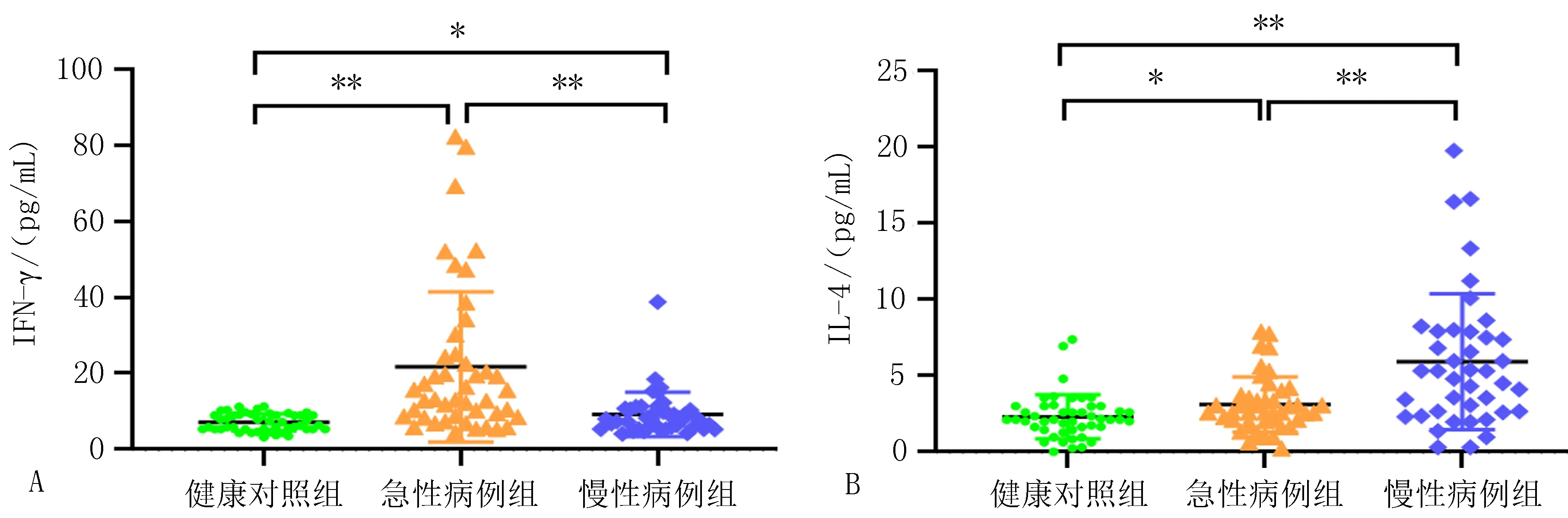
注: A, IFN-γ血清水平; B, IL-4血清水平。
3 讨论
布鲁氏菌感染宿主后,固有免疫无法完全清除这些感染,T细胞在根除布鲁氏菌中发挥了重要的免疫作用[6]。Th1细胞通过释放促炎性细胞因子介导吞噬细胞等免疫细胞杀灭致病菌。 IFN-γ是Th1细胞的主要分泌细胞因子,能够促进Th1的分化发育,并对Th2细胞的分化发育产生抑制作用。IL-4是Th2细胞主要分泌的细胞因子,可以促进Th2分化并抑制Th1分化;因此IFN-γ和IL-4的水平可以反映Th1/Th2细胞的分化情况[7]。IFN-γ在对抗布鲁氏菌的Th1免疫反应中发挥重要作用,其减少会导致细菌无法清除[8],本研究发现IFN-γ在急性病例组显著增高,在慢性病例组中明显回落,而IL-4在慢性病例组中较急性病例组显著上升,说明急性布鲁氏菌病时主要以Th1细胞为主,发挥促炎反应。在慢性布鲁氏菌病时以Th2细胞为主,转为抑炎反应。
已有研究表明,IL-33在感染性疾病中发挥免疫调节作用[9-10]。IL-33属于IL-1家族,在大多数器官中IL-33由上皮细胞和内皮细胞表达,在组织和细胞损伤过程时,IL-33被释放并与受体ST2结合发挥免疫功能,因此被称为炎症预警因子[11]。本研究发现在布鲁氏菌感染者体内IL-33表达增高,与健康对照人群有显著差异,说明IL-33在布鲁氏菌感染时发挥了免疫功能,参与布鲁氏菌的免疫应答。本研究同时也发现IL-33水平在慢性感染时比急性感染时明显增加,说明IL-33参与了布鲁氏菌病的慢性化进程。ST2是作为IL-33的配体,以跨膜受体ST2(ST2L)和可溶性ST2(sST2)2种形式存在。主要表达在Th2、树突状细胞、巨噬细胞等细胞上[12]。本研究发现sST2在布鲁氏菌病中显著上升,特别是在急性布鲁氏菌病中,上升非常明显,而慢性布鲁氏菌病时则显著回落。已有研究表明,sST2水平升高与Th2型免疫为主疾病的活动度及严重程度密切相关[13]。本研究显示ST2下降与布鲁氏菌病中Th1减少有关。
本研究结果表明,慢性期布鲁菌病患者体内IL-33与IL-4血清水比急性布鲁氏菌病患者和健康人群显著升高,并且持续增长。说明IL-33和IL-4在慢性布鲁氏菌病时发挥了重要的免疫功能,可能是由于IL-33导致了布鲁氏菌病从Th1向Th2转变的主要原因。在其他性疾病中也有类似报道,如IL-33在寄生虫[14]和结核感染[15]中均能增强Th2型免疫应答,导致了平衡从Th1向Th2转化。ST2作为IL-33的配体,sST2 可以抑制IL-33诱导的Th2型免疫应答[16];因此本研究认为,IL-33/ST2打破了Th1/Th2细胞之间的失衡,通过抑制Th1细胞,下调IFN-γ的表达水平,同时促进Th2细胞,增加了IL-4 的表达水平,使布鲁氏菌发生了免疫逃逸。
综上所述,布鲁氏菌病从急性期到慢性期的演变过程中存在Th1向Th2倾斜的过程。IL-33/ST2可能参与了Th1/Th2的失衡的改变,这最终导致布鲁氏菌病转为慢性化病程,疾病迁延不愈。抑制IL-33/ST2信号通路介导的Th2型免疫应答,调节Th1/Th2平衡,可能会成为抑制布鲁氏菌病慢性化的关键,但具体如何相互作用尚需进一步研究。
