睡莲酚对H2O2致LO2细胞损伤的保护作用
2020-03-27姑丽巴哈尔艾木都拉张石蕾姚雨含
姑丽巴哈尔·艾木都拉, 张石蕾, 刘 涛, 姚雨含, 赵 军
(新疆医科大学1药学院; 2公共卫生学院, 乌鲁木齐 830011; 3新疆维吾尔自治区药物研究所维吾尔药重点实验室, 乌鲁木齐 830004)
雪白睡莲(NymphaeacandidaPresl)为睡莲科睡莲属草本植物的干燥花蕾[1],研究表明睡莲酚(isostrictiniin)是其主要的化学成分[2],具有降热养肝、清热补心、湿脑安神、消炎止咳、保护肝脏等功效,临床上主要用于热性感冒、干热性脑虚、肝虚、心虚的治疗[3-5]。本课题前期研究发现睡莲酚对半乳糖胺、刀豆蛋白A和四氯化碳诱导的免疫性和化学性肝损伤均有良好的治疗作用[6-9]。本研究采用过氧化氢(H2O2)致LO2细胞氧化应激损伤模型,研究睡莲酚对LO2细胞的保护作用,现报道如下。
1 仪器与试药
1.1 仪器Multiskan GO型自动酶标仪(美国Thermo Fisher Scientific公司);BA210型倒置显微镜(德国Mtic公司);BCD-275TMBC型超低温冰箱(青岛海尔股份有限公司);Heracell型CO2恒温培养箱(美国赛默飞公司);KS12型超净工作台(美国Thermo Scientific公司);HHW420型恒温水浴锅(深圳市博大精科技实业有限公司);AB104-N型电子天平(上海梅特勒托利多公司);KS12型离心机(美国Thermo Scientific公司)。
1.2 试药睡莲酚(新疆维吾尔自治区药物研究所药物合成室自制,纯度>98.0%);RPMI-1640培养基(美国hyclone公司,批号AD16152253);PBS缓冲溶液(美国hyclone公司,批号AD15805314);胎牛血清FBS (以色列BI公司, 批号1805172);胰蛋白酶(美国hyclone公司,批号J170048);双抗溶液(美国hyclone公司,批号J170049);四甲基偶氮唑蓝试剂(MTT,北京酷来搏科技有限公司,批号CM28152114);二甲基亚砜 (DMSO,上海百研生物科技有限公司,批号WXBC5269V);天冬氨酸氨基转移酶检测试剂盒(AST,南京建成生物工程研究所,批号20190110) ;谷氨酸氨基转移酶检测试剂盒(ALT,南京建成生物工程研究所,批号20190109);丙二醛检测试剂盒(MDA,南京建成生物工程研究所,批号20190111);一氧化氮检测试剂盒(NO,南京建成生物工程研究所,批号20190108);氧化物歧化酶检测试剂盒( SOD,南京建成生物工程研究所,批号20190408);总蛋白定量(BCA法)检测试剂盒(南京建成生物工程研究所,批号20190408);过氧化氢(北京益利精细化学品有限公司),试剂均为分析纯。
1.3 LO2细胞人体正常肝 (LO2) 细胞由新疆医科大学中心试验室所提供,经本实验室传代后液氮保存。
2 方法
2.1 LO2细胞的培养和传代将LO2细胞放入25 cm2细胞培养瓶,加入含有10%FBS与1% 双抗的RPMI-1640培养液约4~5 mL,在5%CO2,37℃的恒温培养箱中培养,24 h后换液。观察LO2细胞的生长状态,当细胞生长融合度达到80%时用0.25%胰蛋白酶消化,1∶2传代培养,每2~3 d传代 1次即可。
2.2 LO2细胞计数方法待细胞贴壁生长并其融合度达90%时,弃去培养液,用1 mL消化液(0.25%胰蛋白酶)消化贴壁的细胞,吹打制成均匀的细胞混悬液,吸取10 μL的细胞混悬液注入到盖玻片边缘,使其充满盖玻片和计数板之间。在显微镜下统计4个方格中的细胞数目(只计左侧和上方的压线细胞,不计右侧和下方;如细胞密度太高,可稀释后计数),求平均值。细胞数目计算公式:细胞数目/mL=4个方格细胞总数目/4×104。
2.3 LO2细胞毒性实验(MTT法)方法取对数生长期的LO2细胞,用1 mL消化液(0.25%胰蛋白酶)消化细胞,加完全培养液终止消化,离心,将收集的细胞中加入培养液稀释成密度为5×104个/mL的细胞混悬液,吹匀,按每孔100 μL体积接种到96孔细胞培养板。在37℃,5%CO2的培养箱中培养24 h。弃去上清培养液后每孔给药100 μL,给药组分别加入应浓度为6.25、12.50、25.00、50.00、100.00 μg/mL的睡莲酚溶液100 μL,空白组加入100 μL完全培养液,阴性对照组加入100 μL培养基,每组设6个平行孔。药物作用24、48、72 h后,每孔加入5.0 mg/mL的MTT 10 μL,在原条件下继续培养4 h,吸取上清液,每孔加入DMSO 100 μL,震荡使结晶完全溶解,用酶标仪测定490 nm处OD值(实验重复进行3次)。按如下公式计算细胞存活率:细胞存活率=(实验组OD值-阴性对照组OD值)/(空白组OD值-阴性对照组OD值)×100%。
2.4 H2O2致LO2细胞损伤模型的建立取对数生长期的LO2细胞,加入1 mL消化液消化细胞,调成细胞密度为5×104个/mL的LO2细胞混悬液,每孔200 μL接种于96孔板,培养24 h,待细胞贴壁生长后弃去上清液,对照组每孔分别给予浓度为0.2、0.4、0.6、0.8、1.0和1.2 mmol/L 的H2O2溶液200 μL,空白组给予200 μL完全培养液,每个浓度设6个平行孔,继续在培养箱中培养2、4、8、12、24 h后加入2.5 mg/mL 的20 μL MTT溶液,培养4 h后弃去上清液,避光加入150 μL 的DMSO,用酶标仪测定490 nm处OD值,按“2.3”项下公式计算细胞存活率。
2.5 睡莲酚对H2O2致LO2细胞损伤的保护作用将对数生长期的LO2细胞用1 mL消化液消化,计数后配成5×104个/mL 细胞混悬液,接种于96孔板200 μL/孔,在37℃,5%CO2的培养箱中培养24 h后待细胞贴壁生长,弃去上清液。给药组给予各浓度分别为0、6.5、12.5、25.0 μg/mL的睡莲酚200 μL/孔,阴性对照组加入200 μL培养基(没有细胞),对照组和空白组加入200 μL完全培养液,每组设6个平行孔,置37℃,5%CO2的培养箱中培养24 h后,对照组和给药组加入H2O2溶液200 μL/孔(H2O2的终浓度为0.6 mmol/L),空白组每孔加200 μL完全培养液,培养4 h后每孔加入5 mg/mL的MTT 20 μL,混匀,在原条件下继续孵育4 h后终止培养,弃去上清液,每孔加入150 μL DMSO使结晶充分溶解均匀,用酶标仪测定490 nm处OD值,按“2.3”项下公式计算细胞存活率,每组实验重复3次。
2.6 LO2细胞上清液ALT、AST、MDA、SOD及NO水平测定按同“2.5”项下分组及给药,取LO2细胞,消化、收集、计数后调成5×104个/mL 细胞混悬液,2.0 mL/孔接种于6孔板,培养24 h,待细胞贴壁生长后弃去上清液。给药组给予各浓度分别为0、6.5、12.5、25.0 μg/mL的睡莲酚2.0 mL/孔,对照组和空白组加入2.0 mL完全培养液,于37℃、5%CO2的培养箱中培养24 h,对照组和给药组给予体积为2 mL/孔的H2O2溶液(H2O2的终浓度为0.6 mmol/L),空白组加完全培养液2.0 mL,每组设6个复孔,继续恒温培养4 h后,观察细胞生长状态,参照试剂盒说明书操作检测ALT、 AST、MDA、SOD及NO水平,每组实验重复3次。
2.7 LO2细胞的形态观察取对数生长期的LO2细胞,用1 mL消化液(0.25%胰蛋白酶)消化细胞,加完全培养液终止消化,离心,将收集的细胞中加入培养液稀释成密度为5×104个/mL的细胞混悬液,吹匀,按每孔2 mL体积接种到6孔细胞培养板。在37℃,5%CO2的培养箱中培养24 h。弃去上清培养液后每孔给药2 mL,给药组加入100 μL含相应浓度为6.25、12.50、25.00 μg/mL的睡莲酚,对照组和空白组加入2 mL完全培养液,于37℃、5%CO2的培养箱中培养24 h后,给药组和对照组加入0.6 mmol/L的 H2O2,空白组加完全培养液2.0 mL,继续培养4 h后,在倒置相差显微镜下(×100)观察细胞的生长状况及形态。
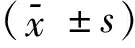
3 结果
3.1 LO2细胞毒性实验结果与空白组比较,给药组对LO2作用24、48、72 h后,在6.25~25.00 μg/mL浓度范围内LO2的细胞活力正常,对细胞的增殖和毒性无明显影响,差异无统计学意义(P>0.05),确定睡莲酚的安全给药浓度范围为6.25~25.00 μg/mL,见表1。

表1 睡莲酚对LO2细胞活力的影响
注: 与空白组比较,*P<0.01。
3.2 H2O2致LO2细胞损伤模型的建立结果与空白组比较,对照组H2O2在0.4~1.2 mmol/L浓度范围内对LO2细胞均造成损伤,差异有统计学差异(P<0.05),本研究选择0.6 mmol/L H2O2处理LO2细胞4 h建立H2O2损伤LO2细胞模型,见表2。

表2 不同浓度H2O2处理LO2不同时间的损伤
注:与空白组比较,*P<0.05。
3.3 睡莲酚对H2O2致LO2细胞损伤的保护作用与空白组比较,对照组LO2细胞存活率降低,差异有统计学意义(P<0.05)。与对照组比较,不同浓度给药组LO2细胞存活率降低,差异有统计学意义(P<0.05),见表3。
3.4 LO2细胞的形态观察与对照组比较,空白组细胞生长状态良好,细胞边界清楚,其大小均匀,细胞间连接紧密,贴壁牢固;对照组细胞数量减少,细胞边界不清,有细胞脱落,甚至损伤破裂;给药组细胞数量和形态均有明显改善,接近于正常组,见图2。

表3 睡莲酚对H2O2致LO2细胞损伤的存活率
注:与空白组比较,#P<0.05; 与对照组比较,*P<0.05。

A: 空白组

B: 对照组

C: 睡莲酚(6.25 μg/mL)

D: 睡莲酚(12.50 μg/mL)

E: 睡莲酚(25.00 μg/mL)
图2 睡莲酚对H2O2致LO2细胞损伤的影响(×100)
3.5 睡莲酚对H2O2损伤LO2细胞上清液AST、ALT水平的影响与空白组比较,对照组LO2细胞上清液中AST和ALT水平升高,差异有统计学意义(P<0.01)。与对照组比较,不同浓度给药组LO2细胞上清液中AST和ALT水平均降低,差异有统计学意义(P<0.01),见表4。
3.6 睡莲酚对H2O2损伤LO2细胞上清液MDA、SOD和NO水平的影响与空白组比较,对照组LO2细胞上清液中MDA和NO水平升高,SOD水平降低,差异有统计学意义(P<0.05)。与对照组比较,不同浓度给药组LO2细胞上清液中MDA和NO水平降低,SOD水平降低,差异有统计学意义(P<0.05),见表5。

表4 睡莲酚对H2O2损伤LO2细胞AST、ALT水平的影响
注:与空白组比较,#P<0.01,;与对照组比较,*P<0.01。

表5 睡莲酚对H2O2损伤LO2细胞MDA、SOD和NO水平的影响
注:与空白组比较,#P<0.05;与对照组比较,*P<0.05。
4 讨论
本研究以LO2肝细胞为研究对象,研究睡莲酚对正常细胞及损伤细胞增殖、形态以及相关生化指标的影响。体外肝毒性通常表现在LO2细胞活力下降[9-10]、细胞形态受损[11]、细胞膜受损通透性等[12]。参照相关研究建立H2O2损伤 LO2细胞模型[11-13],H2O2通过改变LO2细胞的形态和结构,造成肝细胞的氧化性损伤,破坏LO2细胞的细胞膜和细胞结构,提高肝功能相关酶AST、ALT水平及脂质过氧化产物MDA和NO水平,导致SOD抗氧化酶活性降低,进一步加重肝细胞的损伤,和文献报道的数据基本一致[14-19]。睡莲酚作用后,细胞形态和结构得到改善,细胞代偿性增殖减少,细胞中ALT、AST水平降低, SOD活性升高, MDA和NO的含量减少,减轻了氧化产物对LO2细胞的损害。综上所述,睡莲酚通过提高抗氧化功能,降低细胞膜脂质过氧化发挥对肝细胞损伤的保护作用。睡莲酚对体外培养LO2细胞无明显损伤影响,为睡莲酚的后续安全应用提供了理论依据。
