阿帕替尼联合化疗治疗晚期胃癌的临床疗效和安全性分析
2020-03-26冯艳飞
冯艳飞
胃癌属于位于胃黏膜上皮的恶性肿瘤,多由幽门螺杆菌感染、压力大及饮食结构改变等因素导致,在我国癌症患者中死亡率仅次于肺癌,位居第二[1]。晚期胃癌患者临床治疗手段多采用化疗缓解疾病进展,改善临床症状,然而因患者差异,化疗多伴有较为严重毒副作用,导致治疗效果受到影响[2]。鉴于此,笔者选取所在医院收治的晚期胃癌患者96例作为研究对象,探讨分析阿帕替尼联合化疗的临床疗效与安全性,现报告如下。
1 资料与方法
1.1 一般资料 研究纳入96例,均于我院2016年10月至2018年10月收治的晚期胃癌患者。入组标准:经细胞学或组织病理学检查确诊为胃癌,临床分期Ⅳ期;预计生存时间>3个月;对本次研究知情同意。排除靶病灶放疗及具有靶向治疗、化疗禁忌证者。按照治疗方式的不同将96例入组患者分为对照组与研究组,各48例,其中对照组男26例,女22例,年龄32 ~73 岁,平均年龄(61.74±8.38)岁,研究组男27例,女21例,年龄33~72岁,平均年龄(61.94±8.67)岁。两组基本资料比较,差异无统计学意义,P>0.05。
1.2 方法 两组患者均给予顺铂联合卡培他滨联合化疗,其中顺铂(H37021356,齐鲁制药有限公司)采用静脉滴注,剂量80 mg/m2,并口服卡培他滨(H20133365,江苏恒瑞医药股份有限公司)治疗,1次/d,1 000 g/次,21 d为1个治疗周期。研究组患者加用阿帕替尼(H20140103,江苏恒瑞制药)口服治疗,1次/d,500 mg/次。
1.3 观察指标
1.3.1 肿瘤标志物水平 比较两组治疗前后血清癌胚抗原(CEA),糖类抗原72-4 (CA72-4),糖类抗原199(CA199)水平变化情况,对患者治疗前及治疗6个化疗周期后空腹外周静脉血采取4 mL,采用离心机离心获取血清,用免疫酶联法进行测量。
1.3.2 临床疗效 参照实体瘤RECIST标准对两组患者临床疗效进行评估:治疗后病灶全部消失,且维持时间大于4周视为完全缓解(CR);病灶缩小不低于30%,且维持时间大于4周视为部分缓解(PR);病灶增大小于20%或缩小低于30%,维持时间大于4周视为疾病稳定(SD);病灶增大不低于25%或出现新病灶视为疾病进展(PD);疾病缓解(RR)=CR+PR。
1.3.3 不良反应 主要包括出血、骨髓抑制、肾功能损伤、血小板减少、肝功能损伤、胃肠道反应、皮肤黏膜反应、血压升高。
1.3.4 预后情况 比较两组患者无进展生存时间、总生存时间。
1.4 数据处理 采用SPSS 17.0进行统计处理。计量资料用()表示,t检验;计数资料用率表示,χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗前后血清CEA、CA72-4 及CA199 水平比较(表1) 两组治疗前血清CEA、CA72-4及CA199水平比较,差异无统计学意义,P>0.05;治疗后两组血清CEA、CA72-4及CA199水平均降低,P<0.05;且研究组低于对照组,P<0.05。
2.2 两组患者临床疗效比较(表2) 研究组疾病总缓解率(79.17%)均高于对照组(47.92%),差异有统计学意义(χ2=10.117,P<0.05)。
2.3 两组患者不良反应情况比较(表3) 两组各项不良反应发生情况比较,差异无统计学意义,P>0.05。
表1 两组患者治疗前后血清CEA、CA72-4及CA199水平比较() 单位:mg/L
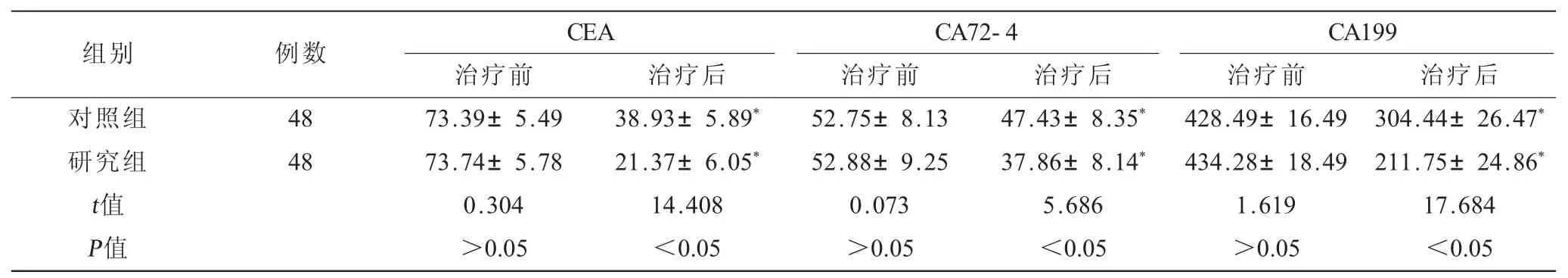
表1 两组患者治疗前后血清CEA、CA72-4及CA199水平比较() 单位:mg/L
注:与同组治疗前比较,*P<0.05。
组别对照组研究组t值P值例数48 48 CEA CA72-4 CA199治疗前 治疗后 治疗前 治疗后 治疗前 治疗后73.39±5.49 38.93±5.89* 52.75±8.13 47.43±8.35* 428.49±16.49 304.44±26.47*73.74±5.78 21.37±6.05* 52.88±9.25 37.86±8.14* 434.28±18.49 211.75±24.86*0.304 14.408 0.073 5.686 1.619 17.684>0.05 <0.05 >0.05 <0.05 >0.05 <0.05
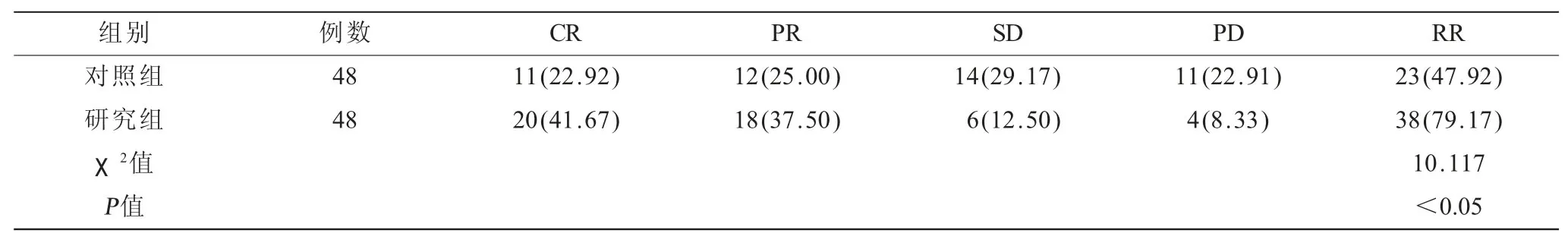
表2 两组患者临床疗效比较[n(%)]

表3 两组患者不良反应情况比较[n(%)]
2.4 两组患者预后情况比较(表4) 研究组无进展生存时间高于对照组(t=4.021,P<0.05),且总生存时间同样高于对照组(t=3.912,P<0.05)。
表4 两组患者预后情况比较() 单位:月

表4 两组患者预后情况比较() 单位:月
组别对照组研究组t值P值例数48 48无进展生存时间 总生存时间3.48±2.18 6.21±2.22 5.29±2.23 8.06±2.41 4.021 3.912<0.05 <0.05
3 讨论
胃癌属于消化系统十分常见的一种恶性肿瘤,具有较为复杂的形成因素,当前已明确与胃黏膜组织存在长期慢性炎症病变具有密切联系[3]。早期、进展期胃癌患者临床症状主要表现为不同程度的疼痛、体质量减轻、乏力等,发展至晚期后上述临床症状会表现的更为严重、频繁,出现营养不良、贫血、消瘦等。临床治疗早期、进展期胃癌多采用手术方式对病灶进行彻底切除,从而缓解临床症状,使患者痛苦得到减轻[4-5]。对于晚期胃癌患者临床多采用化疗延长生命,并在此基础上给予癌细胞靶向药物进行联合治疗,使癌细胞对正常细胞造成的损伤降到最小[6]。
顺铂与卡培他滨联合应用是临床治疗中晚期胃癌的常用化疗方式[7]。然而在临床实际应用过程中,受各种毒副作用影响,化疗方案效果并未得到临床医师及患者认可[8]。本次研究在化疗基础上加用阿帕替尼口服治疗,结果显示,治疗后两组血清CEA、CA72-4及CA199水平均降低,P<0.05;且研究组低于对照组,P<0.05;研究组疾病总缓解率(79.17%)均高于对照组(47.92%),差异有统计学意义(χ2=10.117,P<0.05);两组各项不良反应发生情况比较差异无统计学意义,P>0.05;研究组无进展生存时间高于对照组(t=4.021,P<0.05),且总生存时间同样高于对照组(t=2.733,P<0.05),与以往研究结果一致[9-10]。笔者分析取得上述研究结果原因在于阿帕替尼具有以下作用机制:药物进入机体后能够与血管内皮生长因子中的酪氨酸ATP位点进行竞争性结合,抑制胞内酪氨酸活性的发挥,使血管内皮生长因子结合后的信号传导受到阻断,从而发挥抑制新生肿瘤血管生成的作用。
综上所述,在给予晚期胃癌患者化疗基础上联合应用阿帕替尼能够有效抑制病情发展,提高患者治疗效果的同时延长生存时间,值得深入探讨与推广。
