贵州天冬煮制工艺影响因素的初步研究
2020-03-26刘娅琴王先菊张敏李玮杜洪志吴珊珊
刘娅琴,王先菊,张敏,李玮,杜洪志,吴珊珊
(贵州中医药大学,贵州 贵阳)
0 引言
天冬为百合科植物天冬 Asparagus cochinchinensis (Lour.)Merr.的干燥块根。甘、苦,寒。归肺、肾经。具有养阴润燥,清肺生津的功效[1]。主产于贵州、云南、四川、重庆、湖南等地,以贵州产天冬产量最大、品质最佳[2]。主要有甾体皂苷类、多糖类、氨基酸类等成分[2],现代研究表明,这些成分具有抗衰老、抗癌、抗肿瘤、治疗白血病、镇咳、平喘、增强免疫等作用[3-10]。目前天冬的产地加工方法较混乱。天冬传统的采收初加工,主要包括采收、分档、除杂、水洗、煮制、去皮、干燥等步骤[11]。2015版《中国药典》天冬有蒸或煮两种产地加工方式,但缺乏明确的参数。有研究表明,最佳煮制时间为15min[12];也有研究显示,煮制40min饮片得率较高,水量对天冬浸出物有影响,干燥方式和温度不同,得到的药材质量也有较大差别[13]。前期实验优化了贵州产天冬的蒸制工艺,本研究进一步对贵州产天冬的煮制工艺影响因素进行研究。
1 材料
1.1 仪器
紫外-可见分光光度计(型号GBC cintra 20,澳大利亚照生公司);ME204E型万分之一电子天平(上海梅特勒-托利多);十万分之一电子天平(型号AUW220D,岛津);旋转式蒸发仪(型号RE-52A,上海亚荣);超声清洗机(型号 HS10260D,天津恒奥);电热鼓风干燥箱(型号CS101-1C,重庆四达)。
1.2 试剂与试药
天冬药材采自贵州省安顺市关岭县,经贵阳中医学院生药教研室周汉华老师鉴定为百合科植物天冬Asparagus cochinensis(Lour.) Merr.的根。菝葜皂苷元对照品(批号:110744-200509)、葡萄糖对照品(批号110833-200503)均购自中国药品生物制品检定所;水为蒸馏水;其余所用试剂均为分析纯。
2 方法与结果
2.1 单因素考察
以天冬总皂苷、多糖为指标,考察煮制时间、水量对天冬煮制工艺的影响。
(1)不同煮制时间 取净制的鲜天冬8份,每份200g,分别置锅中煮5、10、15、20、25、30、35、40min后,取出剥皮,用清水漂洗,置60℃烘箱中烘至全干,进行粉碎,过80目筛。测定总皂苷、多糖。
(2)不同煮制水量 取净制的鲜天冬10份,每份200g,分别用2、4、6、8、10、12、14、16、18、20倍水置锅中煮15min,取出剥皮,用清水漂洗,置60℃烘箱中烘至全干,进行粉碎,过80目筛。测定总皂苷、多糖。
2.2 对照品溶液制备
(1)总皂苷 将菝葜皂苷元对照品置于五氧化二磷减压干燥器中,干燥12 h后,精密称取12.70 mg,置于50 mL容量瓶中,加甲醇制成0.2540 mg/mL的溶液。
(2)多糖 精密称取干燥至恒重的无水葡萄糖60mg,置于100 mL容量瓶中,加水溶解稀释,制成0.6 mg/mL的溶液。
2.3 各指标物质提取
(1)总皂苷 精密称取天冬粉末,约0.5g,置于索氏提取器内,加100 mL氯仿脱脂2h,挥干溶剂,再加甲醇100 mL,80℃回流提取至无色,取出药包,回收甲醇,加10mL蒸馏水溶解,用水饱和的正丁醇萃取4次(正丁醇分别为15mL、10mL、10mL、10mL),合并正丁醇部分,用正丁醇饱和的水洗涤,减压回收至干,残渣用甲醇溶液定容至100mL,即可。
(2)多糖 精密称取天冬粉末,约0.25 g,置于烧瓶中,加入80%乙醇100mL,80℃回流提取2h,趁热过滤,挥干溶剂,将滤渣和滤纸同置于烧瓶中,加80mL蒸馏水,提取2次,每次2h,合并滤液,置于200mL容量瓶中,定容,摇匀即可。
2.4 各指标含量测定法
(1)总皂苷 精密吸取各总皂苷元提取液1 mL于显色管中,挥干甲醇,加10 mL高氯酸,摇匀,在65℃水浴加热显色15 min后取出,在冰水浴中冷却15 min,于紫外可见分光光度计波长310 nm处测定吸光度。
(2)多糖 精密吸取各多糖提取溶液2 mL,在冰水浴中缓缓滴加0.2%的蒽酮-硫酸溶液8 mL,摇匀,再置于沸水浴中保持10 min后取出,立即置于冰水浴中保温10 min,于紫外可见分光光度计波长620nm处测定吸光度。
2.5 方法学考察
2.5.1 线性关系考察
(1)总皂苷 精密吸取对照品溶液0.7 mL、0.9 mL、1.1 mL、1.3 mL、1.5 mL、1.7 mL于比色管中,挥干溶剂,加高氯酸10 mL,摇匀,65℃水浴加热显色15min,取出,在冰水浴中冷却15min,摇匀,以同法平行处理的空白溶剂为空白,在310nm处测定吸收值。以菝葜皂苷元质量(mg)为横坐标,吸收值A为纵坐标,绘制标准曲线,回归方程为:y =1.6145x- 0.015,r = 0.9992,菝葜皂苷元在0.1778~ 0.4318 mg/mL范围内具有良好的线性关系。
(2)多糖 精密吸取葡萄糖对照品溶液1.5 mL、1.8 mL、2.1 mL、2.4 mL、3.0 mL、3.3 mL,分别置于25 mL比色管中,定容,分别精密量取2mL于比色管中,在冰水浴中缓缓滴加0.2%蒽酮-硫酸溶液8mL,摇匀,再置沸水浴中保持10分钟后取出,立即置冰水浴中保温10分钟,空白组用2 mL蒸馏水+8 mL0.2%蒽酮-硫酸,于620nm波长处测定吸光度。以吸光度A为纵坐标,浓度C为横坐标,绘制标准曲线,回归方程为:A=5.953C+0.0708,r=0.9991,结果表明葡萄糖对照品在0.036~0.0792mg/mL线性关系良好。
2.5.2 精密度试验
精密吸取供试品溶液,按2.4项下的显色条件进行测定。多糖和总皂苷吸光度的RSD值分别为1.65%,2.35%,结果表明,仪器精密度良好。
2.5.3 重复性试验
精密称取同一处理方法的天冬粉末6份,按2.3项制备供试品溶液,按2.4项下的显色条件对多糖,总皂苷进行测定。多糖和总皂苷吸光度的RSD值分别为2.87%,2.62%,结果表明,测定方法重现性良好。
2.5.4 稳定性试验
精密称取同一处理方法的天冬粉末1份,按2.3项制备供试品溶液,按2.4项下的显色条件,分别在0 h、0.5 h、1.5h、2 h、2.5 h、3 h、3.5 h、4 h、4.5 h和5 h进行吸光度测定,记录试验结果。多糖和总皂苷吸光度的RSD值分别为1.95%,1.38%,结果表明,供试品溶液在5 h内稳定。
2.5.5 加样回收率试验
(1)多糖 精密称取也知含量的天冬样品6份于烧瓶中,每份约0.125 g。精密称取葡萄糖对照品0.15550 g,用蒸馏水定容到25 mL,即得6.22 mg/mL的对照品溶液。分别精密吸取葡萄糖对照品溶液1毫升,加入上述每个烧瓶中,按2.3项方法制备供试溶液,按“2.4”项进行测定。实验平均回收率为100.42%,RSD为2.24%。
(2)总皂苷,精密称取已知含量的天冬样品6份于烧瓶中,每份约0.25g。精密称取菝葜皂苷元对照品0.09170g,用甲醇定容到50毫升,即得1.834mg/mL的对照品溶液。分别精密吸取菝葜皂苷元对照品溶液加8毫升入上述每个烧瓶中,按“2.3”项制备样品溶液,按“2.4”项下条件进行测定,计算回收率。加样回收率试验平均回收率为101.45%,RSD为2.24%。
2.6 不同煮制时间对天冬多糖、总皂苷含量的影响
精密称取2.1项预备好的样品粉末适量,按2.3项制备不同煮制时间的供试品溶液。按2.4项显色条件,测定吸光度,计算各样品中天冬总皂苷、多糖的含量,结果见表1。
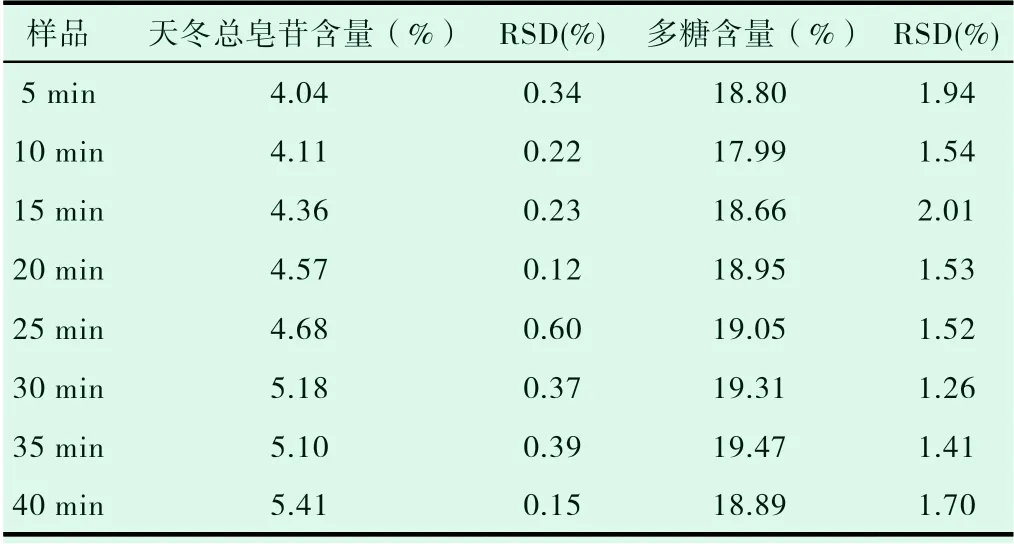
表1 不同煮制时间天冬总皂苷、多糖含量(n=3)
经方差分析,煮制不同时间天冬总皂苷含量的P值为0.002,有显著性差异。煮制不同时间天冬多糖含量的P值为0.06,无显著性差异。煮制40min天冬总皂苷含量最高,煮制35min天冬多糖含量最高。煮制35min和40min天冬总皂苷含量有显著性差异。结果表明,以天冬总皂苷、多糖含量为指标,煮制40min最佳。
2.7 不同煮制水量对天冬多糖、总皂苷含量的影响
精密称取2.1项预备好的样品粉末适量,按2.3项制备不同煮制水量的供试品溶液。按2.4项显色条件,测定吸光度,计算各样品中天冬总皂苷、多糖的含量,结果见表2。
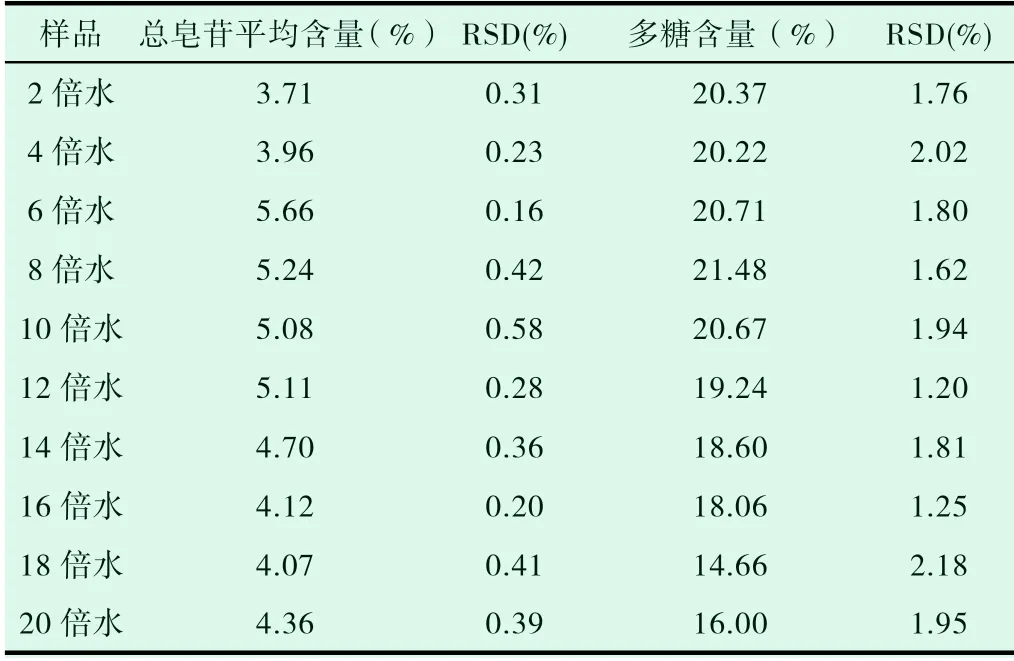
表2 不同煮制水量天冬总皂苷、多糖含量(n=3)
经方差分析,不同煮制水量的天冬总皂苷和多糖含量的P值分别为0.001、0.000,有显著性差异。6倍煮制水量天冬总皂苷含量最高,8倍煮制水量天冬多糖含量最高。6倍和8煮制水量天冬总皂苷含量无显著性差异,但多糖含量有显著性差异。结果表明,以天冬总皂苷、多糖含量为指标,以8倍煮制水量最佳。
3 讨论
实验以天冬多糖、总皂苷含量为指标,考察了不同煮制时间、水量对贵州产天冬的影响,结果表明以8倍水量煮制或煮制40min时,天冬多糖和总皂苷含量均较高。同时以天冬多糖为指标进行实验,实验结果显示:直接干燥生品与未剥皮煮、未剥皮蒸比较有显著性差异,经蒸、煮后,天冬多糖含量较直接干燥生品高;未剥皮煮和剥皮煮有显著性差异,未剥皮煮含量较剥皮煮高,但未对总皂苷作研究;前期实验证明温度为80℃下烘干得到的天冬多糖的含量最高。
研究结果表明不同煮制时间、水量、是否剥皮、干燥温度等因素对贵州产天冬的多糖和总皂苷含量均有影响。由于试验条件和试验时间的限制,不同煮制时间、煮制水量、是否剥皮、干燥方式及温度等对贵州天冬的浸出物、其它有效成分及药效等的影响,还有待进一步研究。下一步将用正交和综合评分法优选贵州产天冬的煮制工艺。
注:方法学考察和指标成分提取,测定来源于前期实验。
