南极磷虾酶解产物中一种含氟多肽的研究
2020-03-26刘云姣张海燕樊成奇刘淑晗沈晓盛
刘云姣,张海燕,孔 聪,樊成奇,刘淑晗,汪 宇,沈晓盛
(1.中国水产科学研究院东海水产研究所,上海 200090;2.上海海洋大学食品学院,上海 201306)
南极磷虾是地球上最大的生物类群之一,由于其储藏量巨大,并且营养价值很高,含有人体所必需的全部氨基酸,被人们称为未来的食品蛋白资源仓库[1]。然而南极磷虾具有富集氟的特性,其氟含量非常高,冷冻南极磷虾肌肉中氟含量为325~570μg·g-1[2-3]。根据中国卫生部发布的人口总氟摄入量健康标准,成人每日氟摄入量应不超过3 mg[4],这说明南极磷虾不能直接作为食品被人类利用。然而,有研究发现以南极磷虾为主要食物的南极企鹅骨骼氟含量达6448~7187μg·g-1,远远超过正常鸟类骨骼的氟含量,但它们并没有出现氟中毒现象[5-6],说明氟的毒性与其赋存形态有关。随着对氟形态研究的深入,人们逐渐认识到生物体对不同形态氟的吸收和生物利用度存在差异[7-8]。这意味着仅分析南极磷虾中氟的总含量不足以解释其毒性大小,也无法科学的评估南极磷虾的安全性,因此研究南极磷虾肌肉中氟的赋存形态是非常有必要的。
有关南极磷虾氟的分析方面,主要集中在对氟的总量分析上,对氟的形态分析相对较少,仅有的几篇关于氟形态的报道也是基于土壤和岩石中氟的形态分析方法[9],并且通过这种分析方法获得的几种氟形态存在交叉折叠,学术上尚存在争议[10]。目前人们对南极磷虾中氟形成机制尚不清楚,关于氟与蛋白存在某种形态结合以及以何种方式结合,还处于假设推断状态。SANDS等[11]基于氟的快速溶解特性,推断氟可能与水溶性蛋白结合在一起,ZHANG等[12]通过对南极磷虾氟的迁移规律研究,推断氟可能与某种结构蛋白有关。笔者在前期的研究中也发现,南极磷虾蛋白中存在结合态的氟,为了进一步获得南极磷虾蛋白中氟的结合形态,本研究在酶解获得蛋白肽的基础上,参考相关蛋白分离文献[13-16],采用超滤、凝胶过滤层析,C18高效液相色谱技术分离纯化得到纯化的磷虾肽,然后通过离子色谱法对其进行氟含量的测定,同时利用LC-MS/MS对其氨基酸序列进行分析,将分析结果通过NCBINucleotide-Euphausiacea蛋白质数据库匹配得到相应的蛋白质,并对该蛋白结构与特性进行深入分析,以期可为南极磷虾中含氟蛋白的制备提供新的技术方法,同时也为南极磷虾中含氟蛋白的安全评价提供技术支撑。
1 材料与方法
1.1 实验材料
1.1.1 南极磷虾来源
实验用南极磷虾于2017年4月采自南极海域,采捕上岸后,放入-20℃的冰箱冷冻保存,运回实验室后,于-80℃下保存备用。
1.1.2 实验试剂
胰蛋白酶(≥50 000 U·g-1),购于国药集团化学试剂有限公司;盐酸、氢氧化钠等其他试剂均购于国药集团化学试剂有限公司,分析纯;实验用水由超纯水仪(美国Millipore公司)制备。
1.2 主要仪器设备
850 Professional IC离子色谱仪(瑞士万通公司);Metrosep A Supp 5-250/4.0色谱柱;高效液相色谱仪(Agilent 1260);YMC-Pack ODS-AQ色谱柱(150 mm×4.6 mml.AQ12S05-1546WT);LC-MS/MS(EASY-nLC1000,LTQ Orbitrap Velos Pro系统,Thermo Finnigan公司);8400型Amicon®搅拌式超滤杯(美国默克公司);Sephadex G-25葡聚糖凝胶柱填料(Pharmacia公司);玻璃层析柱Φ3×150 cm(上海华美实验仪器厂);16RXⅡ高速冷冻离心机(日本HITACHI CF公司);Milli-Q超纯水机(美国 Millipore公司);旋转蒸发仪RE-52A(上海亚荣生化仪器厂)
1.3 实验方法
1.3.1 南极磷虾肽的制备
1.3.1.1 粗肽的制备
参考南极磷虾酶解多肽的制备方法[17],准确称取100 g南极磷虾鲜虾肉,加入超纯水500 mL,按1%酶底浓度加入胰蛋白酶,用0.1 mol·L-1NaOH调节pH为8.0后,于45℃水浴震荡8 h。酶解结束后,取出酶解液于100℃沸水中加热10 min,终止酶解反应。将灭活的酶解液冷却至室温,离心(5℃,5 000 r·min-1)20 min,收集上清液,待用。
1.3.1.2 磷虾肽粉的制备
参考酶解制备多肽的分子量大小[17],选取30 kD超滤膜超截留未酶解完全的大分子蛋白和其他大分子物质,控制蠕动泵转速,调节超滤膜板进口压力为15~20 Psi,出口压力为5 Psi,压力差控制在15 Psi以上,收集滤出液,在-80℃冷冻后,于冷冻干燥机冷冻干燥制得南极磷虾酶解多肽粉。
1.3.2 南极磷虾酶解多肽得率
南极磷虾酶解多肽得率(%)=酶解磷虾肽粉质量(g)/鲜虾肉粉质量(g)×100
1.3.3 南极磷虾多肽的分离纯化
采用凝胶过滤层析与高效液相色谱对南极磷虾多肽分离纯化[13-16]。
凝胶过滤层析 取Sephadex G-25葡聚糖凝胶装柱,用超纯水平衡层析柱2 h,一次加入酶解蛋白肽浓度 0.1 g·mL-1、8~10 mL,以 2 mL·min-1匀速洗脱,收集洗脱液(5 mL·管-1)。
高效液相色谱分离 将凝胶柱洗脱液依次通过HPLC分析得到分离图谱,根据色谱图进行分离纯化,并将纯化得到的相同多肽的层析液合并,通过旋转蒸发仪浓缩至5 mL左右,于冷冻干燥机冷冻干燥24 h,得到不同分子量的各组分磷虾肽粉。其分析条件如下:检测波长:220 nm;柱温:30℃;0.1 mL·min-1;进样量 80μL;流动相A:乙腈;流动相B:超纯水;梯度洗脱条件如下:(A/B)0~2 min,5%(等量梯度);2~12 min,5% ~60%(线性梯度);12~15 min,60% ~80%(线性梯度);15~17 min,80%(等量梯度);17~17.5 min,80% ~5%(线性梯度);17.5~20 min,5%(等量梯度)。
1.3.4 氟的测定
采用离子色谱法进行氟含量测定[18]:取样品0.1 g,加入 2 mL体积比为 11∶1(水∶盐酸)的盐酸水溶液,密闭酸解1 h,用超纯水定容至20 mL,依次过0.22μm水相针式滤膜,IC-Ag+柱,ICNa+柱,上机。色谱条件:流动相:3.2 mmol·L-1Na2CO3-1.0 mmol·L-1NaHCO3;流速:0.700 mL·min-1;柱温25℃;进样量:20μL。
1.3.5 氨基酸分析及蛋白鉴定
由上海鹿鸣生物科技有限公司提供技术支持,采用LC-MS/MS对多肽进行氨基酸分析及蛋白鉴定[13-16],磷虾肽经毛细管高效液相色谱分离后用 LTQ Orbitrap Velos Pro质谱仪(Thermo Finnigan)进行质谱分析。分析时长:90 min,检测方式:正离子,喷雾电压:1.8 kV,离子传输毛细管温度:250℃,使用前经标准校正液校正,母离子扫描范围:350~1 800 m/z,质谱扫描方式为信息依赖的采集工作模式下(information dependent analysis,IDA),每次全扫描(full scan)后采集最强的10个碎片图谱(MS2 scan),碎裂方式:碰撞诱导解离(collision-induced dissociation,CID),正态化能量35%,q值0.25,活化时间:30 ms,动态排除时间:30 s,MS1在 M/Z 400时分辨率为60 000,MS2在离子阱中为单位质量分辨。一级质谱采用profile模式采集,二级质谱采用centroid方式采集以降低数据文件大小。
1.3.6 统计方法
采用 SPSS 10.0软件(SPSS Inc.,Chicago,IL,USA)和 Mascot 2.3软件(Matrix Science)进行数据处理,数据库为 NCBI-Nucleotide-Euphausiacea数据库,酶选择为无,最大缺失切割位点为2;固定改性为:氨基甲酰基甲基(C);变量修饰为:乙酰基(蛋白质 N-末端),脱酰胺基(NQ),二氧化(W),氧化(M);对于成功鉴定,MS耐受性为±10 ppm,MS/MS耐受性为 ±0.6 Da,蛋白质得分CI%大于95%。所有实验数据均为3次平行测定值的平均值±标准差(Means±SD),分别利用 Excel 97-2003、Chemist draw 16.0进行数据分析与作图。
2 结果与分析
2.1 南极磷虾酶解多肽粗提物得率及其氟含量分析
在前期优化酶解工艺的基础上,采用胰蛋白酶对南极磷虾肌肉进行酶解。南极磷虾酶解液离心后取上清液,用30 kD超滤膜截留未酶解完全的大分子蛋白和其他大分子物质,离心,冻干,得到酶解粗提物,经计算100.00 g南极磷虾肌肉酶解后的多肽质量为(19.98±0.41)g,即南极磷虾多肽粗提物得率约为20%。
采用离子色谱法测定南极磷虾肌肉酶解前后的虾肉粉与多肽粉的氟含量分别为(864.52±0.96)μg·g-1和(731.73±1.01)μg·g-1。以多肽得率20%,并考虑到残渣中氟的影响,结合酶解前后虾肉粉与多肽粉总氟比计算,以鲜虾肉计,粗略换算氟含量约为172.90μg·g-1,结果略高于朱兰兰等[19]和 PARK等[20]测得的氟含量(60~120μg·g-1),低于郭帆等[9]和 ZHANG等[12]测得的氟含量(265~325μg·g-1)。这可能与不同实验室所使用的南极磷虾原料的储存条件不同有关,研究表明,存储条件对南极磷虾体内氟迁移的形态与含量有明显的影响[21],随着存储时间的延长或存储温度的升高,虾壳中的氟更容易转变成易被肌肉吸收的离子交换态氟或水溶态氟,因此对南极磷虾捕获后低温快速脱壳技术的研究也是降低肌肉氟含量的重要环节,由于各个实验室选用的南极磷虾原料的采购厂家、存储条件、捕捞海域不一样,导致各个实验室测得的结果存在差异。
2.2 南极磷虾酶解多肽的高效液相色谱分析
图1是南极磷虾肌肉酶解后多肽的高效液相色谱分析图谱,可以看出南极磷虾多肽主要有6个比较明显的峰(分别命名为 F1、F2、F3、F4、F5、F6),且各个峰型良好,说明该色谱条件能较好地将南极磷虾酶解后的多肽有效分开,色谱条件适合南极磷虾酶解多肽的分析。

图1 南极磷虾肌肉酶解后的多肽高效液相色谱图Fig.1 HPLC chromatogram of peptides after enzymatic hydrolysis of Antarctic krill
2.3 南极磷虾酶解多肽的纯化及各组分多肽氟含量分布
为了得到各组分多肽(F1、F2、F3、F4、F5、F6)氟的含量分布,用Sephadex G-25葡聚糖凝胶层析柱分离纯化后,进行分段收集,并通过HPLC C18反相柱精制,纯化后得到6个组分多肽。收集6个组分多肽,并对其进行氟含量分析,表1是离子色谱对多肽(F1、F2、F3、F4、F5、F6)中氟含量的分析结果,从表1中可以看出,6个主要的肽段均有氟分布,但主要集中在多肽F6上,说明多肽F6的结构更容易与氟结合。

表1 不同多肽中氟含量分布Tab.1 Distribution of fluorine content in different peptides
2.4 南极磷虾酶解后的多肽F6的纯度鉴定
为了确保多肽F6的高纯度样品,以免杂质的存在对后续的组成、结构和序列分析造成干扰或影响。将经过Sephadex G-25葡聚糖凝胶柱初步分离后的多肽层析液,通过HPLC进一步分离,获得纯化样品。图2是多肽F6的纯度鉴定结果,可以看出多肽F6的高效液相色谱峰为单一的对称峰,说明样品为单一组成,纯度较高。

图2 多肽F6的高效液相色谱图Fig.2 HPLC chromatogram of peptide F6
2.5 南极磷虾酶解后的多肽F6的MS/MS分析
图3 是多肽F6的 LC-MS/MS质谱图,分析多肽F6分子量以鉴定其氨基酸的序列,将得到的片段氨基酸序列通过NCBI-Nucleotide-Euphausiacea蛋白质数据库检索,按匹配值得分高于100分可筛选鉴定得到4种蛋白质 [Clock,Tropomyosin,ATP synthase subunit 6(mitochondrion),Arginine kinase],标识符分别为:gi|1047815850|gb|ANW48378.1|,gi|156712752|dbj|BAF76430.1|,gi|588481755|gb|AHK23746.1|,说明多肽F6与这4种蛋白相关。Clock蛋白作为调节生物节律关键因子,可通过磷酸化修饰形成羟基磷酸盐[22-23],从而增强稳定性,在维持生命体节律方面具有重要作用,Tropomyosin是一种细肌丝相关蛋白,它具有二聚化α-螺旋结构,对肌肉收缩有重要的调节作用,ATPsynthase subunit 6(mitochondrion)广泛存在于线粒体内膜,参与光合磷酸化和氧化磷酸化,在跨膜质子动力势的推动下合成ATP,为生命体提供能量,Arginine kinase是磷酸原胍基化合物激酶的一种,主要存在于无脊椎动物体内,用于迅速补偿ATP浓度剧烈变化以及细胞内不同部位的能量传递,在细胞能量代谢中起重要作用。
有研究表明,氟与羟基磷酸盐之间的离子交换吸附是南极磷虾富集氟的主要方式,这种结合方式是氟在机体内最稳定的存在方式[34]。由于鉴定出的4种蛋白中,只有Clock蛋白可以通过磷酸化修饰形成羟基磷酸盐,Tropomyosin、ATP synthase subunit 6 (mitochondrion)、 Arginine kinase这3种蛋白在肌肉收缩、能量传递中有重要作用。可以推测南极磷虾蛋白与氟的结合可能与Clock蛋白的磷酸化有关,在ATP synthase subunit 6、Arginine kinase等酶的参与下,Clock蛋白可通过磷酸化修饰形成羟基磷酸盐,氟通过羟基磷酸盐与氨基酸侧链之间的离子交换吸附在南极磷虾中积累,以维持南极磷虾肌肉内稳定的氟含量。表2是Clock蛋白的氨基酸序列,蓝色标示为多肽F6与Clock蛋白的匹配序列。
3 讨论
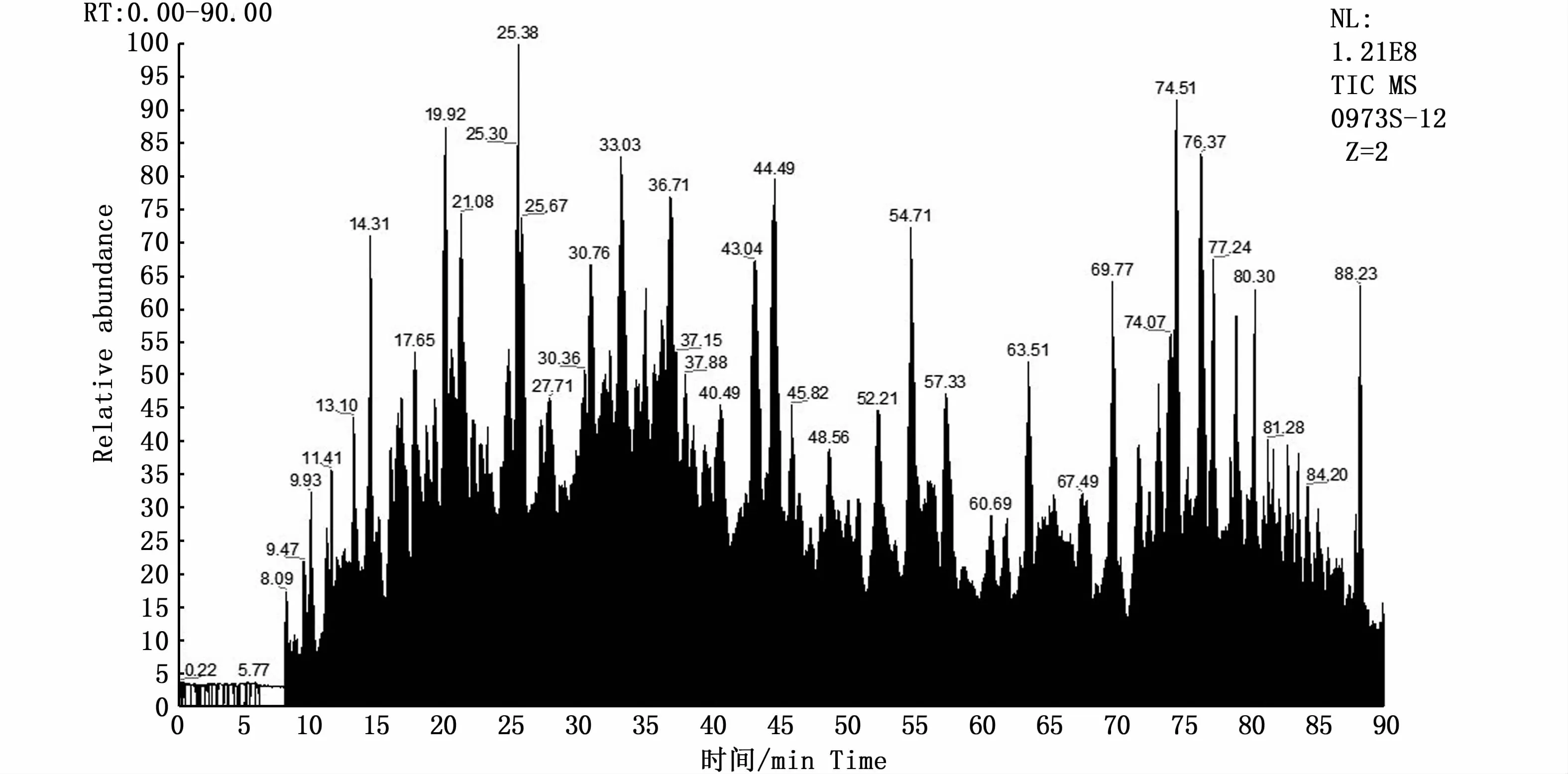
图3 多肽F6的MS/MS质谱图Fig.3 MS/MSspectrum of Antarctic krill peptide F6

表2 Clock蛋白的氨基酸序列Tab.2 Amino acid sequence of Clock protein
南极磷虾作为人类最大的动物性蛋白资源库,其蛋白的利用对产业发展至关重要。然而,研究显示,南极磷虾肌肉中的氟含量在225~570 μg·g-1之间[2-3],并以游离态和结合态的方式赋存于肌肉中。游离态氟可根据氟离子的水溶性特征进行快速去除,但结合态氟很难通过简单的工艺将氟除去,容易导致南极磷虾蛋白粉或南极磷虾多肽粉中氟含量超标,影响其开发利用。参考相关文献[24-26],酶解法反应条件温和,整个反应无高温高压强酸强碱过程,对蛋白结构的破坏程度小。此外,生物酶具有专一性,一种酶只能催化一种反应,作用于特定的肽键,如胰蛋白酶只能断裂赖氨酸、精氨酸、组氨酸这3种碱性氨基酸所形成的肽键。故本文通过酶解的方式分离南极磷虾肌肉中的含氟多肽,目的是不破坏结合态氟的赋存形式,有利于后期结合态氟的安全性以及理化特性的研究。本实验结果也表明,采用酶解获得南极磷虾多肽粗提物是可行的,多肽通过凝胶色谱层析和反相液相色谱再次分离纯化后,可成功制备出纯度较高的多肽,多肽F6就是本文分离纯度较高的多肽。
为了进一步获得多肽F6与氟结合的可能肽链,通过质谱技术结合氨基酸序列对多肽F6进行分析,发现氟与Clock蛋白结合的可能性最大。鉴定出的Clock蛋白是由Clock基因编码的蛋白质,可调节生物节律。有研究证明,磷酸化修饰后的Clock蛋白在生物钟的正负反馈回路中起关键性作用,Clock蛋白可以通过磷酸化修饰增强其在机体内的稳定性、相互作用和活性[22-23]。Clock蛋白磷酸化是通过将ATP中的磷酸基团磷酸化到蛋白质的特定位点来实现的,该特定位点一般是指含有羟基的氨基酸即丝氨酸(Ser)、苏氨酸(Thr)和酪氨酸(Lyr),它们的磷酸化氨基酸结构如图4所示,这3种氨基酸具有游离羟基且不带电荷,当磷酸化时,蛋白质带负电荷[27]。钙离子广泛存在于细胞中,可与钙调素结合引起钙调素构象的变化,从而在特定的反应中结合特定蛋白质,作为蛋白质的重要辅助因子,参与磷酸化等翻译后修饰[28],另外细胞内Ca2+作为调节多种细胞活动的第二重要信使,还参与某些类型神经细胞中动作电位的传播[29]。由于钙离子带有正电荷,它们可以通过离子传输通道与带负电荷的磷酸化Clock蛋白结合形成羟基磷酸钙(HAP),HAP作为一种可以吸附在蛋白上的生物矿物质,可能在促进化学进化上起着累积生物分子的作用[30]。因为南极磷虾肌肉中有很多游离的氟离子,HAP具有很强的离子交换能力,所以OH-很容易被F-所取代,而形成吸附能力更强、更加稳定的氟磷灰石(FHAP)[31-33]。南极磷虾肌肉中氟的结合形态可能与Clock蛋白磷酸化有关,通过磷酸化来形成稳定的生物矿物质(FHAP),来维持机体的正常代谢与生命活动。目前认为南极磷虾通过离子交换吸附,即通过Ca5(PO4)3OH+F-=Ca5(PO4)3F+OH-实现氟离子的聚集便是基于这个原理[34]。
4 小结
1)本研究采用胰蛋白酶酶解法制备南极磷虾多肽的得率约为20%。
2)将南极磷虾酶解多肽经过超滤、Sephadex G-25葡聚糖凝胶柱层析、高效液相色谱技术分离纯化得到的6个组分多肽(分别命名为F1、F2、F3、F4、F5、F6),并且氟主要集合在多肽 F6,多肽F6氟含量最高,可达(266.11±0.40)μg·g-1。
3)通过LC-MS/MS分析得到多肽F6的氨基酸序列,并将片段氨基酸序列通过 NCBINucleotide-Euphausiacea蛋白质数据库检索,按匹配值得分高于100分可筛选鉴定得到4种蛋白质[Clock, tropomyosin, ATP synthase subunit 6(mitochondrion),Arginine kinase]。通过对 4种蛋白的研究,同时结合多肽的理化特性分析,在现有的实验数据下,说明南极磷虾蛋白结合氟可能与Clock蛋白的磷酸化有关,氟以FHAP生物矿物盐的形式与南极磷虾蛋白结合,以维持南极磷虾肌肉内稳定的氟含量,但具体结合结构、结合机理仍需要进一步研究与验证。
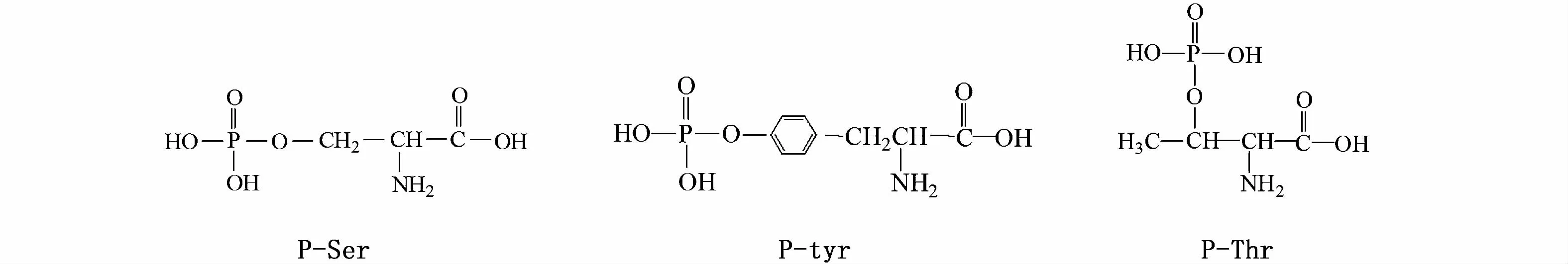
图4 磷酸化氨基酸结构式Fig.4 Phosphorylated amino acid structure
