MTHFR基因多态性与急性淋巴细胞白血病患儿甲氨蝶呤化疗后不良反应及临床预后的关系
2020-03-25郑明霞赵文理
郑明霞,赵文理
1苏州大学医学部儿科临床医学院,江苏苏州 215000;2苏州大学附属儿童医院;3上海交通大学附属第六人民医院南院
急性淋巴细胞性白血病(ALL)是小儿最常见的恶性肿瘤之一,占儿童白血病的70%~80%,是导致儿童死亡的主要原因[1]之一。近年来,随着ALL分子生物学的分型、新的化疗药物及化疗方案的不断发展,小儿ALL的救治成功率提高,完全缓解率达90%以上[2]。大剂量甲氨蝶呤(MTX)化疗是目前治疗小儿ALL的主要方案之一,但在临床用药过程中发现,不同患儿用药后临床反应及不良反应差异较大[3],因而有必要针对药物代谢相关的基因,对患儿用药后不良反应进行预测,以指导临床合理用药。亚甲基四氢叶酸还原酶(MTHFR)是叶酸和蛋氨酸代谢过程中的限速酶,而叶酸参与DNA的合成、修复及甲基化等过程。MTHFR基因C677T和A1298C位点突变导致酶活性下降,细胞内叶酸水平和S-腺苷甲硫氨酸(SAM)降低,DNA中的胞嘧啶甲基化水平降低后促进原癌基因启动子过度激活并诱导细胞恶性转化[4]。此外,研究表明MTHFR基因多态性影响大剂量MTX化疗的敏感性和特异性,并与大剂量MTX化疗的不良反应和预后有关[5]。2016年3月~2017年3月,我们通过检测ALL患儿MTHFR基因C677T和A1298C位点多态性,研究其与大剂量MTX化疗不良反应和临床预后的关系。
1 资料与方法
1.1 临床资料 选取2016年3月~2017年3月苏州大学附属儿童医院诊治的112例ALL患儿,其中男59例、女53例,年龄(6.2±2.4)岁。满足CCLG-ALL2008危险分型标准[6],其中标危51例,中高危61例。纳入标准:①ALL的诊断符合中华医学会儿科分会血液学组制定的《儿童急性淋巴细胞白血病诊疗建议(第四次修订)》[7];②均为初次诊治,既往未接受过化疗等治疗;③至少完成一周期的大剂量MTX化疗。排除标准:①临床病理及随访资料不完整;②未接受大剂量MTX化疗;③治疗前均无严重肝肾功能障碍
1.2 治疗方法 患儿均予大剂量MTX化疗,化疗剂量标危2 g/m2,中危及高危5 g/m2。24 h滴注MTX,突击量给药:将总剂量的10% 30 min内静脉快速滴注;均匀量给药:总剂量剩余90%在23.5 h内匀速静脉滴注,同时予以碳酸氢钠注射液碱化水化,及保护肝肾功能等辅助治疗。化疗后48 h监测血MTX药物浓度,36 h后予以亚叶酸钙解救治疗(15 mg/m2),6 h一次,根据MTX药物浓度决定给药次数,共6~8次,至血药浓度<0.1 μmol/L。
1.3 基因检测方法 患儿大剂量MTX治疗前,抽取空腹外周静脉血3 mL,枸橼酸钠抗凝,应用DNA提取试剂盒提取基因组DNA,应用琼脂糖凝胶电泳进一步确定DNA的完整性,-20 ℃冰箱保存。应用荧光定量PCR法对MTHRF基因C677T和A1298C位点进行单核苷酸多态性分析,C677T正向引物序列:5′-TGAAGGAGAAGGTGTCTGCGGGA-3′,逆向引物序列:5′-AGGACGGTGCGGTGAGAGTG-3′;A1298C正向引物序列:5′-CTTTGGGGAGGTGAAGGACTACTAC-3′,逆向引物序列:5′-CTTTGGGGAGGTGAAGGACTACTAC-3′。反应条件:95 ℃ 5 min、95 ℃ 30 s、60 ℃ 60 s、72 ℃ 60 s、72 ℃ 5 min,共40个循环。用限制性核酸内切酶对PCR产物进行限制性消化,总体系20 μL,其中12 μL PCR产物,2 μL 10×缓冲液B,2 μL 1 g/L乙酰化BSA,0.5 μL HinfⅠ限制性核酸内切酶,去离子水定容至20 μL。制备聚丙烯凝胶,取10 μL样品,2 μL的loading buffer 80 V电泳1 h,银染后干胶摄片。C677T野生型CC为198 bp单片段,TT型为23 bp,175 bp两个片段,CT型为23、175、198 bp三个片段。A1298C野生型AA为29、37、79 bp三个片段,CC型为37、108 bp两个片段,AC型为29、37、79、108 bp四个片段。
1.4 随访 所有患儿自出院之日起开始随访,随访时间1~35个月,中位随访时间26个月,随访间隔时间1~3个月,以门诊或电话方式随访,收集患儿化疗期间胃肠道反应、皮肤黏膜损伤等不良反应,化疗后血常规、肝肾功能等指标变化,复发情况、生存时间,计算各基因型患儿不良反应发生率、复发率及无事件生存期(EFI)。EFI为从确诊至事件发生或随访终止,事件定义为患儿诱导化疗失败、严重感染或死亡。复发指骨髓复发(骨髓原始+幼稚细胞≥25%)和(或)髓外复发如中枢神经系统复发(有相应的症状、体征,脑脊液有明确的白血病细胞且白细胞≥5×106/L)或睾丸复发(病理活检证实有白血病细胞浸润)。随访终点为2019年3月,无失访病例。
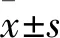
2 结果
2.1 ALL患儿MTHFR基因型分布 MTHFR基因 C677T位点中,野生型CC占34.8%(39/112),TT突变型占20.5%(23/112),CT突变型占44.6%(50/112),以CT突变型最常见;MTHFR基因A1298C位点中,野生型AA占53.6%(60/112),AC突变型占34.8%(39/112),CC突变型占11.6%(13/112),以野生型AA最常见。
2.2 大剂量MTX化疗与不良反应的关系 本研究中,大剂量MTX化疗后的主要不良反应中,胃肠道反应(如恶心、呕吐等)占56.3%(63/112),骨髓抑制占69.6%(78/112),皮肤黏膜损伤(如口腔黏膜炎、皮疹等)占45.5%(51/112),肝肾功能损伤占16.1%(18/112)。MTHFR C677T各基因型在胃肠道反应、骨髓抑制、皮肤黏膜损伤及肝肾功能损害间差异无统计学意义(P均>0.05),见表1。MTHFR A1298C各基因型在胃肠道反应间差异有统计学意义(P<0.05),而在骨髓抑制、皮肤黏膜损伤及肝肾功能损害间差异无统计学意义(P均>0.05),见表2。

表1 MTHFR C677T基因型对MTX化疗与不良反应关系

表2 MTHFR A1298C基因型对MTX化疗与不良反应关系
2.3 ALL患儿MTHFR C677T基因型与预后的关系 MTHFR C677T的CC、CT、TT基因型患儿复发率分别为7.7%(7/39)、15.0%(10/50),17.9%(2/23),TT型患儿复发率明显高于CC、CT型患儿(χ2分别为0.392、0.758,P分别为0.531、0.384)。CC、CT、TT基因型EFI分别为(25.59±7.64)、(22.61±7.64)、(17.90±7.62)个月,TT型ALL患儿EFI较CC型、CT型EFI长(t分别为3.534、2.322,P分别为0.001、0.023),而CC型与CT型EFI间差异无统计学意义(t=1.721,P=0.089)。
2.4 ALL患儿MTHFR A1298C基因型与预后的关系 MTHFR A1298C的CC、AA、AC各基因型患儿复发率分别为15.4%(2/13)、18.3%(11/60)、15.4%(6/39),各基因型患儿复发率间差异无统计学意义(χ2=0.173,P=0.917)。CC、AA、AC各基因型EFI分别为(25.23±8.35)、(20.29±7.71)、(19.90±7.02)个月,各基因型患儿EFI之间差异无统计学意义(F=3.03,P=0.052)。
3 讨论
小儿ALL是骨髓造血干细胞的恶性增殖性疾病。遗传因素与环境因素共同参与肿瘤的发生发展,环境因素可促进疾病发展,而基因的遗传易感性和对环境的反应性决定了白血病发生的风险[8]。近年来,随着新的ALL化疗药物的应用和治疗方案改进,提高了患儿的长期无病生存时间[9]。大剂量MTX化疗是小儿ALL治疗的重要化疗方案,对于诱导患儿持续缓解和预防ALL复发有重要意义。但临床治疗过程中,不同个体用药后的疗效和药物毒性反应不一,其原因是叶酸代谢调节基因的单核苷酸多态性对MTX的药物代谢动力学影响。此外,叶酸提供1-碳单位用于正常DNA合成和甲基化,对于细胞发挥其功能是必需的。MTHFR主要在体内促进5,10-亚甲基四氢叶酸生成5-甲基四氢叶酸,参与体内叶酸代谢。叶酸代谢相关酶的基因多态性,如MTHFR、二甲基四氢叶酸还原酶等基因,可下调叶酸水平或改变细胞中叶酸的分布,从而影响叶酸代谢,干扰DNA合成和甲基化,影响DNA合成和修复,增加患恶性肿瘤的风险[10]。本研究中,我们应用PCR-RFLP法分析ALL患儿的MTHFR基因两个常见的突变位点,即第677位的C-T突变和第1298位的A-C突变,探讨MTHFR基因多态性的分布及各基因型与大剂量MTX化疗不良反应和临床预后的关系。
本研究中,MTHFR C677T基因型中,CC型、TT型及CT型占比分别为34.8%、20.5%、44.6%,其中CT型最常见,与以往报道一致[11]。C677T的多态性发生在外显子4上,导致第222密码子处的丙氨酸被缬氨酸取代,导致MTHFR与其辅助因子黄素腺嘌呤二核苷酸结合力降低,叶酸水平降低,而同型半胱氨酸水平升高。研究表明,MTHFR C677T TT基因型与CC野生型相比,MTHFR酶活性仅为30%,而突变杂合子CT基因型的酶活性为CC野生型的60%[12]。本研究结果显示,ALL患儿C677T各基因型大剂量MTX化疗后不良反应间差异无统计学意义,但TT型患儿复发率低于CC、CT型患儿,TT型患儿EFI较CC型、CT型EFI长,表明C677T TT突变型对ALL具有保护性作用,与以往研究报道一致[13],其机制可能是C677T TT突变型通过分流一碳单位,促进细胞内胸苷和嘌呤合成,通过环状途径增加细胞内叶酸水平,增加大剂量MTX化疗细胞毒性,提高药物治疗的敏感性,从而降低ALL患儿复发率,延长患儿无事件生存时间[14]。本研究中,MTHFR A1298C基因型中,AA型、AC型、CC型分别为占53.5%、34.8%、11.6%,以AA型最常见。A1298C的多态性位于第7外显子中,导致第429位密码子谷氨酸被丙氨酸替代,这种多态性存在于MTHFR的S-腺苷甲硫氨酸(SAM)调节结构域中,结果导致与SAM结合后MTHFR酶构象发生改变,MTHFR酶活性受到抑制。研究表明,淋巴细胞中CC型的MTHFR酶活性仅为野生型AA型的60%,而AC型的酶活性为野生型的50%~60%[15]。ALL患儿大剂量MTX治疗后A1298C突变型CC型和AC型的消化系统不良反应发生率明显高于野生型AA型,表明与A1298C 野生型AA相比,CC和AC突变型MTX化疗后不易发生毒性反应,与以往报道一致[16]。表明CC和AC突变型可能是大剂量MTX化疗不良反应的保护因素。其原因是MTHFR酶活性降低导致5,10-亚甲基四氢叶酸增多,促进胸腺嘧啶的合成,进而起到对抗MTX的细胞毒性作用[17]。此外,本研究中A1298C CC、AA、AC型间复发率和EFI差异无统计学意义,可能与样本例数有限有关,有待进一步深入研究。
综上所述,MTHFR C677T基因多态性与ALLA患儿大剂量MTX治疗后毒性反应无关,TT型患儿复发率较CC型、CT型低,而EFI明显较长,MTHFR A1298C基因多态性与消化道不良反应有关,各基因型间复发率和EFI差异无统计学意义。检测ALL患儿MTHFR C677T、A1298C基因多态性有助于指导个体化治疗。
