血清趋化因子样受体1水平与2型糖尿病并发视网膜病变的关系
2020-03-25胡淑阳徐燕任舒婷
胡淑阳,徐燕,任舒婷
中国人民解放军联勤保障部队第904医院,江苏无锡 214044
2型糖尿病(T2DM)是临床最常见的慢性病及基础疾病之一。有数据表明,随着人们生活方式的不断改变,T2DM的发病率呈逐年升高趋势[1]。视网膜病变是T2DM患者较常见的一种微血管并发症,亦是导致盲眼病的重要原因[2]。迄今为止,关于糖尿病视网膜病变的具体发病机制尚未完全明确。多数研究者认为,糖尿病视网膜病变不仅与血糖及糖尿病病程相关,同时可能和脂肪代谢紊乱密切相关[3]。有研究[4]报道显示,糖尿病患者出现视网膜病变可能和多种血管生成因子及抑制因子相互作用引起的新生血管过度增殖及微血管损伤有关。其中近年来发现的趋化因子样受体1(CMKLR1)属于趋化脂肪因子Chemerin配体,已被证实其可参与炎症反应和免疫应答以及脂质代谢等多种与疾病相关的发展过程,而其是否与T2DM并发视网膜病变有关,有待深入研究[5]。另有学者指出,CMKLR1可能是Chemerin诱导的胰岛素抵抗的潜在治疗靶点[6]。2016年7月~2018年12月,我们检测了T2DM患者血清CMKLR1水平,并探讨其与T2DM并发视网膜病变的关系。现报告如下。
1 资料与方法
1.1 临床资料 选取2016年7月~2018年12月本院收治符合下述标准的T2DM患者123例,纳入标准:①患者均符合中华医学会糖尿病学分会《中国2型糖尿病防治指南(基层版)》[7]中所制定的T2DM相关诊断标准;②年龄≥18周岁;③无心、肺、肾等重要脏器疾病者;④无临床病历资料缺失。排除标准:①合并慢性感染、免疫系统、神经系统疾病者;②妊娠期或哺乳期女性;③伴有屈光改变、青光眼及白内障等眼部疾病者。按照全国眼底病学术会议制定的糖尿病视网膜病变诊断及分期标准[8],将123例T2DM患者分为单纯T2DM组42例及视网膜病变组81例。单纯T2DM组男26例、女16例,年龄(51.68±6.01)岁。体质量指数(BMI)为(25.91±4.20)kg/m2,收缩压(126.39±12.39)mmHg,舒张压(78.94±7.42)mmHg,吸烟7例,糖尿病病程(2.50±0.91)年。视网膜病变组男49例、女32例,年龄(51.30±5.79)岁。BMI(25.78±3.83)kg/m2,收缩压(127.11±12.34)mmHg,舒张压(78.42±7.57)mmHg,吸烟14例,糖尿病病程(8.92±1.42)年。另取同期于我院接受体检的健康人员60例为对照组。男37例、女23例,年龄(52.03±5.88)岁。BMI(24.95±3.15)kg/m2,收缩压(125.92±7.80)mmHg,舒张压(77.80±8.04)mmHg,吸烟9例。视网膜病变组糖尿病病程长于单纯T2DM组(P<0.05),其他基线指标三组差异均无统计学意义。本研究已获得所有纳入对象的同意,并得到医院伦理委员会批准。
1.2 血清CMKLR1及其他实验室指标检测 视网膜病变组、单纯T2DM组于入院当日,对照组于体检当日,采集清晨空腹肘静脉血5 mL,平均分装于两支EP管中,分离血清,3 000 r/min,15 min,置于-80 ℃冰箱中保存备用。以酶联免疫吸附(ELISA)法检测血清CMKLR1,具体操作务必以试剂盒说明书进行,相关试剂盒购自上海江莱生物科技有限公司。通过葡萄糖氧化酶法,以广州标佳科技有限公司生产的相关试剂盒完成空腹血糖(FPG)的检测。通过酶联免疫吸附法,以杭州联科生物技术股份有限公司生产的试剂盒完成糖化血红蛋白(HbA1c)的检测。采用日本日立公司生产的7060型全自动生化分析仪进行总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)的检测,试剂盒购自美国罗氏制药国际集团公司。
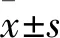
2 结果
2.1 三组血清CMKLR1水平及其他实验室指标水平比较 三组整体比较,除TC外,其余指标差异均有统计学意义(P均<0.05)。视网膜病变组和单纯T2DM组血清FPG、HbA1c、LDL-C及CMKLR1水平高于对照组,且HDL-C水平低于对照组(P均<0.05);视网膜病变组血清FPG、HbA1c、LDL-C及CMKLR1水平高于单纯T2DM组,而HDL-C水平低于单纯T2DM组(P均<0.05)。见表1。

表1 三组血清CMKLR1及其他实验室指标比较
注:与对照组相比,aP<0.05;与单纯T2DM组相比,bP<0.05。
2.2 血清CMKLR1与糖尿病病程、FPG、HbA1c、TG、LDL-C、HDL-C的相关性 Pearson相关性分析结果显示,血清CMKLR1与糖尿病病程、HbA1c、LDL-C呈正相关关系(r分别为0.602、0.517、0.526,P分别为0.000、0.018、0.014);与FPG、TG、HDL-C无相关性(P均>0.05)。
2.3 T2DM并发视网膜病变的Logistic回归分析 建立非条件Logistic回归模型,以本次研究的单纯T2DM组和视网膜病变组资料为样本,以是否并发视网膜病变为应变量,赋值1=是,0=否。自变量来自单因素分析中P<0.10的指标,经Logistic回归分析结果显示,糖尿病病程(较长)及血清CMKLR1水平(较高)均是T2DM并发视网膜病变的独立危险因素(P均<0.05)。见表2。

表2 T2DM并发视网膜病变的Logistic回归分析
注:表中两自变量均转化为两分类变量,转化界值即两组样本的对应总均值(适当取整),参见表中赋值。
2.4 血清CMKLR1诊断T2DM并发视网膜病变的价值 以本次研究的单纯T2DM组和视网膜病变组资料为样本,将T2DM指标水平划分成8个组段,绘制ROC曲线。结果显示,血清CMKLR1诊断T2DM并发视网膜病变的AUC为0.863,95%CI为0.658~0.878,理论阈值(截断值)为54.27 μg/L,灵敏度为0.861,特异度为0.830。
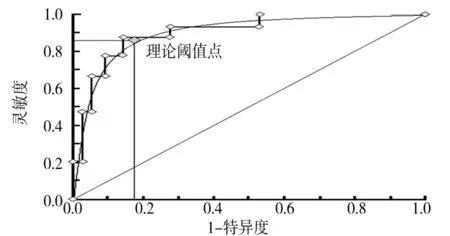
图1 血清CMKLR1诊断T2DM并发视网膜病变的ROC曲线
3 讨论
糖尿病作为代谢性疾病之一,已成为严重威胁我国居民身体健康的重大公共卫生问题。WHO相关数据表明,世界范围内约有3.5亿人受糖尿病的困扰,其中90%以上患者为2型糖尿病,至2030年糖尿病将成为全球第7大死亡原因[9,10]。糖尿病患者存在不同程度的血糖代谢异常,而长期处于上述状态会导致微血管结构及功能发生改变,进一步引起微循环障碍及血管新生,最终可引发糖尿病患者的视网膜病变[11,12]。因胰岛素代谢异常导致的眼组织、神经及血管微循环改变,继而引起眼的营养及视功能损坏是T2DM视网膜病变的主要病因。微血管主要是指组织与血液进行物质交换的重要场所,T2DM患者由于血液成分发生改变,继而导致血管内皮细胞功能异常,进一步导致血-视网膜屏障受损,最终引发视网膜病变[13]。随着近年来相关研究的不断深入,学者发现T2DM是由糖代谢及脂代谢紊乱所导致的固有性免疫长期慢性激活引起的慢性炎症反应,且在T2DM微血管并发症相关研究中亦发现了免疫和炎症均发挥重要作用。而Chemerin属于促炎症细胞趋化因子之一,主要发挥葡萄糖及脂肪代谢调节作用,且和胰岛素呈正相关[14]。而CMKLR1是Chemerin的受体,其表达异常可能引起脂肪细胞生成障碍,同时可能导致糖脂代谢异常。因此,笔者推测,其可能和胰岛素抵抗存在密切相关,在糖尿病微血管病变过程中起重要作用。临床已有研究[15]报道表明,糖尿病视网膜病变患者血清中的Chemerin水平显著升高。且有实验证实[16],沉默CMKLR1可有效抑制小鼠血管平滑肌细胞增殖,因此CMKLR1可能与视网膜病变有紧密联系。
据报道,随着糖尿病病程的不断增加,促进了患者的疾病进展、加重,进一步使得T2DM患者发生较为严重的视网膜病变[17,18],本研究结果与其一致。本研究还发现,视网膜病变组血清CMKLR1水平高于单纯T2DM组,单纯T2DM组血清CMKLR1水平又高于对照组,差异均有统计学意义,同时,经Logistic回归分析结果显示,血清CMKLR1水平是T2DM并发视网膜病变的独立危险因素。提示随着血清CMKLR1水平的不断升高,T2DM患者并发视网膜病变的风险随之增高。究其原因,CMKLR1属于脂肪因子Chemerin的内源性配体,和配体相结合后可促进细胞内钙离子的释放,继而通过调控ERK1及核转录因子等信号通路,进一步作用在中性粒细胞、单核巨噬细胞及未成熟的树突状细胞等炎症细胞因子,同时释放IL-6、肿瘤坏死因子-α等炎症因子,以此介导炎症反应发生发展。且随着上述相关炎症因子表达的逐渐增加,会促进脂肪细胞的脂解加速,进一步使得游离脂肪酸溢出细胞,从而在胰岛素抵抗的发生过程中起重要作用[19],间接促进微血管病变的发生。经Pearson相关性分析结果显示,血清CMKLR1与糖尿病病程、HbA1c、LDL-C呈正相关关系。提示血清CMKLR1与糖尿病病程及HbA1c、LDL-C水平存在密切相关,分析原因可能是随着糖尿病病程的不断延长,糖尿病患者胰岛素抵抗程度越明显,进一步引起CMKLR1表达异常。本研究通过分析CMKLR1诊断T2DM并发视网膜病变的价值,结果显示,血清CMKLR1诊断T2DM并发视网膜病变的价值较高,其AUC高达0.863,且灵敏度达到0.861,有助于更好地进行临床诊断。
综上所述,血清CMKLR1水平和T2DM并发视网膜病变密切相关,检测血清CMKLR1水平对诊断T2DM并发视网膜病变具有较高的预测价值。
