经耳缘静脉注射ADSCs修复兔SANFH的效果及细胞定植研究*
2020-03-23齐新文
齐新文
遵义医科大学第五附属(珠海)医院骨二科,广东 珠海 519100
激素性股骨头坏死(Steroid-induced avascular necrosis of the femoral head,SANFH)是因长期大剂量应用激素所引致的一种代谢性疾病[1],其致残性高,对社会产生较大影响[2]。因此,寻求针对SANFH有效的治疗方法,具有重要的临床意义[3]。本研究通过经耳缘静脉注射的方式移植经Brdu标记的脂肪干细胞(Adipose mesenchymal stem cells,ADSCs),观察ADSCs在坏死股骨头区的定植情况及其对SANFH的修复效果,试图寻求一种有效干预SANFH的新方法,研究结果如下。
1 材料与方法
1.1 实验动物
45只体重为2.5~3.0 kg的雄性新西兰大白兔,均为8月龄,于广东省实验动物中心购买,许可证号为SCXK(粤)20140035。各兔单独分笼饲养,自由饮水及进食饲料。实验中所有操作与动物伦理学要求相符。
1.2 实验试剂及仪器
溴脱氧尿嘧啶核苷(Bromodeoxyurdine,BrdU)(广州玺美生物科技有限公司);马血清(SH30074.03,Hyclone);DMEM培养基(SH30243.01,Hyclone); 125mg注射用甲基强的松龙(武汉新星生物药业有限公司);离心机(Thermo-ST16,上海仁器仪器公司);石蜡切片机(RM2235,德国Leica公司);电子显微镜(日本尼康公司)。
1.3 方法
1.3.1 建立兔激素性股骨头坏死模型:从实验兔中随机选取3只兔作分离ADSCs用,均不用于造模,余42兔作为建模兔。将各建模兔经耳缘静脉注射10 ml/kg马血清,3周后各兔经耳缘静脉注射5 ml/kg马血清。最后一次注射马血清后两周,经腹腔注射5 ml/kg甲基强的松龙,连续注射3 d,两周后各建模兔麻醉后完善髋部正位片及髋部磁共振成像(Magnetic Resonance Imaging,MRI)检查了解股骨头情况。以髋关节正位片见股骨头密度欠均匀、囊性变,同时髋部MRI见股骨头软骨下带状低信号,关节积液增多,认为兔激素性股骨头坏死模型建立成功[4]。
1.3.2 建模后分组:随机选取36只造模成功的兔进行随机分组,分为静脉注射组、局部注射组及对照组,每组各12只兔。
1.3.3 兔ADSCs的提取及培养传代:将非造模兔经耳缘静脉注射10%水合氯醛(剂量为1.5 ml/kg)充分麻醉后,将兔固定于固定板上,消毒后从颈项部切取约3 g脂肪组织。磷酸缓冲盐溶液(phosphate buffer saline,PBS)冲冼3次后剪至糊状放入无菌瓶中,加入0.1%Ⅰ型胶原酶溶解,吸出溶液5 ml,并同量完全培养基一起加入到15 ml离心管中离心5 min,过滤后接种于培养瓶中,置入培养箱中(37℃,5%CO2)培养,将细胞传代至第3代。将第3代细胞进行流式细胞学鉴定确认为ADSCs。
1.3.4 溴脱氧尿嘧啶核苷(Bromodeoxyurdine,BrdU)标记ADSCs并制成细胞溶液:取第3代ADSCs接种于T25培养瓶中进行培养,细胞浓度为1×105/cm2。待细胞汇合度达80%,往培养瓶中加入100μl浓度为10μmol/L的BrdU,于培养箱内孵育48 h。将ADSCs经消化离心后,加入单纯高糖培养基重悬细胞,制成1×107/ml的细胞悬液备用。
1.3.4 兔ADSCs移植干预兔激素性股骨头坏死:局部注射组:将各兔左髋部备皮、消毒并铺无巾后,依次置于X线机下,俯卧位,充分固定四足后,使用5 ml注射器从左髋关节刺入,X线机摄片证实注射器尖端已达股骨头后,注入 5ml经BrdU标记的ADSCs。静脉注射组:将兔右耳缘静脉局部充分备皮后,经耳缘静脉注入5 ml已标记BrdU的ADSCs。对照组不作任何干预。
1.3.5 干预后4周、8周各组兔股骨头组织学分析:于干预后第4周、第8周各组随机选取6只模型兔,处死后切取各组兔左侧股骨头将各兔左侧股骨头进行脱钙、脱水、透蜡并包埋,切片脱蜡至水。将各兔股骨头切片分成两部份,一部份作HE染色,100倍显微镜下观察各组兔两时间点股骨头骨陷窝、骨小梁情况,并计算空骨陷窝率;一部份作Brdu免疫组化染色,100倍显微镜下观察BrdU标记的ADSCs经静脉移植后在病变股骨头的定植情况,并计数Brdu阳性细胞数量。
1.3.6 统计学方法
数据采用SPSS 17.0软件进行统计分析,计量资料以均数±标准差()表示,干预后同一时间点各组间比较,采用单因素方差分析,组间比较采用t检验;以P<0.05为差异有统计学意义。
2 结果
2.1 兔激素性股骨头坏死模型的建立情况
42只大白兔经静脉注射马血清联合腹腔注射甲基强的松龙后,2兔出现死亡,考虑腹腔注射后出现感染所致,共37兔建模成功。
2.2 各组兔干预后4周、8周股骨头组织形态变化
干预后4周:对照组可见较多空骨陷窝及脂肪细胞、骨小梁稀疏,而局部注射组、静脉注射组空骨陷窝及脂肪细胞数量较对照组少,骨小梁稍稀疏。
干预后8周:对照组可见空骨陷窝及脂肪细胞数量较干预后4周增多,部分脂肪细胞已融合成团,可见骨小梁断裂;局部注射组及静脉注射组可见空骨陷窝及脂肪细胞数量极少,骨小梁较致密。
2.3 各组兔干预后4周、8周股骨头空骨陷窝率测定
于干预后4周、8周分别测量各组兔股骨头空骨陷窝率,结果可见干预后4周、8周局部注射组及静脉注射组的空骨陷窝率均高于对照组,差异有统计学意义(P<0.05),而局部注射组与静脉注射组比较差异无统计学意义(P>0.05)。干预后8周局部注射组及静脉注射组空骨陷窝率均低于同组干预后4周,差异有统计学意义(P<0.05)。见表1。
表1 干预后4周、8周各组股骨头空骨陷窝率() %
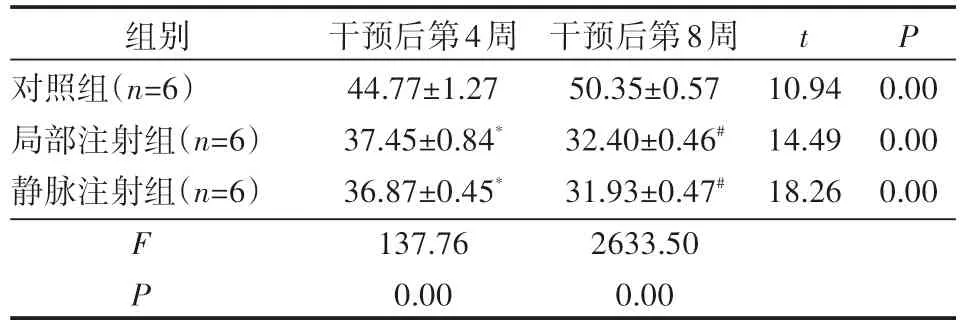
表1 干预后4周、8周各组股骨头空骨陷窝率() %
注:*表示在干预后4周与对照组比较,P<0.05;#表示在干预后8周与对照组比较,P<0.05。
P t组别对照组(n=6)局部注射组(n=6)静脉注射组(n=6)10.94 14.49 18.26 0.00 0.00 0.00 FP干预后第4周44.77±1.27 37.45±0.84*36.87±0.45*137.76 0.00干预后第8周50.35±0.57 32.40±0.46#31.93±0.47#2633.50 0.00
2.4 各组兔干预后4周、8周后Brdu免疫组化染色
于干预后4周、8周,局部注射组及静脉注射组可见细胞核呈棕褐色的Brdu标记阳性细胞,并随时间推移,阳性细胞增多。对照组于干预后第4周、第8周均未见经Brdu标记的阳性细胞。干预后8周局部注射组及静脉注射组Brdu阳性细胞数均高于同组干预后4周(P<0.05);而于干预后4周、8周局部注射组与静脉注射组比较,差异无统计学意义(P>0.05)。见表2。
表2 干预后4周、8周各组Brdu阳性细胞数() %

表2 干预后4周、8周各组Brdu阳性细胞数() %
注:*表示与同组干预后4周作比较,P<0.05。
组别局部注射组(n=6)静脉注射组(n=6)t P 0.00 0.00干预后8周35.19±1.01*34.78±1.56*0.60 0.56干预后4周23.23±1.03 22.87±1.75 0.49 0.64 22.74 13.913 tP
3 讨论
SANFH是骨科临床常见的难治性疾病[5],目前其保髋治疗方法如药物及物理治疗、高压氧治疗、髓芯减压手术治疗等均能起一定的疗效,但远期效果仍欠满意[6]。目前已有研究指出局部注射移植干细胞可对激素性股骨头坏死起较好的修复效果,其主要修复机制考虑与干细胞的多向分化能力促进骨修复及其分泌因子促进局部血管生成有关[7],干细胞疗法有望成为治疗SANFH的良好疗法[8]。本研究通过操作简单的经耳缘静脉注射方法,移植干细胞种类中易获取、增殖能力强的ADSCs,观察ADSCs在股骨头的归巢及其对股骨头坏死的修复效果,探讨静脉注射ADSCs修复SANFH的可行性,目前该方面的研究国内外报道较少。
从Brdu免疫组化结果可得,干预后4周及干预后8周静脉注射组均可见Brdu阳性细胞,并且随着时间延长,阳性细胞会随着增多,说明经耳缘静脉注射的ADSCs可逐渐定植于坏死股骨头区,并且从统计学分析结果可得,其定植数量与经局部注射移植无明显差异,说明经静脉注射ADSCs可在股骨头达到与局部注射相近的细胞浓度。但经静脉注射的ADSCs如何经血液循环到达有血运障碍的股骨头区,具体机制需进一步研究。有研究指出,干细胞可特异性地归巢于缺血或损伤的组织中[9],这主要与组织缺血损伤后分泌的趋化因子及黏附分子有关[10]。经静脉注射进入血液循环中的ADSCs,可能受到坏死股骨头区分泌趋化因子及黏附分子的作用,从而定植于股骨头区。
从组织学分析结果可见,于干预后4周、8周,局部注射组及静脉注射组脂肪细胞数量均明显比对照组少,而骨小梁均较对照组致密,空骨陷窝率两干预组均低于对照组,但两干预组的镜下组织学表现与空骨陷窝率均无明显差异。可见经耳缘静脉注射ADSCs可对兔SANFH具有一定的修复效果,并且可能达到与局部移植相近的修复效果。
综上所述,经耳缘静脉移植ADSCs可定植于股骨头区,对SANFH有一定的修复作用。
