牛磺酸修饰巯基化壳聚糖季铵盐载体的合成及其体外shTNF-α pDNA递送效果
2020-03-23陈瑾轩印春华
陈瑾轩,印春华
(复旦大学 生命科学学院,上海 200438)
急性肝损伤(Acute Liver Injury, ALI)是临床常见疾病之一,可导致肝实质细胞严重受损,肝组织中大量肝细胞坏死和凋亡,肝功能衰竭[1].目前治疗急性肝损伤的手段包括血浆置换、体外肝脏辅助装置、肝脏移植等[2],这些手段价格昂贵,治疗风险大,患者顺应性差,缺乏特效药物治疗急性肝损伤.肿瘤坏死因子-α(Tumor Necrosis Factor-α, TNF-α)具有潜在的细胞毒性,可引起炎症级联反应,其过度表达与ALI相关[3].RNA干扰(RNA interference, RNAi)是一项诱导序列特异性mRNA降解后基因沉默技术[4],其具有高效、低毒、特异性强等优点,已用于肿瘤、炎症等疾病的治疗,具有较大的临床应用潜力[5-6].其中,短发夹RNA(shRNA)是诱导RNAi的常用手段之一,shRNA是含反向重复序列的发夹状RNA,先克隆至pDNA表达载体,进入细胞核持续转录shRNA后被Dicer酶切割为siRNA可发挥RNAi功效,故shRNA介导的基因沉默功效较siRNA更稳定与持久[7].不过pDNA体内稳定性差;与荷负电细胞膜静电相斥,不易被细胞摄取,转染率低[8].故需借助安全有效的载体,递送pDNA至靶细胞,发挥基因沉默功效.
近年来,非病毒纳米载体在基因抗炎症研究中发展迅速,其生物可降解,生物相容性好,无免疫原性[9];无遗传毒性和细胞毒性;可高效包裹、浓缩和保护pDNA[10];表面积大,可偶联功能配体,高效介导体内外基因转染[11].壳聚糖生物相容,生物可降解,无免疫原性,可进行多种功能化修饰,用于化疗药物、基因药物以及免疫药物的递送[12-13].壳聚糖经季铵化修饰可增强其水溶性和正电性,增强聚合物与基因药物的结合力,也可与小肠紧密连接处的荷负电脂质作用,打开紧密连接,促进小肠吸收[14];牛磺酸可缓解急性肝损伤[15],且文献报道[16]胆汁酸在分泌出肝细胞前会与甘氨酸或牛磺酸结合,以结合物形式被小肠吸收并历经多次肠肝循环,以牛磺酸修饰壳聚糖,进入肝脏的纳米复合物有望通过牛磺酸基团与胆汁酸结合后进入肠道,再被肠道重吸收进入全身循环,提高基因药物的生物利用度[16-18];壳聚糖经巯基化修饰可与小肠黏液层糖蛋白和细胞膜表面富含半胱氨酸的区域交联形成二硫键,增强黏膜黏附和细胞摄取[19].
本实验合成了牛磺酸修饰壳聚糖季铵盐(Taurine-modified Trimethyl chitosan, TT)和牛磺酸修饰巯基化壳聚糖季铵盐(Taurine-modified Trimethyl Chitosan-cysteine, TTC)聚合物,TT和TTC包载沉默肿瘤坏死因子-α的质粒编码短发夹RNA(shTNF-α pDNA),形成纳米粒(TT-shTNF-α pDNA和TTC-shTNF-α pDNA),考察纳米粒的理化性质、细胞毒性、摄取与摄取途径、体外基因沉默效果等.
1 材料与方法
1.1 材料与细胞
壳聚糖(脱乙酰度: 85%,分子量: 200kDa)购自浙江金壳药业有限公司;牛磺酸(Taurine,Tau)、L-半胱氨酸盐酸盐(L-cysteine, Cys)、1-乙基-3-(3-二甲氨基丙基)-碳二亚胺盐酸盐(1-ethyl-3-(3-dimethylaminopropyl) carbodiimide, EDC)、N-羟基琥珀酰亚胺(N-hydroxysuccinimide, NHS)购自上海源聚生物科技有限公司;pGL、shTNF-α pDNA购自山东维真生物科技有限公司;过滤器CS1(Filtration CS1)、吸附柱CP6(Spin Columns CP6)购自天根生化科技(北京)有限公司;粗糠柴毒素(Rottlerin)、异硫氰酸荧光素(Fluorescein Isothiocyanate, FITC)购自Sigma;染料木素(Genistein)、氯丙嗪(Chlorpromazine)购自Selleck Chemicals;TNF-α ELISA试剂盒购自上海优宁维生物科技股份有限公司;其他试剂均为分析纯.
Raw 264.7细胞(ATCC,美国),以含10% FCS、1%谷氨酰胺、1%非必需氨基酸、100U/mL氨苄青霉素和100U/mL链霉素的DMEM于37℃、5%CO2培养箱中培养.
1.2 方法
1.2.1 TT和TTC的合成与表征
参照文献[20]方法合成N,N,N-三甲基壳聚糖季铵盐(TMC).称取0.1g Tau溶于2mL H2O,加入0.08g EDC和0.05g NHS,以1mol/L HCl调节pH至4.8,搅拌活化24h;称取0.05g TMC,溶于5mL H2O,加至Tau反应液中,搅拌5h,以pH 5.0 HCl溶液透析3d(MWCO 3500 Da),冷冻干燥,所得产物即为TT.
称取0.05g TT,溶于5mL H2O;称取0.1g Cys,溶于1mL H2O,以10mol/L NaOH调节Cys溶液pH至2.0,混合TT与Cys溶液,加入0.23g EDC和0.14g NHS,以1mol/L NaOH调节pH至5.0,避光搅拌反应5h,以pH 5.0 HCl溶液4℃透析3d,所得产物即为TTC.
TMC和TT分别溶于氘水(D2O),以四甲基硅烷(TMS)为内标,核磁共振仪测定1H NMR图谱.参照文献[20]方法测定TTC游离巯基和二硫键含量.
1.2.2 纳米粒的制备与表征
以H2O配制2mg/mL TT、TTC溶液和0.2mg/mL shTNF-α pDNA溶液,涡旋下滴加一定体积的shTNF-α pDNA溶液分别至TT和TTC溶液中,制备聚合物-shTNF-α pDNA质量比为20∶1的纳米粒,37℃水浴30min,制得纳米粒,分别命名为TT-shTNF-α pDNA和TTC-shTNF-α pDNA.
ZetasizerNano-ZS型电位及粒度测定仪测定纳米粒的粒径和Zeta电势.量取一定体积的裸shTNF-α pDNA或TT-shTNF-α pDNA、TTC-shTNF-α pDNA(含2μg shTNF-α pDNA),加入适量溴酚蓝混合均匀,加样至1%琼脂糖凝胶上样孔,130V电泳40min,Gelsafe核酸染料显色,FR-980A生物电泳图像分析系统观察.
1.2.3 纳米粒稳定性
按1.2.2项下方法制备TT-shTNF-α pDNA和TTC-shTNF-α pDNA,以1mol/L HCl调节纳米粒溶液pH至1.2,测定其粒径和Zeta电势,再将pH 1.2的纳米粒溶液以1mol/L NaOH回调pH至7.4,测定其粒径和Zeta电势.量取一定体积的TT-shTNF-α pDNA和TTC-shTNF-α pDNA溶液,分别与0.4,0.8,1.0,1.6,2.0,4.0和8.0mg/mL肝素钠溶液等体积混合,使肝素钠终浓度为0.2,0.4,0.5,0.8,1.0,2.0和4.0mg/mL,室温避光静置2h,加入适量溴酚蓝混合均匀,加样至1%琼脂糖凝胶上样孔,130V 电泳40min,Gelsafe核酸染料显色,FR-980A生物电泳图像分析系统观察.
1.2.4 体外释放
参照文献[21]方法制备异硫氰酸荧光素(FITC)标记shTNF-α pDNA,制备包载FITC-pDNA的纳米粒(含5μg FITC-pDNA),13300r/min离心15min,弃上清,沉淀加入500μL PBS(0.2mol/L,pH 7.4),重悬分散,37℃,100r/min培养,分别于1,2,4,6,8,12和24h 13300r/min离心15min,吸取上清250μL,同时补充250μL释放介质,酶标仪测定FITC-pDNA含量(λex=488nm,λem=519nm),计算累积释放百分率(%),绘制释放曲线.
1.2.5 细胞毒性
按1.2.2项下方法制备载无功能质粒pGL的TT-pGL和TTC-pGL纳米粒,以1×104细胞/孔密度接种Raw 264.7细胞至96孔板,37℃、5%CO2培养24h,每6孔为一组,按每孔5,50,250,1000和1500μg/mL 聚合物加入2mg/mL TT和TTC聚合物溶液,按每孔2,4,6,8,10和20μg/mL pGL加入TT-pGL和TTC-pGL,以加0.2mol/L pH 7.4 PBS的孔为对照,37℃、5%CO2培养6h;吸弃孔内液体,每孔分别加入200μL新鲜培养基和20μL以0.2mol/L PBS(pH 7.4)配制的5mg/mL MTT溶液,37℃、5%CO2培养3h;每孔液体换为200μL DMSO,37℃、100r/min振荡30min,测定570nm吸光值,以对照孔吸光值为100%存活率,计算各组细胞相对存活率.
1.2.6 细胞摄取
以5×104细胞/孔密度接种Raw 264.7细胞至24孔板,37℃、5%CO2培养24h,将每孔液体换为DMEM,3孔为一组,按照每孔2μg/mL FITC-pDNA加入TT-FITC-pDNA、TTC-FITC-pDNA和裸FITC-pDNA,37℃、5%CO2培养4h;弃去孔中液体,每孔加0.2mol/L PBS(pH 7.4)洗3次,弃去PBS,每孔加0.5mL 0.5%(质量浓度)SDS溶液(pH 8.0),37℃、100r/min避光振荡30min,酶标仪测定FITC-pDNA的荧光强度(λex=488nm,λem=519nm),Lowry法测定细胞蛋白含量,摄取量以每毫克蛋白含FITC-pDNA的量(μg)表示(μg/mg).
1.2.7 细胞摄取机制
1.2.7.1 抑制剂细胞毒性 以1×104细胞/孔的密度接种细胞至96孔板,37℃、5%CO2培养24h;6孔为一组,每组孔中分别加入不同浓度的叠氮钠(50,100和200mmol/L),染料木素(5,10和20μg/mL),氯丙嗪(0.75,1和2μg/mL)和粗糠柴毒素(10,50和100μmol/L),以加0.2mol/L PBS(pH 7.4)的孔为对照,37℃,5%CO2培养6h;吸弃孔内液体,每孔分别加入200μL新鲜培养基和20μL以0.2mol/L PBS(pH 7.4)配制的5mg/mL MTT溶液,37℃、5%CO2培养3h;每孔液体换为200μL DMSO,37℃、100r/min振荡30min,测定570nm吸光值,以对照孔吸光值为100%存活率,计算各组细胞相对存活率.
1.2.7.2 Raw 264.7细胞摄取机制 分别加入终浓度为50mmol/L叠氮钠、5μg/mL染料木素、50μmol/L 粗糠柴毒素和2μg/mL氯丙嗪,37℃、5%CO2培养30min,加入纳米粒溶液(每孔含2μg/mL FITC-pDNA),37℃、5%CO2培养4h,以不加抑制剂细胞摄取量记为100%,计算各试验组相对细胞摄取率.
1.2.8 体外基因沉默
以4×104细胞/孔的密度接种细胞至24孔板,37℃、5%CO2培养24h;3孔为一组,每组孔中分别加入TT-shTNF-α pDNA和TTC-shTNF-α pDNA(每孔含6μg/mL shTNF-α pDNA),以加0.2mol/L PBS(pH 7.4)的孔为对照,37℃、5%CO2培养4h,吸弃孔内液体,每孔加入1mL完全培养基,37℃、5%CO2继续培养44h,孔中加入LPS,使其终浓度为10ng/mL,37℃刺激5h;吸取上清液,TNF-α ELISA试剂盒测定TNF-α含量.以对照组TNF-α含量为100%,计算各试验组TNF-α相对百分含量(%).
2 结果与分析
2.1 TT和TTC的合成与表征
图1为TTC合成路线图.壳聚糖上游离氨基分别与碘甲烷、Tau和Cys反应,制得牛磺酸修饰壳聚糖季铵盐(TT)和牛磺酸修饰巯基化壳聚糖季铵盐(TTC).
图2为TMC和TT的1H NMR图谱.3.26×10-6处为壳聚糖上季胺基团的甲基氢峰,表明成功合成TMC;3.48×10-6~3.58×10-6处为牛磺酸-CH2-基团氢峰,表明成功合成TT;Ellman’s法测得TTC游离巯基含量为(76.6±3.5) μmol/g,二硫键含量为(147.1±4.5) μmol/g.
2.2 纳米粒的制备和表征
表1为TT-shTNF-α pDNA和TTC-shTNF-α pDNA粒径和Zeta电势.可见TTC-shTNF-α pDNA粒径小于TT-shTNF-α pDNA,这是因为TTC分子内与分子间二硫键可提高聚合物折叠并拢和缩合shTNF-α pDNA的能力,使纳米粒结构更紧致,粒径减小[22-23].图3(a)为纳米粒的凝胶电泳图,纳米粒可

表1 TT-shTNF-α pDNA和TTC-shTNF-α pDNA粒径和电势Tab.1 Particle sizes and Zeta potentials of TT-shTNF-α pDNA and TTC-shTNF-α pDNA
完全阻滞shTNF-α pDNA的迁移,表明纳米粒可有效缩合shTNF-α pDNA.
2.3 纳米粒稳定性
模拟从胃部酸性环境进入肠道中性环境后的pH变化过程,研究pH 1.2至7.4时纳米复合物的稳定性,若pH变化后纳米复合物结构稳定,则表明纳米复合物口服递送过程中可保护所载基因药物的完整性.表2为TT-shTNF-α pDNA和TTC-shTNF-α pDNA pH变化后的粒径和Zeta电势.pH降至1.2时,TT-shTNF-α pDNA粒径变化不明显,电势降低,TTC-shTNF-α pDNA粒径和电势无明显变化,表明TTC-shTNF-α pDNA耐受胃部酸性环境
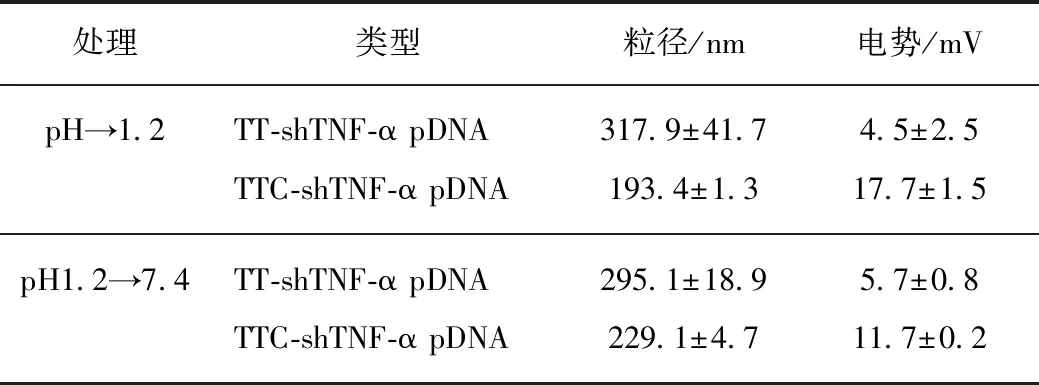
表2 pH处理后TT-shTNF-α pDNA和 TTC-shTNF-α pDNA的粒径和电势Tab.2 Particle sizes and Zeta potentials of TT-shTNF-α pDNA and TTC-shTNF-α pDNA after pH alteration
能力强于TT-shTNF-α pDNA,可在胃部环境中保持结构稳定;pH回调至7.4时,TT-shTNF-α pDNA粒径和电势无明显变化,TTC-shTNF-α pDNA粒径略微增大,电势降低,表明两种纳米粒在从胃部酸性环境进入肠道中性环境后可保持结构稳定.
肝素钠为黏多糖硫酸酯类物质,其N-硫酸基在水溶液中水解而产生较强负电荷,可与阳离子复合物形成分子络合物.当载有负电荷pDNA的纳米粒与肝素钠溶液混合时,肝素钠可竞争结合至纳米粒,致使pDNA从纳米粒中解离,因此肝素钠解离试验可用于定性考察纳米粒与pDNA间的结合力.图3(b)为TT-shTNF-α pDNA和TTC-shTNF-α pDNA与不同浓度肝素钠溶液共培育2h后的凝胶电泳图,可见TT-shTNF-α pDNA和TTC-shTNF-α pDNA肝素钠最低解离浓度均为0.5mg/mL,TT、TTC与shTNF-α pDNA结合力相同.
2.4 体外释放
pH 7.4的PBS可模拟动物体内生理环境,研究pH 7.4条件下纳米复合物的药物释放特性可预测体内基因药物释放行为.图4为TT-shTNF-α pDNA和TTC-shTNF-α pDNA在0.2mol/L PBS(pH 7.4)中的释放曲线,可见TT-shTNF-α pDNA和TTC-shTNF-α pDNA均初期突释后期缓释,24h累积释放百分比分别为56.0%和54.5%.
2.5 细胞毒性
图5为TT载体、TT-pGL、TTC载体和TTC-pGL分别与Raw 264.7细胞共培养6h后的细胞相对存活率,可见TT和TTC载体在5~250μg/mL范围内,细胞存活率均超过90%,表明此浓度范围内的TT和TTC载体无明显细胞毒性;载2~6μg/mL pGL纳米粒组细胞平均存活率高于90%,表明pDNA浓度在6μg/mL以下时,两种纳米粒均无明显细胞毒性,不影响细胞的代谢活力,确保了后续试验的可靠性.
2.6 细胞摄取与机制
图6(a)为TT-FITC-pDNA和TTC-FITC-pDNA与Raw 264.7细胞共培养4h后的细胞摄取量结果,可见TT-FITC-pDNA和TTC-FITC-pDNA摄取量均显著高于裸FITC-pDNA,TTC-FITC-pDNA摄取量显著高于TT-FITC-pDNA,这是因为巯基基团可与细胞膜表面富含半胱氨酸的糖蛋白交联形成二硫键增加细胞摄取.
图6(b)为细胞摄取抑制剂处理后的Raw 264.7细胞活力,可见50mmol/L的叠氮钠,5μg/mL的染料木素,50μmol/L的粗糠柴毒素和2μg/mL的氯丙嗪均无细胞毒性,确保后续细胞摄取抑制试验结果的可靠,故选择上述浓度进行后续试验.
图6(c)为不同细胞摄取抑制剂预处理后Raw 264.7细胞对TT-FITC-pDNA和TTC-FITC-pDNA的细胞摄取,叠氮钠可抑制胞内腺苷三磷酸(ATP)的合成,经叠氮钠处理后,TT-FITC-pDNA和TTC-FITC-pDNA摄取量均显著降低,表明纳米粒主要经能量依赖的内吞方式入胞[24];粗糠柴毒素可阻断巨胞饮介导的细胞内吞[25],粗糠柴毒素处理后细胞对TT-FITC-pDNA和TTC-FITC-pDNA摄取量均显著下降,表明两种纳米粒均通过巨胞饮介导的内吞方式入胞;染料木素可特异性抑制小窝蛋白介导的内吞[26],染料木素处理后细胞对两种纳米粒的摄取量显著下降,表明纳米粒均通过小窝蛋白介导的内吞入胞;氯丙嗪可特异性抑制网格蛋白介导的内吞[26],氯丙嗪处理后细胞对TTC-FITC-pDNA摄取量显著下降,对TT-FITC-pDNA摄取量无明显变化,表明TTC-FITC-pDNA经过网格蛋白介导的内吞方式入胞,TT-FITC-pDNA则不经此途径入胞.
2.7 体外基因沉默
图7为TT-shTNF-α pDNA和TTC-shTNF-α pDNA转染Raw 264.7细胞48h后TNF-α蛋白的表达情况.pDNA剂量为6μg/mL 时,TT-shTNF-α pDNA和TTC-shTNF-α pDNA均可显著抑制TNF-α蛋白表达,TTC-shTNF-α pDNA基因沉默效果优于TT-shTNF-α pDNA,这是因为TTC-shTNF-α pDNA细胞摄取量高于TT-shTNF-α pDNA.
3 讨 论
壳聚糖脱乙酰度决定其分子链上胺基(-NH2)含量,85%的脱乙酰度有利于提高壳聚糖溶解性,降低生产难度和促进壳聚糖以酰胺键接枝多种功能配体.文献[27]报道聚合物分子量过大,聚合物分子链过长,穿透细胞膜能力减弱,不利于有效递送药物.且本课题组前期研究表明分子量200kDa,脱乙酰度85%的壳聚糖衍生物可高效包载并递送基因药物,治疗肝癌、急性肝损伤、溃疡性结肠炎等多种疾病[3,11,28].因此本研究选择脱乙酰度85%,分子量200kDa的壳聚糖进行后续实验.Raw 264.7细胞属于巨噬细胞,且据文献报道脂多糖(LPS)活化的Raw 264.7细胞可作为炎症巨噬细胞模型,可用于研究巨噬细胞的炎症疾病治疗方法[11].急性肝损伤的发病过程与促炎症细胞因子肿瘤坏死因子-α(TNF-α)密切相关,炎症状态下的巨噬细胞分泌大量TNF-α,抑制TNF-α的分泌可治疗急性肝损伤[3].以Raw264.7作为细胞模型,可模拟和预测体内纳米粒被炎症巨噬细胞摄取的过程以及沉默TNF-α表达的效果.本研究采用季铵基团、牛磺酸基团和巯基基团修饰壳聚糖,合成牛磺酸修饰壳聚糖季铵盐(TT)和牛磺酸修饰巯基化壳聚糖季铵盐(TTC).为达到更加稳定和持久的基因沉默效果[7],本课题采用shTNF-α pDNA,特异性沉默TNF-α表达.TT和TTC分别与shTNF-α pDNA按照质量比20∶1自组装形成纳米粒(TT-shTNF-α pDNA和TTC-shTNF-α pDNA),与TT-shTNF-α pDNA相比,TTC-shTNF-α pDNA粒径更小,pH稳定性更好,细胞摄取量更多,基因沉默效果更强.
文献[29]报道小肠是药物口服吸收的主要场所,小肠上皮细胞在药物吸收中起重要作用.其中回肠段绒毛丰富,消化酶含量相对较少,上皮细胞紧密连接的致密性相对较弱且含有派氏结,派氏结可吞噬肠腔内物质,经免疫细胞转运和呈递进入血液循环[30-31].纳米粒可能经小肠正常上皮组织吸收或被位于派氏结袋形囊腔中的巨噬细胞吸收,进入血液循环和淋巴循环,随巨噬细胞递送pDNA至炎症部位.后期可考察TTC-shTNF-α pDNA的体外细胞单层转运,进一步阐明纳米粒口服后胃肠道的吸收部位;口服递送TTC-shTNF-α pDNA治疗小鼠急性肝损伤模型,进一步验证牛磺酸基团的功效以及TTC-shTNF-α pDNA的体内基因沉默功效.
