苯菌灵添加对植物种间竞争的影响:以加拿大一枝黄花与野大豆为例
2020-03-23吕盈和邱士允
吕盈和,邱士允,李 博
(1.复旦大学 生物多样性与生态工程教育部重点实验室, 上海 200438; 2.复旦大学 生命科学学院 生物多样性科学研究所, 上海 200438)
土壤微生物(包括共生微生物、自主生活微生物及病原菌)对植物的生长、繁殖及植物的群落动态起到重要调控作用[1].其中共生微生物如菌根真菌、根瘤菌能够显著增加植物对水分及矿质营养的吸收、促进植物的生长与繁殖[1-3],是影响植物种间竞争及群落动态的主要因子,受到了广泛的关注[1,4-5].人类活动的干扰如灭菌剂使用、农业活动等,会直接或间接抑制植物与土壤微生物的共生,导致共生关系的破坏(mutualism disruption)[6-9].但是干扰导致的共生关系的破坏如何影响植物种间竞争及其机制仍不明确.
许多研究通过接种菌剂的方式,考察共生微生物对植物生长及种间竞争的影响[5,10].以丛枝菌根真菌(AMF)的研究为例: 植物能够与多种丛枝菌根真菌同时形成共生关系,而不同的丛枝菌根真菌对同一植物的促进作用不同,导致丛枝菌根真菌对植物种间竞争的影响往往与其菌种有关[11-12].故这类研究结果并不能完全预测野外条件下干扰导致的共生作用破坏对植物种间竞争与入侵的影响.
干扰导致的共生作用破坏对外来和本地植物之间竞争的影响尤其需要重视.外来生物入侵的重点区域往往是受人类活动干扰程度较高的地区,而干扰强度较高的区域往往存在一定程度的共生微生物的缺失,这暗示着干扰区域中共生微生物的缺失可能与外来植物的成功入侵存在一定的关联[13-14].了解干扰导致的共生作用破坏对植物生长与种间竞争影响,不仅有助于我们更好地评估人类活动对群落动态的影响,还在入侵植物的预防、治理及相关的生态修复过程中具有重要的实践意义[15].
不同植物对共生微生物的依赖性不同,因而在对共生关系破坏的响应模式上也不完全一致.例如,根瘤菌的缺失对豆科植物的影响明显大于其他植物;环境中菌根真菌的缺失对专性菌根植物造成的限制较强,而对兼性菌根植物的影响相对较弱[16].植物对共生微生物的依赖性还与植物的功能性状有关.例如根适合度(root fitness)较低(如根冠比较低)的植物对菌根真菌的依赖性可能更强[17-18],这些植物的性状对菌根真菌的缺失也可能表现出更强烈的响应.根冠比等性状对环境变化的响应可能在一定程度上决定其与邻体植物间的竞争结果.例如,研究表明提高生物量向地上部分的分配有利于植物在光竞争中获得优势[19].因此,探究植物功能性状对共生微生物缺失的响应,有助于揭示干扰导致的共生关系破坏影响植物种间竞争的机制.
本研究使用苯菌灵抑制植物与土壤微生物之间的共生作用,选择入侵植物加拿大一枝黄花(Solidagocanadensis)与土著植物野大豆(Glycinesoja)为研究对象,以探究干扰导致的共生关系破坏对两种植物种间竞争的影响及其可能的生态学后果.苯菌灵是一类内吸式广谱杀真菌剂,在植物体内分解为多菌灵与异氰酸丁酯,能够有效抑制真菌细胞的分裂及菌丝的侵染,且对植物本身并无影响[20].苯菌灵主要影响菌根真菌及部分子囊菌纲、半知菌纲及某些担子菌纲的真菌[20].尽管苯菌灵在作用于菌根真菌[14]的同时也会对土壤病原菌等产生影响,但这种影响较弱[20].研究表明,野外条件下,苯菌灵对植物与菌根真菌间共生作用的抑制是其影响植物群落结构的主要途径[14,21-22].因此,施加苯菌灵仍是目前野外条件下最合适、也是最常用的控制植物-菌根真菌共生作用的方法[23].加拿大一枝黄花原产于北美,在1935年被作为庭院植物传入我国,后逸生野外成为一种恶性杂草[24].野大豆是广泛分布于我国各地的本地种,其在野外常缠绕生长于加拿大一枝黄花之上,与加拿大一枝黄花形成竞争关系.两种植物均与丛枝菌根真菌形成共生关系[25-27].此外,野大豆与根瘤菌之间也存在着共生作用[27].已有研究表明,菌根真菌能提高加拿大一枝黄花与野大豆的营养获取能力、光合作用能力和对非生物胁迫的耐受能力等[25-27],暗示着共生关系破坏可能对加拿大一枝黄花与野大豆的生长造成抑制作用.共生关系破坏对加拿大一枝黄花与本地植物竞争结果的影响,在一定程度上取决于两种植物在对共生作用破坏响应上的差异.在本研究中,我们利用野大豆的缠绕特性,区分了植物的地上、地下竞争,以更好地了解植物种间相互作用对共生关系破坏的响应及其机制.
1 材料与方法
1.1 土壤的准备
栽培使用的园土,于2017年12月取自复旦大学江湾校区旺溪植物园,该地点同时有加拿大一枝黄花和野大豆分布.挖取地表30cm的根际土壤,翻晒过筛后将土壤充分混匀,分装至花盆中,每只花盆内装1.6kg的土壤.
1.2 植物材料的准备
加拿大一枝黄花的根状茎挖取自复旦大学旺溪植物园.选取直径约5mm的根状茎,剪成长5cm的根段,于温室中培养至芽点萌发,当幼苗长至4cm高时挑选大小一致的个体进行移栽.野大豆种子产自山东东营,在培养箱中萌发至第一对真叶展开后移栽.
1.3 野大豆与加拿大一枝黄花的种间竞争
野大豆与加拿大一枝黄花的种间竞争设置如图1所示.
共有4种竞争模式: (1) 无竞争组: 野大豆与加拿大一枝黄花的单种,密度为1株植物/盆;(2) 地下竞争: 野大豆与加拿大一枝黄花栽种于同一花盆中,牵引野大豆的地上部分至花盆外,从而避免植物的地上竞争、仅保留地下竞争.密度为1株加拿大一枝黄花+1株野大豆;(3) 地上竞争: 野大豆与加拿大一枝黄花分别栽种于两个花盆中,将野大豆地上部分牵引至加拿大一枝黄花之上,形成地上竞争、避免地下竞争.密度为1株加拿大一枝黄花+1株野大豆;(4) 全竞争: 野大豆与加拿大一枝黄花栽种于同一花盆中,将野大豆的地上部分牵引至加拿大一枝黄花之上,同时形成地上竞争与地下竞争,密度为1株加拿大一枝黄花+1株野大豆.每种竞争处理设置灭菌组与未灭菌组,每组设5个重复,共计60盆、80株植物.实验在温室中进行,每2周随机移动一次花盆位置,以排除位置效应造成的差异.
1.4 苯菌灵处理
本研究通过添加苯菌灵抑制植物与土壤微生物的共生作用.选用蓝丰生化50%苯菌灵可湿性粉剂.在植物生长的过程中,每隔2周对苯菌灵处理组的植物施加100mL苯菌灵溶液,浓度为1g/L,苯菌灵溶液现配现用.
1.5 植物的收获
植物种植于2018年1月,收获于2018年5月.植物收获后,用自来水将地上部分洗净,并分为以下3个部分: (1) 植物中段完全展开的叶片(选取5~10片),使用叶面积仪(LI-3050C)测量植物的叶面积,烘干称重后用于计算植物的比叶面积(叶面积/叶生物量).(2) 剩余的叶片、未展开的叶片与芽;(3) 植物的茎.植物的根系洗净后,挑选出部分根系用于测定菌根真菌侵染率(见1.6).将植物各部分放入65℃的烘箱中烘干72h,测定植物各部分的生物量.其中,野大豆的繁殖生物量为野大豆的豆荚与种子的生物量之和;植物的根冠比为植物地下生物量/地上生物量;总叶面积为比叶面积×叶片总生物量;叶根比为植物总叶面积/地下生物量.
1.6 菌根真菌侵染率的测定
对每株植物,选取直径<1mm的一级侧根,剪成1.5cm左右的根段,共计50个根段.为了更好地观察菌根真菌,使用墨水醋染色法染色[29].加拿大一枝黄花与野大豆均为丛枝菌根植物,墨水醋染色方法能对丛枝菌根真菌的丛枝、泡囊等结构染色,而不对病原真菌等微生物染色[30].此外,为了更精确地比较植物菌根侵染率的差异,本文在放大交叉法[31]与侵染率分级强度法[32]的基础上略作改进.具体操作为: 将植物的根段置于1mm×1mm的网格上,使用尼康CF160光学显微镜,在200倍下观察根段与网格相交处的菌根真菌侵染情况,每份根系样品共观察400~500个交点.将相交处的侵染率分为0%,1%,(1,10%),[10%,50%),50%,(50%,90%],(90%,100%],共7个区间等级(分级标准见图2).其中,当无法确定侵染率<50%或>50%时,将侵染率记为50%.判断相交处的菌根侵染情况的等级,统计每个等级下的交点数量,记为N0,N1,N2,N3,N4,N5,N6,按以下公式计算菌根真菌侵染率:

其中,交点数量(N0~N6)前的系数代表该等级的平均侵染率.如,用30%代表[10%,50%)这一等级的侵染率.
1.7 竞争系数的计算
根据以下公式计算种间竞争条件下的竞争系数[33]:
加拿大一枝黄花相对产量=lg(Wcb/Wcc),
野大豆相对产量=lg(Wbc/Wbb),
竞争强度指数=(Wbb+Wcc)/(Wbc+Wcb)-1,

其中:Wcc为单独种植时加拿大一枝黄花的干重,Wbb为单独种植时野大豆的干重,Wcb为混合种植时加拿大一枝黄花的干重,Wbc为混合种植时野大豆的干重.加拿大一枝黄花与野大豆相对产量>0则表示竞争促进了植物的生长,加拿大一枝黄花与野大豆相对产量<0则表示竞争抑制了植物的生长;竞争强度指数越高表示植物的种间竞争越强;竞争平衡指数增高表明加拿大一枝黄花的竞争能力增强而野大豆的竞争能力减弱[33].
1.8 数据分析
利用R 3.2.2进行数据分析与作图.使用Shapiro.test对数据先进行正态性检验、使用leveneTest进行方差齐性检验.所有数据满足正态性与方差齐性之后,使用完全随机两因素方差分析,然后使用LSD检验进行多重比较,比较加拿大一枝黄花与野大豆的生长性状对苯菌灵添加的响应、竞争系数对苯菌灵添加的响应.
2 结 果
2.1 苯菌灵添加对共生微生物的影响
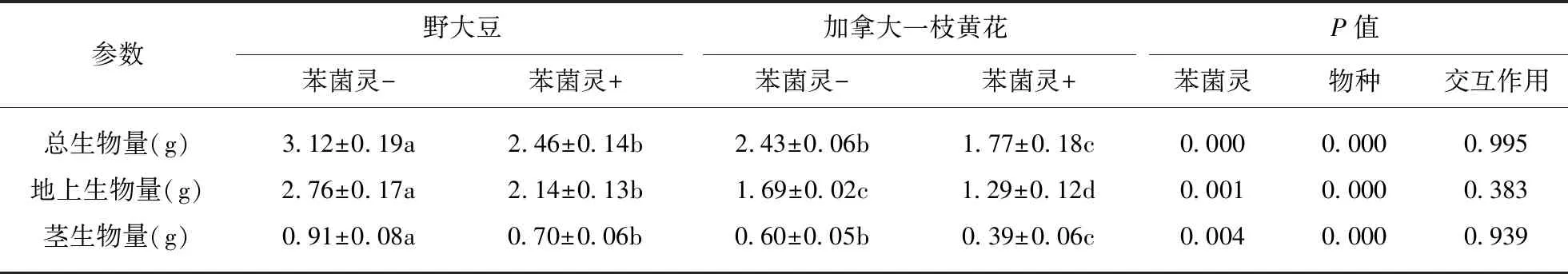
苯菌灵添加使野大豆与加拿大一枝黄花的菌根真菌侵染率分别下降25%与28%(图3(a),P<0.001),有效抑制了植物与丛枝菌根真菌的共生作用.且添加苯菌灵前后,野大豆的菌根真菌侵染率均显著高于加拿大一枝黄花(图3(a),P<0.001).苯菌灵的添加使野大豆的根瘤生物量下降58%(表1,P<0.001).
2.2 植物性状对苯菌灵添加的响应
单种条件下,苯菌灵添加使野大豆与加拿大一枝黄花总生物量显著下降(图3(b),P<0.001),但是两种植物的生物量下降程度无显著差异(表1).添加苯菌灵前后,野大豆的总生物量均高于加拿大一枝黄花(图3(b),P<0.001).
参数野大豆加拿大一枝黄花P值苯菌灵-苯菌灵+苯菌灵-苯菌灵+苯菌灵物种交互作用总生物量(g)3.12±0.19a2.46±0.14b2.43±0.06b1.77±0.18c0.0000.0000.995地上生物量(g)2.76±0.17a2.14±0.13b1.69±0.02c1.29±0.12d0.0010.0000.383茎生物量(g)0.91±0.08a0.70±0.06b0.60±0.05b0.39±0.06c0.0040.0000.939
(续表)
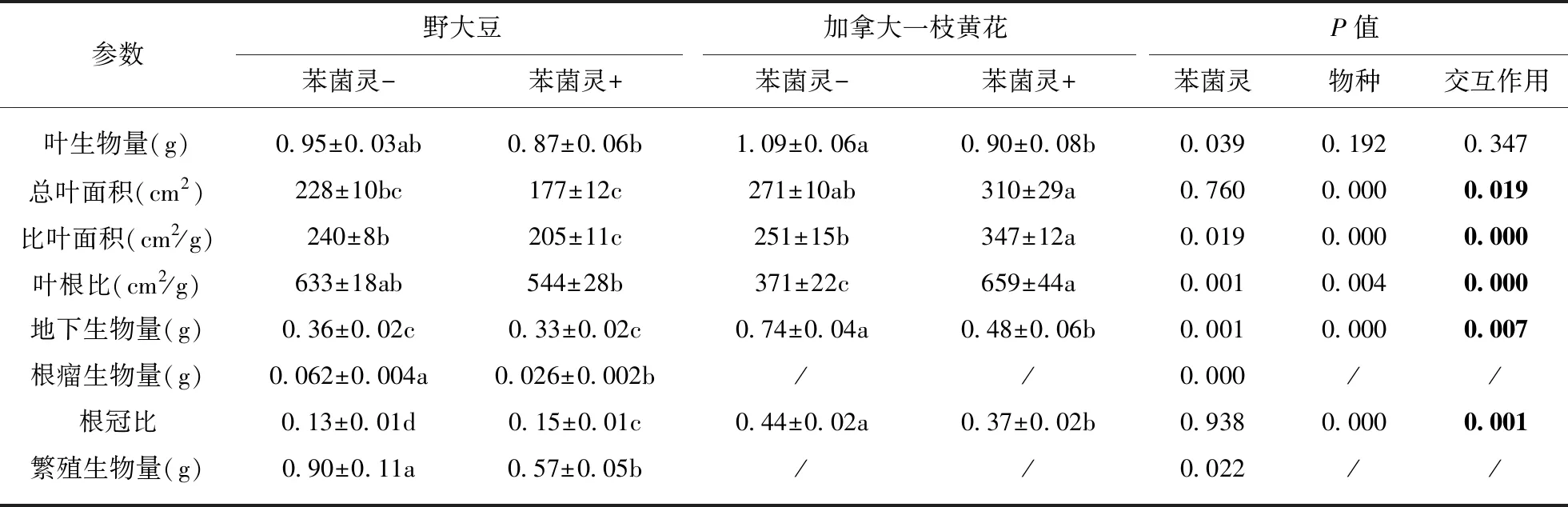
比较野大豆与加拿大一枝黄花的生物量分配策略,由表1可知: 未添加苯菌灵时,野大豆的总生物量、地上生物量、茎生物量、叶根比均大于加拿大一枝黄花(表1,P<0.001);而野大豆的总叶面积、比叶面积、根生物量与根冠比均小于加拿大一枝黄花(表1,P<0.001).进一步比较单种条件下,苯菌灵添加对野大豆与加拿大一枝黄花生长的影响.由表1可知,苯菌灵添加降低了野大豆与加拿大一枝黄花的地上生物量、茎生物量与叶生物量(P<0.05).
但是两种植物的总叶面积、比叶面积、叶根比、地下生物量与根冠比对苯菌灵添加的响应不同(P<0.05).添加苯菌灵后,野大豆的总叶面积下降22%,比叶面积降低15%,叶根比下降14%,地下生物量无显著变化,根冠比上升18%.而加拿大一枝黄花总叶面积上升15%,比叶面积上升38%,叶根比上升78%,地下生物量下降35%,根冠比下降15%.此外,苯菌灵添加后,野大豆繁殖生物量(豆荚与种子)下降37%.
2.3 苯菌灵添加对植物种间竞争的影响
由图4(a)、图4(b)可知,添加苯菌灵之前,地下竞争使加拿大一枝黄花与野大豆相对产量显著下降,而地上竞争并没有影响两种植物的相对产量.地上竞争情况下,添加苯菌灵对加拿大一枝黄花相对产量无显著影响;地下竞争情况下,添加苯菌灵使加拿大一枝黄花相对产量显著上升(P<0.001).而苯菌灵添加并未影响野大豆的相对产量(图4(b)).从竞争强度指数看,野大豆与加拿大一枝黄花的地下竞争强于地上竞争,苯菌灵添加显著降低了植物的种间竞争强度.苯菌灵添加改变了野大豆与加拿大一枝黄花的种间竞争平衡.仅存在地上竞争时,苯菌灵添加并未改变植物的种间竞争平衡,当存在地下竞争时,苯菌灵添加改变了野大豆与加拿大一枝黄花的种间竞争平衡,使野大豆竞争能力减弱而加拿大一枝黄花竞争能力增强.
3 讨 论
干扰导致植物-土壤微生物共生关系减弱的现象已被广泛报道[6-9],但共生作用破坏对植物种间竞争的影响及其机制仍不明确.我们的研究发现,虽然单种情况下,苯菌灵的添加对野大豆与加拿大一枝黄花生物量的影响程度无显著差异(分别下降21%与27%),但是苯菌灵添加后野大豆与加拿大一枝黄花的竞争平衡发生变化.这可能是由于苯菌灵抑制了植物与土壤微生物的互利共生,导致不同植物的生物量分配策略发生不同的变化[17-18],主要表现为野大豆叶根比下降,而加拿大一枝黄花叶根比上升;从而提高了加拿大一枝黄花的竞争能力而降低了野大豆的竞争能力.本研究结果表明,植物生长对共生作用破坏的响应存在明显的种间差异,这种差异可能是部分植物在干扰生境下表现出相对竞争优势的原因[19].
3.1 苯菌灵添加对土壤共生微生物的影响
菌根真菌与根瘤菌是植物群落动态的重要驱动因子[1],也是存在于加拿大一枝黄花与野大豆根际最主要的共生微生物[26-27].苯菌灵的添加显著降低了植物的菌根真菌侵染率,并降低了野大豆的根瘤生物量,破坏了植物与其共生微生物之间的共生关系(图3,表1).虽然苯菌灵的生物毒性可能会对土壤中的病原真菌或是线虫造成不利影响,从而促进植物的生长[23],但是本实验中,苯菌灵的添加显著降低了单种条件下野大豆与加拿大一枝黄花的生物量(图4).苯菌灵添加对两种植物生长的抑制说明苯菌灵添加对植物-共生微生物关系的作用要显著强于其对植物-病原真菌关系的影响[23].需要指出的是,尽管本研究结果间接表明了苯菌灵主要影响植物与土壤中有益微生物的共生作用,我们仍推荐后续研究结合高通量测序或PLFA等分子检测技术[34-35],以便更直接地证实这一推断.
3.2 苯菌灵干扰对植物生长与种间竞争的影响
植物会依据自身对地上资源与地下资源的需求,改变地上、地下部分的生物量分配[33,36-37].例如,当土壤的水分、养分条件下降时,植物的根冠比上升;当光照强度降低时,植物的根冠比下降[19,33].由于地下竞争影响植物的生物量大小[36],而地上竞争导致植物个体大小的不等性[19,37],因此植物的根冠比变化往往会导致植物群落组成的变化[19,37].以往研究表明,施肥能够降低地下资源对植物生长的限制,导致植物的根冠比降低,加剧植物间的地上竞争(非对称竞争),从而降低植物群落的多样性[19,38].
共生微生物能够提高植物对土壤养分的吸收,其效果与施肥类似[3].而苯菌灵的干扰破坏了植物与土壤微生物的共生作用,并影响了植物的种间竞争平衡,使加拿大一枝黄花的竞争优势上升而野大豆的竞争优势下降.由于单种条件下,苯菌灵添加对两种植物生物量的影响程度无显著差异(图4,表1),但是两种植物的生物量分配策略对苯菌灵干扰的响应不同.因此,我们推断本研究中,苯菌灵并非通过抑制植物的生长直接影响植物的种间竞争,而是通过抑制共生作用改变了植物的营养获取方式,这进一步影响了植物的生物量分配及植物的地上、地下竞争能力,间接改变了植物的种间竞争平衡[19,38-39].
本研究中,苯菌灵添加使野大豆的根冠比上升、叶根比无显著变化(表1);而加拿大一枝黄花的根冠比降低、叶根比上升(表1).这种差异或与两种植物的生长习性及其菌根依赖性有关.野大豆作为一类攀缘植物,无法直立生长,为了满足自身对光照的需求,其生物量多往地上分配,导致根冠比较低[33,40].而根冠比越低的植物对共生微生物的依赖性往往越强[17].菌根真菌及根瘤菌提高了野大豆对N、P等矿质营养的吸收、取代了部分的根系作用,使其维持较低的根冠比,有利于植物的地上竞争[17,41].当共生作用遭到抑制后,野大豆需要更多地依赖自身的根系吸收土壤中的矿质营养,因此采取了保留根系生物量、牺牲地上生物量的策略,表现出总叶面积及叶根比下降、根冠比上升的响应特征[17,41-42].与野大豆不同,加拿大一枝黄花的根系发达,对于共生破坏的适应性更高[18,28].其根状茎除了具有吸收功能外,还具有贮藏、繁殖功能[28].菌根真菌的存在会消耗宿主植物的部分光合产物,菌根侵染率的降低可以减少植物的光合产物分配到根系中的比例[28];此外,随着菌根真菌侵染率的降低,植物获取资源的能力也降低,植物由营养繁殖转向有性繁殖,根系贮藏物质减少,根冠比降低[43-44].
仅存在地上竞争时,苯菌灵添加并未影响野大豆与加拿大一枝黄花的竞争强度与竞争平衡(图4),这似乎与基于生物量分配策略的推断不符.可能是由于本研究中植物的种植密度低,地上竞争强度也低,而植物对地上竞争的响应有时是以其地下竞争的强度为条件的[36,45-46],因此仅存在地上竞争时,苯菌灵添加未改变植物的竞争平衡.
仅存在地下竞争时,苯菌灵的添加降低了加拿大一枝黄花与野大豆的地下竞争强度,这与以往的研究结果一致[26,28,41],说明共生作用破坏后,植物的生长受到抑制,导致竞争强度下降.此外,苯菌灵添加后,加拿大一枝黄花相对产量增加而野大豆相对产量无显著变化,这与竞争平衡指数的升高相吻合(图4).说明野大豆受苯菌灵干扰的影响更大,对加拿大一枝黄花的竞争效应下降.虽然苯菌灵的干扰对加拿大一枝黄花根生物量的影响更大,但是共生作用破坏后,植物主要依赖自身的根系吸收土壤养分,而野大豆的根系生物量远低于加拿大一枝黄花,其对共生关系破坏的适应性较差[18].因此野大豆对加拿大一枝黄花的竞争效应显著下降,加拿大一枝黄花的相对产量及竞争平衡指数升高.这也侧面表明了野大豆对共生微生物的依赖性更强[16].
在地下竞争的基础上添加地上竞争,加拿大一枝黄花的相对产量与竞争平衡指数继续升高(图4),其中,加拿大一枝黄花的相对产量甚至达到了0.1,出现了超产,导致植物的竞争平衡发生显著改变.这可能由以下两方面因素导致: (1) 植物与豆科植物的套种往往能够导致超产[33].虽然苯菌灵的添加抑制了根瘤的生长,但并非完全杀死根瘤菌,残留的根瘤菌依然能够提高土壤中的N含量,从而促进植物的生长.(2) 两种植物的生物量分配策略对苯菌灵添加的响应不同,野大豆通过牺牲地上部分以保障地下部分对养分的吸收,根冠比上升;而加拿大一枝黄花则是保留地上部分,根冠比下降.这意味着苯菌灵对野大豆地上竞争能力的影响更大.由于地上竞争与地下竞争的加性效应[33,46],这进一步降低了野大豆的总生物量,此消彼长,加拿大一枝黄花的相对产量上升.研究表明,相较于地下竞争,地上竞争通过影响植物个体大小的不等性、对植物种间竞争的影响更大[37].本研究的结果亦再次证实,地上竞争对植物种间竞争平衡的影响大于地下竞争,不过这种影响需要以地下竞争作为前提.
4 总 结
灭菌剂的施用及其他环境干扰能直接或间接破坏植物与菌根真菌及其他土壤微生物的共生作用,而不同的植物对共生微生物的依赖性不同,对这类干扰的响应也不同,这势必影响植物在种间竞争中的表现.本研究结果表明,虽然单种条件下,苯菌灵对加拿大一枝黄花与野大豆生物量的影响程度无显著差异,但是在种间竞争条件下,土著植物野大豆受到的影响更大.苯菌灵能够降低土著植物野大豆对加拿大一枝黄花的竞争优势,间接促进了加拿大一枝黄花的入侵.本研究不仅揭示了共生作用破坏影响植物种间竞争的机制,还对于入侵植物的管理具有一定的指导意义.我们的结果意味着,在未来的生产实践中,需要重视农药残留及其他人类活动对土壤微生物的干扰、加强对农业弃耕地及其他干扰后生境的重视与监控,预防外来植物的入侵与定殖.此外,若要从共生微生物的角度控制入侵植物,则需要结合入侵植物、土著植物对共生微生物的依赖性及具体的环境条件进行分析[47].
