新型环烯烃聚合物微流控芯片的设计及其在大肠埃希菌O157:H7 快速检测中的应用
2020-03-22高菊逸吴传安杨伟康罗裕旋刘胜楠徐小平
高菊逸,吴传安,杨伟康,罗裕旋,刘胜楠,徐小平
(1.深圳市龙华区妇幼保健院,广东 深圳 518110;2.香港大学深圳医院,广东 深圳 518053)
大肠埃希菌O157:H7是大肠埃希菌中可引起人类发病最多的血清型之一,可从牛肉或牛奶等食物中被分离到,主要引起人的出血性结肠炎和溶血性尿毒综合征,病死率较高[1-4]。因此,该菌在食品安全等方面具有重要的研究价值。本研究利用微流控芯片技术建立了一种快速检测大肠埃希菌O157:H7的技术平台,具有耗材成本低、操作简便、检测时间短、灵敏度高等优点。
1 材料和方法
1.1 微流控芯片设计及制作
取25μmOCA光学透明胶,利用计算机辅助软件(Pro/Engineer)设计的长160 μm、宽40 μm的流体通道,采用激光雕刻技术切出设计图形(图1)。将合适尺寸的环烯烃聚合物(cycloolefin polymer,COP)与OCA光学透明胶一同放入O2等离子进行清洗(100 mW,1% O2,60 s)后取出,用OCA光学透明胶将上、下2层COP进行不可逆键合,放入80 ℃烤箱烘烤10 min。芯片制作完成后,将可食用性染料通入芯片,用于验证芯片的实用性(图2)。

图1 微流控芯片设计图

图2 微流控芯片实物图
1.2 芯片检测区域表面修饰和抗体固定
通过注射泵控制反应通道内反应液的流动,采用巯基-马来酰亚胺基团硅烷化偶联法,对反应检测区进行表面修饰和抗体固定[5-7]。具体步骤为:用注射泵往通道中通入5 μL 3-巯基丙基三甲氧基硅烷(3-methyl propyl trimethoxy silane,MPTS)(5%,溶于无水乙醇溶液),5 μL N-(4-马来酰亚胺丁酰基氧)琥珀酰亚胺(4-maleimidobutyric acid N-hydroxysuccinimide ester,GMBS)
(2 mg/mL,溶于二甲亚砜溶液),分别在室温下反应1 h和30 min,反应后用无水乙醇和磷酸盐缓冲液(phosphate-buffered saline,PBS)清洗。清洗后,通入5 μL链霉亲和素溶液(1 mg/mL,溶于PBS),室温下反应1 h。PBS清洗后,通入5 μL生物素标记羊抗O157:H7大肠埃希菌菌体抗原抗体(单抗,美国KPL公司)(10 μg/mL,溶于含1%牛血清白蛋白的PBS)(图3),室温下反应30 min后冲洗备用。
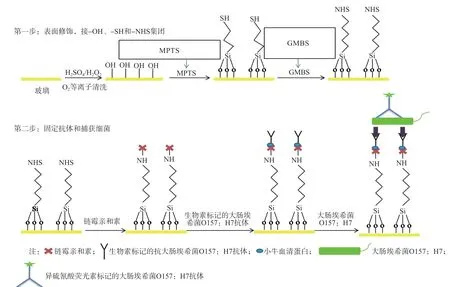
图3 芯片内表面修饰
1.3 菌株来源及样本制备
1.3.1 菌株来源 大肠埃希菌O157:H7菌株(深圳市疾病预防控制中心),大肠埃希菌(ATCC 25922)、伤寒沙门菌(ATCC 14028)(香港大学深圳医院微生物科),大肠埃希菌O157:H7显色培养基(法国科玛嘉公司),EC肉汤培养基(广东环凯公司)。
1.3.2 样本制备 取接种了大肠埃希菌O157:H7并过夜培养后的营养肉汤菌悬液0.2 mL,加入无菌0.9%氯化钠溶液,调成浓度为1.6×107CFU/mL的初始菌液(经平板菌落计数确定浓度),10倍稀释至1.6×101CFU/mL,每个浓度各取1 mL菌液于沸水中煮15 min灭活,离心备用。大肠埃希菌(ATCC 25922)和伤寒沙门菌(ATCC 14028)也分别按上述方法进行培养并计数,制成1×107CFU/mL的菌悬液,离心备用。阴性对照为高压灭菌的PBS缓冲液,阳性对照(自制)为经荧光染料V3染色的大肠埃希菌O157:H7菌液(浓度为1×106CFU/mL)。
1.4 确定最佳进样流速和进样时间
采用注射泵分别以0.5、1.0、3.0、5.0 μL/min的速度往芯片内通入阳性对照液,每隔5 min记录1次荧光信号值,直至60 min。当进样速度为0.5 μL/min时,芯片反应区内的荧光信号强度可达到最高,到达最高值需要1 h;当进样速度为1.0 μL/min时,芯片反应区内的最高荧光信号强度比0.5 μL/min时略低,达到最高值需要30 min;随着进样速度的加快,反应区内的荧光信号强度达到最高值的时间也逐渐缩短,但荧光信号最高值也逐渐下降。因此,后续试验选择1.0 μL/min和30 min为最佳进样速度和反应时间。见图4。

图4 反应条件优化结果
1.5 样本的检测
采用注射泵将待测样本及阴、阳性对照液各30 μL以最佳进样速度从通道通入芯片内。反应30 min后,以PBS冲洗,再以最佳进样速度从通道通入5 μL异硫氰酸荧光素标记羊抗大肠埃希菌O157:H7菌体抗原单克隆抗体(50 μg/mL,溶于含1%牛血清白蛋白的PBS)。反应30 min并冲洗后,将芯片置于倒置荧光显微镜下观察检测区域内的荧光,并用电荷耦合器件(charge coupled device,CCD)拍照记录(20倍,曝光时间1.25 s),最后用Image-Pro Plus 5.0软件分析各检测区域的荧光信号。荧光信号强度高于阴性对照荧光值+3s者为阳性,反之为阴性[8],其中阴性对照荧光值为465~495。
1.6 确定检测灵敏度和特异性
分别取1×107、1×106、1×105、1×104、1×103、1×102CFU/mL的大肠埃希菌O157:H7菌液,并以0.9%氯化钠溶液做阴性对照,以最佳进样速度通入芯片内进行检测,采用SPSS 13.0软件对结果进行统计学分析,通过独立样本t检验结果确定新型微流控芯片的最低检测限,即灵敏度。
分别取1×107、1×106、1×105、1×104、1×103、1×102CFU/mL的大肠埃希菌(ATCC 25922)及伤寒沙门菌(ATCC 14028)菌液进行检测,观察检测结果,确定特异性。
2 结果
2.1 新型COP微流控芯片的优势
本研究采用激光雕刻机为加工仪器、以OCA光学透明胶为主要材料制作的微流控芯片,与采用光刻机制作的微流控芯片相比,具有制作过程简单、制作速度快、成本低、环保、节能等优点。芯片的制作只需1 min即可完成,而且采用的仪器价格低廉、便于携带,对试验环境、人员要求低,适合院外或床旁检测。临床上传统的细菌检测一般需要48~72 h,而这种新型的技术只需30 min~1 h即可完成检测,样本和试剂用量少、不需大型设备、费用低廉。
2.2 检测限
分别检测大肠埃希菌O157:H7菌液和对照液,每个浓度平行测定3次。微流控芯片检测区域内的荧光信号强度随着大肠埃希菌O157:H7菌液浓度的递增而逐渐增强,形成1个S形曲线,而阴性对照组荧光信号强度保持在极低的水平。以细菌浓度对数值(CFU/mL)为横坐标,以荧光信号对数值为纵坐标,得到浓度反应曲线。根据最低检测限为荧光信号强度高于阴性对照荧光值+3s者的样本浓度[9],确定本方法对大肠埃希菌O157:H7的检测限为1×103CFU/mL。见图5。
2.3 特异性
取浓度为1×107CFU/mL 的大肠埃希菌O157:H7、大肠埃希菌(ATCC 25922)和伤寒沙门菌(ATCC 14028)菌液各30 μL,每个样本平行测定3次。在通入相同浓度的菌液后,大肠埃希菌O157:H7的荧光信号强度比通入大肠埃希菌(ATCC 25922)及伤寒沙门菌(ATCC 14028)的荧光信号强度高出3个数量级,荧光信号对数值差异具有统计学意义(t=5.324,P<0.01),表明此方法对大肠埃希菌O157:H7的检测具有很高的特异性。见图5。

图5 微流控芯片检测大肠埃希菌O157:H7的灵敏度和特异性
2.4 可重复性
取浓度为1×106CFU/mL的大肠埃希菌O157:H7菌液,分为10份,按上述方法进行检测。结果显示,同批检测的精密度(以相对标准偏差表示)为5.2%,表明此方法具有较好的可重复性。
2.5 模拟临床样本的检测
取100份正常人临床粪便样本,挑取少量样本制成粪便悬液样本,加入已知浓度的大肠埃希菌O157:H7,配置成含不同浓度大肠埃希菌O157:H7(1×103~1×106CFU/mL)的阳性样本50份,及不含大肠埃希菌O157:H7的阴性样本50份。700×g离心15 s后用纱布过滤,每份样本都同时以微流控芯片法和培养法进行检测,最后计算出微流控芯片法的敏感性、特异性及2种方法的符合率。培养法参照《全国肠出血性大肠埃希菌O157:H7感染性腹泻监测方案》[10]进行检测和鉴定。结果显示,微流控芯片法检测粪便样本中大肠埃希菌O157:H7的敏感性为90%,特异性为100%,二者符合率达95%。见表1。
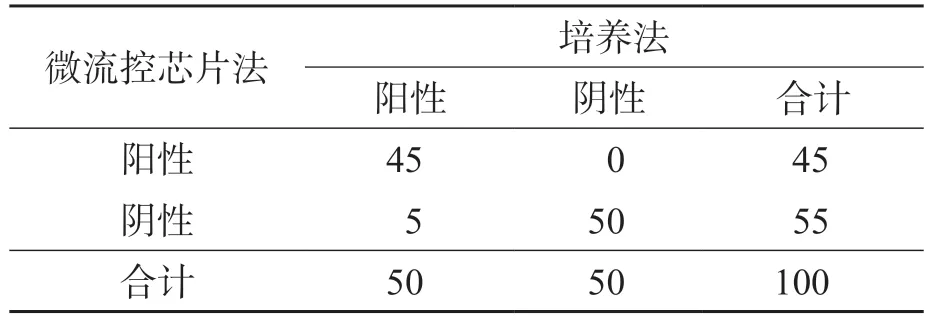
表1 2种方法检测结果比较 份
3 讨论
微流控芯片技术是目前生物化学、药物、化学合成及临床诊断等领域的重要研究内容。但随着研究的不断深入,微流控芯片技术的发展也逐渐暴露出一些问题,如系统操作复杂、相关研究力量薄弱、对技术人员要求高、制作工艺局限性大等。为了实现技术上的突破,本研究团队前期研究通过双面黏性薄膜微流控芯片实现了对循环肿瘤细胞的捕获,对乳腺肿瘤细胞的捕获率为(92±3)%,证明这种材料制作的微流控芯片在实际应用中是可行的,可大大降低人力和物力成本。本研究采用OCA光学透明胶和COP研制的新型塑料微流控芯片,进一步提高了材料的选用标准,可在管道中增加结构,提高芯片的检测范围,再结合表面修饰技术和免疫荧光技术,大大降低了技术成本,其中表面修饰固定抗体环节还利用等离子清洗等工序,使得检测系统的灵敏度有了更好的保障。
本研究建立的COP微流控芯片系统只需30 min~1 h即可完成检测,不需大型设备,样本和试剂用量少,且低碳、环保,对大肠埃希菌O157:H7的检测限为1×103CFU/mL。经模拟实验验证,此法检测敏感性为90%,特异性为100%,与李永新等[11]采用微流控芯片-激光诱导荧光快速检测大肠埃希菌O157:H7的检测限相近,但本研究的芯片制作过程简单、速度快、成本低,更适合用于院外及床旁检测。此外,该微流控芯片不仅可用于检测同一种病原菌,还可以采用多通道同时检测多种病原菌,可作为疾病早期对病原菌的快速筛查方法,对临床快速获得病原菌信息,制定个性化治疗方案具有重要意义。
