非靶向脂质组学在子痫前期预测中的应用
2020-03-22赵晟隆张春红刘京瑞翟燕红刘晓巍
曹 正 ,董 莹,赵晟隆,王 晶,张春红,陈 陆,刘京瑞,沈 敏,翟燕红,刘晓巍
(1.首都医科大学附属北京妇产医院检验科,北京 100026;2.美康生物参考实验室,浙江 宁波 315104;3.首都医科大学附属北京妇产医院围产医学部,北京 100026)
子痫前期是妊娠2 0 周后以高血压和蛋白尿为主要临床特征的妊娠期疾病,发病率为3%~5%,每年在全世界范围内导致超过500 000例胎儿或新生儿以及70 000例孕产妇死亡[1-2]。子痫前期的发病机制至今尚未完全阐明,胎盘缺血、子宫螺旋动脉重铸不足、可溶性FMS样酪氨酸激酶-1(soluble fms-like tyrosine kinase-1,sFlt-1)和可溶性内皮素(soluble endoglin,sEng)释放入血导致高血压和蛋白尿的发生发展、氧化应激产生的活性氧引起血管内皮细胞损伤、蛋白多糖和透明质酸结构改变介导母胎界面功能障碍以及全身炎症反应如胎盘、肾脏、白细胞过表达Toll样受体4导致炎症因子释放和胎盘、肾脏功能障碍等机制可能与子痫前期的发生有关[1,3]。子痫前期唯一有效的治疗方法是终止妊娠。低分子肝素、小剂量阿司匹林、维生素D及钙补充对子痫前期的预防有一定的价值[4-6]。目前常用的一些实验室检查项目,如sFlt-1、胎盘生长因子(placental growth factor,PLGF)、可溶性内皮素、多普勒超声等预测子痫前期的价值较低。有研究结果显示,尽管sFlt-1/PLGF比值对子痫前期的阳性预测率较低,但具有较高的阴性排除价值[7]。寻找准确而可靠的预测子痫前期的生物标志物已成为一个临床亟待解决的问题。
代谢组学是继基因组学、转录组学、蛋白组学后被提出的新兴的组学技术。作为一种高通量的、基于小分子代谢物的组学技术,代谢组学已被广泛用于疾病标志物的研究。代谢产物处于DNA、信使RNA和蛋白质的下游,主要包括核苷酸、醛类、酮类、脂肪酸、氨基酸等。由于代谢组学研究是对实际发生或发生过程的整体代谢状态的反映,因此相较于蛋白组学、基因组学,代谢组学更有利于解释疾病表型和相关临床表现的原因,阐明疾病发生、发展的机制。目前,基于代谢组学的、针对子痫前期预测标志物的研究通常为回顾性研究。有研究结果显示,子痫前期患者血清酰基肉碱水平明显升高,肉碱是将脂质从细胞质运输至线粒体进行能量代谢的载体,其水平升高可能是为了适应大量脂质的氧化代谢,提示子痫前期与脂质代谢紊乱存在密切联系[8-9]。本研究拟应用非靶向脂质组学寻找能早期预测子痫前期的生物标志物,并通过通路分析和富集分析,阐述与子痫前期发病相关的代谢通路。
1 材料和方法
1.1 研究对象
选取2017年8月—2018年2月首都医科大学附属北京妇产医院门诊的子痫前期高危孕妇66例,年龄25~45岁。排除已诊断为子痫前期或HELLP综合征的患者以及在过去3个月中接受过子痫治疗的患者。子痫前期定义为妊娠20周后新发的收缩压≥18.62 kPa(140 mmHg)或舒张压≥11.97 kPa(90 mmHg)(间隔4 h测量),合并出现蛋白尿、24 h尿蛋白定量>300 mg或中段尿尿蛋白定性达“++”[10]。本研究经首都医科大学附属北京妇产医院伦理委员会批准通过,所有对象均知情同意。
1.2 子痫前期高危人群的判断标准[7]
年龄≥18岁,单胎妊娠,孕周为20~36周,且满足以下条件之一:(1)平静时测量血压,收缩压>15.96 kPa(120 mmHg)或舒张压>10.64 kPa(80 mmHg);(2)尿蛋白阳性;(3)上腹部不适;(4)水肿;(5)子宫动脉切迹;(6)胎儿宫内生长受限;(7)体质量增加>1 kg/周;(8)头痛;(9)视力障碍;(10)血小板降低;(11)丙氨酸氨基转移酶和天门冬氨酸氨基转移酶升高。
1.3 试剂和仪器
异丙醇(质谱级)、乙腈(质谱级)、甲酸氨(质谱级)和甲酸(质谱级)购自美国Thermo Fisher公司;Waters 2777C UPLC仪,Water Xevo G2-XS QTOF质谱仪及ACQUITY UPLC CSH C18色谱柱均购自美国Waters公司。
1.4 样本采集和预处理
采用含惰性分离胶的促凝管采集所有对象肘静脉血3 mL,离心分离血清,-80 ℃保存,统一检测。对所有对象进行随访,直至分娩,记录是否发生子痫前期。根据后期是否发生子痫前期将前瞻性队列分为子痫前期组和无子痫前期组(对照组)。由于代谢产物的个体差异较大,因此选取33例子痫前期患者[年龄(30.45±5.39)岁,采血孕周为(34.28±4.83)周]和33例无子痫前期孕妇[年龄(31.53±4.30)岁,采血孕周为(34.28±4.83)周]进行检测,2个组之间年龄和采血孕周差异均无统计学意义(P>0.05)。检测前将血清样本置于室温下充分融解,取40 μL血清,加入120 μL冷异丙醇,震荡混匀1 min,室温下静置10 min,于4 ℃2 000×g离心40 min,吸取25 μL上清液加入225 μL脂质复溶液(异丙醇∶乙腈∶水=2∶1∶1),制备成待测样本。从66份待测样本中各取20 μL,充分混匀,制成1份质控样本。从66例待测样本和1份质控样本中各取60 μL,分别加入96孔板后上机检测。
1.5 样本检测
采用超高效液相色谱(ultra performance liquid chromatography,UPLC)-飞行时间质谱(time-of-flight,TOF)联用技术对样本进行色谱分离和质谱分析。
色谱条件:上样体积为10 μL,色谱柱柱温为55 ℃,流速为0.4 mL/min。流动相A为乙腈(acetonitrile,ACN)∶水=60∶40,含0.1%甲酸和10 mmol/L甲酸铵(即在1 L流动相A中吸去1 mL,加入1 mL纯甲酸,充分混匀后再加入0.63 g甲酸铵固体至完全溶解)。流动相B为异丙醇(iso-propyl alcohol,IPA)∶ACN=90∶10,含0.1%甲酸和10 mmol/L甲酸铵(即在1 L流动相B中吸去1 mL,加入1 mL纯甲酸,充分混匀后再加入0.63 g甲酸铵固体至完全溶解)。梯度洗脱(0~2 min,40%~43%流动相B;2.1~7.0 min,50%~54%流动相B;7.1~13.0 min,70%~99%流动相B;13.1~15.0 min,40%流动相B。
质谱条件:分别采用正、负离子模式采集从色谱柱上洗脱下来的小分子。正离子模式下,毛细管电压和锥孔电压分别为3.0 kV和40.0 V;负离子模式下,毛细管电压及锥孔电压分别为2.0 kV和40.0 V。采用全信息串联质谱模式进行centroid数据采集,正离子一级扫描范围为100~2 000,负离子为50~2 000,扫描时间为0.2 s,对所有母离子按19~45 eV的能量进行碎裂,采集所有碎片的信息,扫描时间为0.2 s。
每隔10份样本检测1次质控样本,用于评估样本检测过程中仪器状态的稳定性。
1.6 统计学方法
将原始检测数据导入 Progenesis QI 2.2软件(美国Waters公司)进行峰对齐、峰提取和归一化。对峰面积数据进行log2转换。采用SIMCA-P13.0软件(瑞典Umetrics公司)对数据进行Pareto scaling缩放调整,随后进行主成分分析(principal component analysis,PCA)和偏最小二乘判别分析(partial least square discriminant analysis,PLS-DA)。根据PLS-DA模型中的变量投影重要性值(variable importance in projection,VIP)对各代谢物变量进行初筛,VIP≥1表示相应的代谢物变量有统计学意义。组间比较采用差异倍数和非参数Wilcoxon秩和检验。以P<0.05为差异有统计学意义。将同时满足VIP≥1、P<0.05和差异倍数≥1.2或≤0.833 3的代谢物作为潜在的生物标志物,基于华大实验室自建数据库和人类代谢组数据库(http://www.hmdb.ca)对筛选出的生物标志物进行定性分析。采用SPSS 21.0软件对VIP排名前5位的生物标志物进行受试者工作特征(receiver operating characteristic,ROC)曲线分析,评价代谢物对子痫前期的诊断价值。
2 结果
2.1 生物标志物的筛选
对子痫前期组和对照组的非靶向脂质代谢数据进行分析。在负离子模式下,PCA图无法区分子痫前期组与对照组;在正离子模式下,PCA图显示子痫前期组与对照组有一定的差异,但差异不明显,见图1。PCA图中质控点高度聚集,说明整个分析过程处于稳定状态。
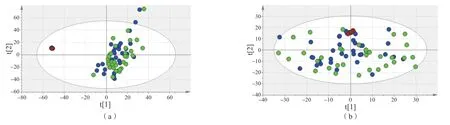
图1 子痫前期组、对照组和质控样本血清非靶向脂质组学PCA图
无论在正离子模式还是负离子模式下,PLS-DA图均能明显区分子痫前期组和对照组,见图2。根据筛选条件(同时满足VIP≥1、P<0.05和差异倍数≥1.2或≤0.833 3),正离子模式下筛选出差异性母离子273种,负离子模式下筛选出135种。根据保留时间和二级离子碎片信息,在正离子模式下筛选出生物标志物139种,负离子模式下筛选出32种。通过代谢通路筛选确定其中42种生物标志物。见表1。
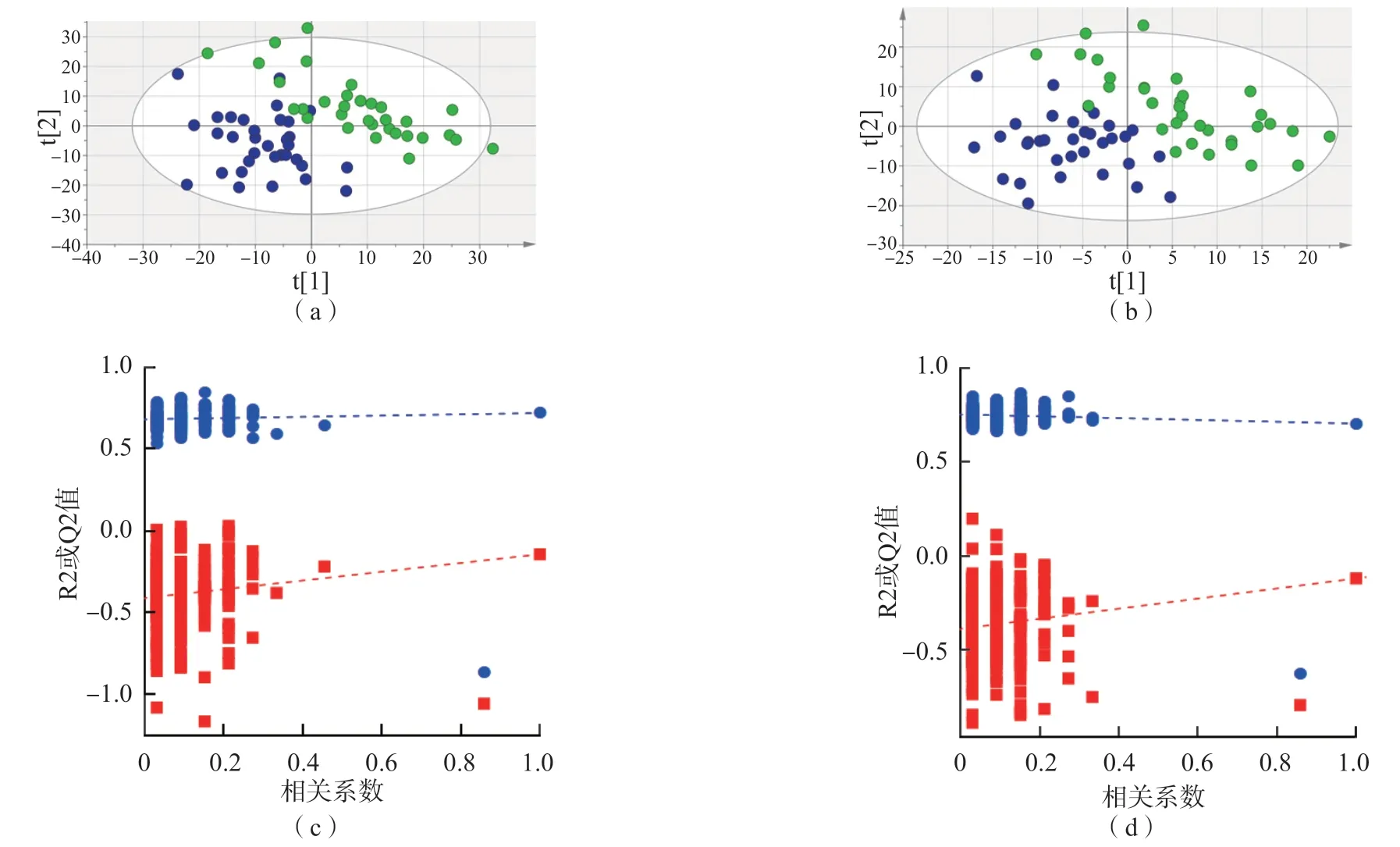
图2 子痫前期组和对照组血清非靶向脂质组学PLS-DA图和置换检验结果
2.2 生物标志物的通路分析和富集
42种代谢物的通路分析和富集分析结果显示,含2种以上生物标志物的代谢通路分别为鞘脂类代谢途径、甘油磷脂代谢途径和初级胆汁酸生物合成途径。见表2。
对通路的富集分析结果显示,这42种生物标志物主要参与α-亚麻酸和亚麻酸代谢、缩醛磷脂合成、长链饱和脂肪酸的线粒体β氧化、鞘脂代谢及胆汁酸生物合成。见图3。
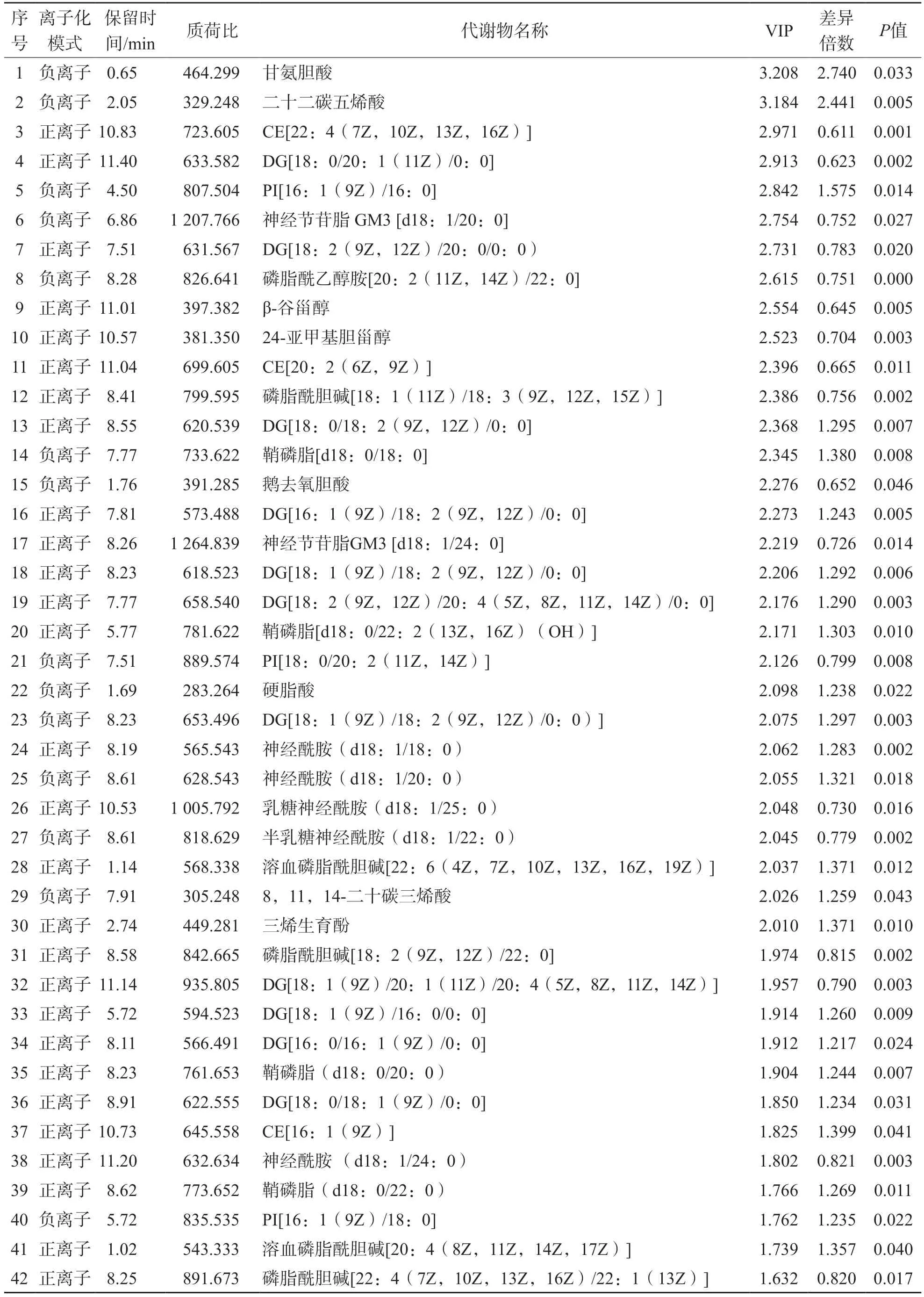
表1 子痫前期组和对照组基于非靶向脂质代谢组学的42种生物标志物

表2 子痫前期组和对照组生物标志物代谢通路分析
2.3 VIP值前5的生物标志物预测子痫前期发病能力比较
VIP值居前5位的生物标志物分别为甘氨胆酸、二十二碳五烯酸、CE[22:4(7Z,10Z,13Z,16Z)]、DG[18:0/20:1(11Z)/0:0]和PI[16:1(9Z)/16:0]。与对照组比较,子痫前期组中甘氨胆酸、二十二碳五烯酸、PI[16:1(9Z)/16:0]水平升高,CE[22:4(7Z,10Z,13Z,16Z)]和DG[18:0/20:1(11Z)/0:0]水平降低。见图4。
ROC曲线分析结果显示,CE[22:4(7Z,10Z,13Z,16Z)]、DG[18:0/20:1(11Z)/0:0]、二十二碳五烯酸、PI[16:1(9Z)/16:0]及甘氨胆酸的ROC曲线下面积(area under curve,AUC)分别为0.723、0.715、0.678、0.669和0.660。见图5、表3。
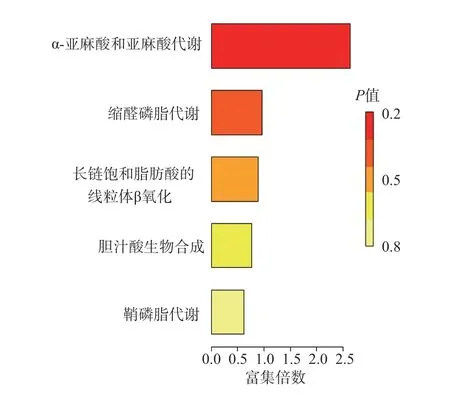
图3 子痫前期组和对照组42种生物标志物通路富集分析结果

图4 子痫前期组和对照组中VIP居前5位的生物标志物的相对峰面积

图5 5种生物标志物诊断子痫前期的ROC曲线
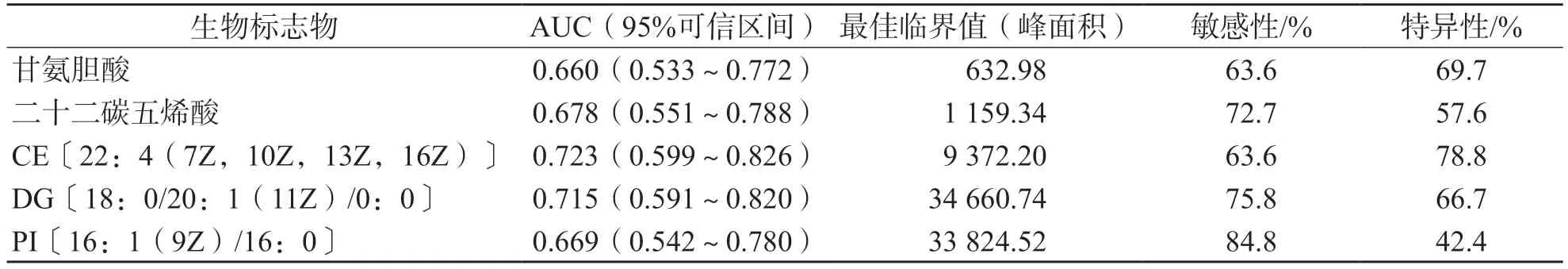
表3 5种生物标志物预测子痫前期发病的效能
3 讨论
目前,代谢组学研究分为2种:代谢物靶标分析和代谢物轮廓分析(也称非靶向代谢组学),前者是对一种或几种目标代谢物进行着重分析,后者是对待测样本进行尽可能多的小分子代谢物检测。当机体受毒性物质、代谢障碍或生理因素影响时,细胞、组织,甚至整体水平会发生代谢的变化应答,导致生物体液中的代谢物种类和浓度发生变化。非靶向代谢组学是基于生物体整体代谢状态的分析方法。本研究采用非靶向脂质组学对脂类进行研究,结果显示脂类和类脂代谢改变能区分子痫前期患者和对照者。通过VIP、P值及差异倍数筛选并定性的42种生物标志物中,VIP居前5位的代谢物中有4种代谢物分别参与了初级胆汁酸生物合成通路、甘油磷脂代谢通路和鞘脂代谢通路,这4种代谢物分别为甘氨胆酸、磷脂酰乙醇胺(20:2/22:0)、磷脂酰胆碱(18:1/18:3)、鞘磷脂(18/18)。甘氨胆酸属于结合型胆汁酸,由游离型胆酸的24位羧基与甘氨酸结合生成。子痫前期组甘氨胆酸水平明显升高,差异倍数高达2.74,VIP高达3.208。胆汁中所含的胆汁酸以结合型为主,含量最丰富的甘氨胆酸和牛磺胆酸的比例是3∶1。LUNZER等[11]在1986年就发现孕15~40周的孕妇血清甘氨胆酸水平明显升高,但每次检测结果的中位数均在参考区间(0~1.5 μmol/L)内。BRITES等[12]的研究结果显示,甘氨胆酸>2.0 μmol/L对妊娠期肝内胆汁淤积具有早期诊断价值。目前尚未发现有甘氨胆酸与子痫前期或高血压疾病的相关报道。1999年,WU等[13]为了研究胆汁酸在调节人和大鼠血压中所起的作用,对人和大鼠进行了胆汁酸的检测,结果显示高血压组血浆总胆汁酸水平明显高于正常组,且在大鼠模型中,胆汁酸能诱发高血压。磷脂酰乙醇胺和磷脂酰胆碱是细胞膜磷脂的重要组成部分。BAHADOSINGH等[2]和CHEN等[14]的研究结果显示,子痫前期患者血清中有1种磷脂酰胆碱水平明显高于健康对照者。而AUSTDAL等[15]的研究结果显示,子痫前期患者和妊娠高血压患者的血清磷脂酰胆碱水平明显下降。本研究结果与AUSTDAL等[15]的研究结果一致。磷脂酰胆碱水平降低提示胆碱代谢发生改变。胆碱与减弱免疫炎症和抑制氧化应激反应相关。有研究结果显示,孕晚期母体摄入较高水平的胆碱可以降低胎盘和血液循环中抗血管生成因子FMS样酪氨酸激酶-1的水平[16-17]。
脂肪酸是脂肪、胆固醇酯和磷脂的重要组成成分。本研究筛选出的42种生物标志物中有8种代谢物能提供亚油酸〔18:2(9Z,12Z)〕、亚麻酸〔18:3(9Z,12Z,15Z)〕和花生四烯酸〔20:4(5Z,8Z,11Z,14Z)〕残基侧链,其中6种属于DG、1种属于磷胆酰胆碱、1种属于三酰甘油。JAIN等[18]对子痫前期患者和正常妊娠妇女的胎盘进行代谢组学研究,结果显示脂肪酸含量升高,升高的脂肪酸以花生四烯酸为主。花生四烯酸是生成前列腺素、血栓烷及白三烯的前体,而亚油酸和亚麻酸可在人体合成花生四烯酸。2018年,DAS等[19]发现花生四烯酸及其代谢物脂氧素A4(lipoxin A4,LXA4)和氧化四烯酸(epoxyeicosatrienoic acid,EET)通过调节平滑肌细胞功能和增殖、电压门控离子通道、细胞膜流动性和细胞膜受体、G蛋白偶联受体等参与血压的调节和糖尿病的发生、发展。花生四烯酸通过细胞色素P450环氧化物酶产生环氧基,转化为5,6-EET、8,9-EET、11,12-EET和14,15-EET。有研究结果显示,子痫前期患者的胎盘中EET水平明显升高,提示α-亚麻酸与亚麻酸代谢通路与子痫前期的发病有关[20]。还有研究结果显示,子痫前期患者的胎盘中细胞色素亚家族2J2上调,其代谢产物5,6-EET、14,15-EET及其相应的双羟基二十碳四烯酸水平升高[21]。EET可影响胚胎滋养层细胞入侵子宫螺旋动脉,导致螺旋小动脉重铸不足,使胎盘血流减少,最终导致胎盘缺血缺氧。此外,子痫前期患者血液中升高的5,6-EET可转换成血栓烷类物质,血栓烷类物质可引起血小板聚集,促进血管收缩。因此,花生四烯酸及其代谢物在子痫前期中的具体作用值得进一步研究。线粒体β氧化是脂肪酸分解的核心过程,子痫前期患者脂肪动员增加,因此脂质代谢异常与子痫前期有密切联系。
综上所述,本研究通过非靶向脂质组学方法,确定了子痫前期患者与非子痫前期孕妇代谢物的差异和可能的代谢通路差异。由于入组孕妇例数有限,且为半定量结果,因此还需要进一步进行大规模验证,才能为临床预测子痫前期提供准确、新型的代谢生物标志物。
