大鼠脑缺血/再灌注过程中血流量和脑组织含水量的变化趋势*
2020-03-20马梦尧苏欣宇姜鲲鹏
张 冉, 马梦尧, 苏欣宇, 孟 想, 姜鲲鹏, 李 曙△, 洪 云
(1. 皖南医学院病理生理学教研室, 安徽 芜湖 241002; 2. 皖南医学院弋矶山医院超声医学科, 安徽 芜湖 241001)
缺血性脑卒中(ischemia stroke)也称脑梗死,是人类疾病的第二大死因[1-2]。在缺血性脑血管病治疗中,多数常规治疗手段都可引起缺血/再灌注损伤(cerebral ischemia/reperfusion injury,CI/RI)。脑水肿作为脑缺血再灌后最严重的并发症,也是引起脑功能障碍甚至死亡的主要原因之一。血管源性脑水肿是脑梗塞后最常见的一种,主要特点是脑微血管通透性增高,血脑屏障完整性被破坏[3]。目前,对脑水肿的发病机制研究主要有血脑屏障学说、脑微循环障碍学说等。因此,了解脑微循环的改变对脑水肿的影响对于寻找缺血/再灌注损伤的治疗和康复措施也具有重要意义。有实验表明,高血压和脑血管梗塞多伴有血液动力学和血液流变学的异常[4]。目前,经颅多普勒超声技术已被广泛用于检测脑血液动力学与脑血液流变学的相关参数,这些参数在评价高血压、高颅压、阿尔茨海默病等脑血管及脑神经性病变有重要意义,并且脑血液动力学指标与脑血管梗塞的病理性变化方面更密切相关[4-6]。相对于脑血液动力学与流变学那些复杂的指标而言,脑血流量变化是在脑缺血/再灌注过程中最直接的改变[5]。因此,脑血流量的检测可做为脑血液动力学改变的直接参照。PeriCam PSI 血流灌注成像系统(简称PSI系统)基于激光散斑对比分析技术,可对大面积组织进行实时的血流动态成像监测,为微循环研究提供了全新的方法。本研究利用PSI系统,通过该系统获得全脑红外线散斑图、血流灌注量对比曲线和脑缺血/再灌注过程中的血流量数据变化[7-9],结合干湿重法测定的脑组织重量,探讨脑血流量变化与脑水肿形成的相关性,以期为临床治疗和促进康复提供新的思路。
1 材料与方法
1.1 实验动物
选择4~6周龄的SPF级SD雄性大鼠20只,体重240~260 g,由长沙市天勤生物技术有限公司提供[证书编号SCXK(湘)2014-0011]。自然光照饲养1周,正常饮食,维持室温25℃,湿度60%~70%。
1.2 主要试剂、仪器和材料
10%的水合氯醛、冰生理盐水、乙醚;PeriCam PSI血流灌注成像仪为德国Pari公司产品;0.1 mg精度的FA2004电子分析天平为天津天马衡基有限公司产品;BHD-9101.0A型电热恒温古风干燥箱为金华市荣华仪器制造有限公司产品;恒温鼠板为成都泰盟软件有限公司产品;定性滤纸为杭州富阳北木浆纸有限公司产品;A5级栓线为北京西浓科技有限公司产品。
1.3 MCAO大鼠模型制备
实验前大鼠禁食8~10 h,不禁水。所有大鼠均参照改良Zea-Longa线栓法建立MCAO大鼠模型[10-12],腹腔注射10%水合氯醛(0.3~0.5 ml/100 g)麻醉,待其全身肌肉松弛,呼吸、心跳平稳后,将大鼠仰卧位固定于恒温鼠板上。颈部常规备皮、消毒,做正中切口,顿性分离肌层,暴露右侧颈总、颈外及颈内动脉;夹闭颈总动脉,颈外动脉做一切口,线栓由此插入颈总动脉;游离颈外动脉,缓慢轻柔将线栓插入颈内动脉颅内段(此时应注意避免进入翼额动脉)至线栓标记处,固定线栓,缝合皮肤。当患侧血流灌注量下降超过50%即为线栓插入成功[13]。实验分为正常组(缺血前)、缺血5 min、30 min、1 h、2 h组及再灌注1 h、2 h、4 h、6 h及24 h组。正常组麻醉后不做任何处理,缺血组按上述线栓法建立不同时间的缺血模型,再灌注组大鼠均缺血2 h后拔出线栓建立不同时间的再灌模型。
1.4 PSI监测血流量变化情况
大鼠麻醉后,先测量未缺血时右侧大脑中动脉供血区血流量:将大鼠俯卧位固定于恒温鼠板上,分离头部皮肤、黏膜(较为敏感),暴露大鼠颅骨;打开PSI系统,将大鼠移至系统检测板上,固定头部,保持俯卧位,维持呼吸、心跳平稳,持续检测15~30 s,缝合头部皮肤,开始建立MCOA模型。持续监测大鼠右侧大脑在缺血5 min、30 min、1 h、2 h、再灌注5 min、30 min、1 h、2 h、4 h、6 h及24 h的血流量变化,监测过程用乙醚棉球在密闭环境中维持大鼠麻醉状态,待呼吸、心跳平稳后开始记录。
1.5 干湿重法测定脑组织水含量
干湿重法是目前实验室采用的测量脑组织水含量的经典方法。大鼠断头取脑后,脑组织用冰生理盐水冲洗干净,除去延髓,置于冰上,用定性滤纸粘吸脑组织表面的水及血迹,沿大脑纵裂将其分成左、右脑半球,分别称取两侧半球的重量,即为湿重;随后将脑组织置于65℃恒温烤箱中,24 h后取出,称其重量即为干重[14-16]。参照Panahpour H[17-18]等的方法计算脑组织水含量及水肿形成。
水含量(%)=[(湿重-干重)/湿重]×100
水肿(%)=损伤侧水含量-非损伤侧水含量
1.6 统计学处理
2 结果
2.1 不同时间点脑血流监测成像结果的比较
图像可清晰显示缺血前大脑血流灌注量丰富,灌流通畅,正常血供区呈现红色;缺血后,右侧大脑中动脉供血区出现血流中断,血流量下降;缺血前期,血流量逐渐下降,缺血1 h后血流量下降至最低,缺血2 h时变化趋势不明显;再灌初期,血流量恢复较快,再灌30 min时下降,再灌中期变化趋势不明显,再灌4 h后缓缓上升,至再灌24 h血流量恢复到接近正常(图1,见彩图页Ⅱ)。实验结果说明大鼠脑中动脉栓塞时脑血流量会逐渐下降,恢复再灌的早期血流量立刻恢复,但前期突然下降,中后期缓慢上升接近正常值。
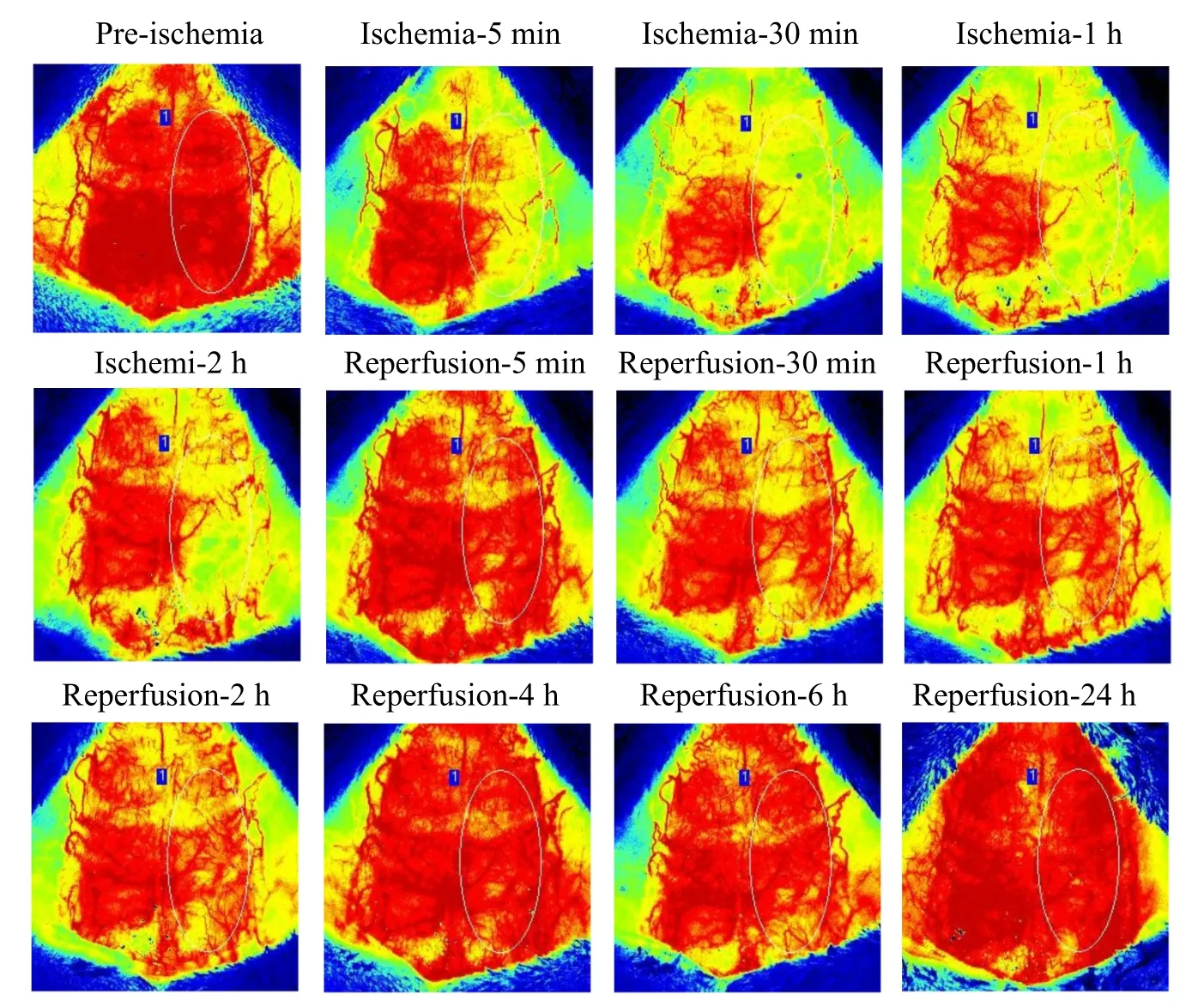
Fig.1 Color diagram shows cerebral blood perfusion at 12 different time points during the process from ischemia to reperfusion, where red represents the blood supply area and yellow represents the absence of blood flow. Comparing the areas enclosed by the oval box in the right hemisphere, the differences were obvious
2.2 不同时间点脑血流量变化百分比的比较
表中数据经过标准化处理,以缺血前血流量为1,不同时间点占缺血前血流量的比值为最终分析。线栓插入后,血流量即刻下降30%~40%;1 h下降50%(P<0.05);2 h无明显变化;再灌注时血流量即刻恢复至70%-80%(P<0.05);30 min时下降至60%(P<0.05);2 h血流量变化不明显;4 h血流量开始上升接近70%(P<0.05);6 h血流变化不明显,至24 h再次上升至85%(P<0.05),但任低于缺血前血流量。由此可以得出,大鼠在缺血2 h后血流达到最低,再灌后血流量即刻恢复,之后由于再灌注损伤的作用血流量出现了下降,再灌30 min~2 h之间血流量比较稳定,但仍然高于灌注前;4 h接着上升至6 h相对稳定,24 h再次上升接近缺血前水平(表1)。
Tab. 1 Comparison of the ratio of blood flow at different times to n=5)
2.3 不同时间点大鼠左、右脑半球水含量和水肿形成的比较
大鼠脑缺血/再灌注过程中左半球水含量在各时间点中无明显差异。右半球水含量与Control组比,缺血2 h组无明显变化,;再灌30 min、4 h及24 h组明显上升(P<0.05),且再灌24 h组水含量较30 min和4 h组均显著上升(P< 0.05)。同时,脑水肿程度与Control组比,缺血2 h和再灌30 min无明显差异,再灌4 h和24 h组较正常组、缺血组及再灌30min组都明显增高(P<0.05)且再灌24 h组较4 h组更显著(P<0.05)。实验结果说明大鼠大脑右半球水含量在缺血/再灌注过程中逐渐上升,并且脑水肿程度在再灌注中后期也逐渐加重(表2,图2)。
Fig. 2 Brain tissue in wet and dry state
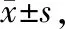
Tab. 2 The percentage of WC and edema formation in the left and right hemispheres of the brain tissues of rats in different groups(%, n=3)
3 讨论
本研究利用PSI血流灌注仪连续监测大鼠从缺血前到缺血2 h到再灌注24 h过程中缺血侧大脑的血流量变化,结果表明,大鼠大脑缺血期间血流量逐渐下降,随着再灌注的发生,再灌瞬间(5 min)血流量恢复较大,早期(30 min)缓慢下降至2 h期间维持稳定;中期(4 h)开始上升保持稳定,后期(24 h)再次上升接近缺血前。这说明大鼠大脑缺血/再灌注期间血流量的变化存在一定的规律性,尤其是在再灌30 min时血流量下降值得深入讨论。经过对不同时间点缺血及再灌模型的大鼠脑组织干湿重的测定,结果表明,各组样本间左侧脑半球无明显水含量的改变;右侧脑半球血流量在再灌早期下降后4 h开始上升,此时脑水肿形成也明显增高;24 h时,脑血流量恢复到最大,而脑水肿形成最高。因此,我们认为大鼠大脑缺血/再灌注中后期脑血流量的变化是造成脑水肿的重要因素之一。
目前,对于脑缺血/再灌注损伤的研究大多集中在能量代谢障碍、氧化应激、细胞凋亡等相关机制上,在脑微循环障碍方面的研究鲜有报道。缺血后脑水肿形成的机制也还不是很清楚,主要涉及钙离子学说、脑微循环障碍学说、血脑屏障学说及脑细胞代谢障碍等[19]。实验已经证实,脑缺血/再灌注后神经元的损伤加重与ROS的含量增多有关。并且在缺血/再灌注大鼠的脑组织中,缺血侧ROS的含量随再灌时间的延长(3 h~24 h)而增加[20]。而本实验的结果显示,再灌后脑血流量增加的同时脑组织水含量也明显增多。因此,我们认为再灌后增加的脑血流量也通过某种途径影响了ROS的产生或清除障碍,这有待进一步的研究。临床上脑水肿是缺血性脑卒中的严重并发症,有研究表明[3],CART肽(内源性活性肽)可抑制脑缺血引起的血脑屏障通透性增高而减轻脑水肿。也有文献表明,在中风期间增强微血管循环也可具有神经保护作用[21]。因此,有效减少脑水肿的发生也是目前临床治疗的重要手段。本实验研究大鼠脑缺血/再灌后血流量的变化与脑水肿的相关性,希望可以给临床治疗提供新的思考方向。
