miRNA-191对前列腺癌的增殖、迁移侵袭能力的影响及其机制*
2020-03-16聂永莉汤世敏毛永荣
聂永莉, 汤世敏, 彭 芳, 许 涛, 毛永荣
(1. 国药汉江医院肿瘤科, 湖北 丹江口 442700; 2. 长江大学机能学部, 湖北 荆州 434023; 3. 十堰市人民医院肿瘤科, 湖北 十堰 442000; 4. 湖北省肿瘤医院病理科, 湖北 武汉 430079)
前列腺癌是男性泌尿系统最常见的肿瘤之一,也是男性癌症相关死亡的主要原因之一。其通常是一种迟发性疾病,63%的确诊男性年龄在65岁及以上,且发病率逐年上升[1-2]。越来越多的证据表明,miRNA-191的异常表达具有致癌性[3-5]。研究报道[6-7],miRNA-191可调节细胞的侵袭和分化,促进细胞外基质的形成,并促进转移。miRNA-191在弥漫大B细胞淋巴瘤(DLBCL)患者中表达上调,并促进OCI-LY10细胞增殖侵袭。然而目前miRNA-191对前列腺癌细胞增殖、迁移及侵袭能力影响的研究鲜见报道。
磷脂酶C δ1(PLCD1)编码一种参与能量代谢、钙稳态和细胞内运动的酶,定位于第3号染色体短臂22.3区,在多个癌症中经常低表达[8]。研究表明,结直肠癌中PLCD1的表达明显低于癌旁组织,且PLCD1可抑制结直肠肿瘤细胞的增殖和迁移,并促进结直肠肿瘤细胞凋亡,诱导G1 / S期细胞周期停滞[9]。本研究通过检测前列腺癌细胞系中miRNA-191的表达,建立miRNA-191表达抑制转染细胞,探讨miRNA-191靶向PLCD1对前列腺癌细胞的增殖、迁移及侵袭能力的影响及其相关机制,为前列腺癌的防治提供理论依据。
1 材料与方法
1.1 主要试剂
人正常前列腺细胞RWPE-2和人前列癌细胞系(PC-3、DU-145、LNCa P、22RU1,美国ATCC公司);胎牛血清(美国 Gibco 公司);miRNA-191抑制剂和阴性对照(广州市锐博生物科技有限公司);Lipofectamine 2000转染试剂盒、TRIzol Reagent、miRNA-191和U6引物(美国Invitrogen公司);RT-qPCR引物(上海生工公司);SYBR Green PCR Master Mix(TaKaRa);兔抗PLCD1单克隆抗体(Abcam公司);HRP标记山羊抗兔IgG(Santa Cruze公司);双荧光素酶基因报告检测试剂盒(Promega);结晶紫溶液(上海碧云天生物技术有限公司)。
1.2 细胞培养
将PC-3、DU-145、LNCa P、22RU1人前列腺癌细胞培养于含10%胎牛血清的RPMI 1640培养基中;将RWPE-2人正常前列腺上皮细胞培养于含10%胎牛血清的KSFM培养基中,将培养基置于37℃、5%CO2的培养箱中培养。取对数生长期各细胞系,采用实时定量PCR法(RT-qPCR法)检测各细胞系中miRNA-191表达水平,选择PC-3细胞进行后续实验。
1.3 细胞转染
取对数生长期PC-3细胞接种于24孔板(2×105cells/well),待细胞融合度达到60%时,按照Lipofectamine 2000转染试剂盒说明书,分别将5 nmol/L miRNA-191抑制剂和5 nmol/L miRNA-191 Inhibitor NC溶于无血清培养基中;将1 μl Lipofectamine 2000溶于无血清培养基中,室温孵育5 min。将miRNA-191抑制剂或miRNA-191 Inhibitor NC与Lipofectamine 2000混合后室温静置20 min。转染期间将24孔板培养基换成无血清培养基,每孔400 μl,转染6 h后更换含血清培养液,继续培养48 h收集细胞,进行后续实验。
1.4 实时定量PCR法(RT-qPCR法)检测各组细胞miRNA-191和PLCD1 mRNA表达水平
Trizol法提取转染后PC-3细胞总RNA,逆转录获得cDNA,采用实时荧光定量PCR方法检测miRNA-191和PLCD1基因的表达水平。引物设计如下:miRNA-191正向5'-ACACTCCAGCTGGGCAACCGAATCCCAAAAGC-3',反向5'-CTCAACTGGTGTCGTGGA-3';U6正向5'-GCTTCGGCAGCACATATACTAAAAT-3',反向5'-CGCTTCACGAATTTGCGTGTCAT-3';PLCD1正向5'-TGTCGCTACTCAAGTGAGTC-3';反向5'-AGTCCTCCTGAACTTGTAG-3';β-actin正向5'-TGACGTGGACATCCGCAAAG-3',反向5'-CTGGAAGGTGGACAGCGAGG-3'。mRNA表达水平按公式(2-△△Ct法)计算。
1.5 Western blot法检测各组细胞PLCD1的蛋白表达
分别收集转染后各组细胞,加入RIPA 细胞裂解液裂解细胞,振荡离心后提取总蛋白并测定蛋白浓度。将蛋白样品与上样缓冲液混匀,经过SDS-PAGE分离胶后转至PVDF膜。5%脱脂奶粉中封闭1 h,加入PLCD1一抗(1∶1 000稀释),4℃冰箱孵育过夜。加入二抗(1∶3 000稀释),室温杂交1 h,ECL化学发光,于暗室成像拍照,以GAPDH为内参,计算各组细胞中PLCD1蛋白相对表达。
1.6 CCK8法检测细胞增殖水平
将转染后的各组细胞按每孔5×103个细胞数接种于96孔板,每组3个复孔,每孔培养液总量为100 μl。严格按照试剂盒说明书步骤操作,用酶标仪测定每孔450 nm处的吸光度值,实验重复3次。
1.7 细胞划痕法检测PC-3细胞的迁移能力
将各组细胞培养于6孔板中,用高压灭菌的200 μl枪头在孔内轻轻划1-3道痕,用PBS清洗并去除划下的细胞,加入无血清培养基培养24 h后在显微镜下观察细胞并拍照,计算相对划痕宽度。实验重复3次。
1.8 细胞侵袭法检测PC-3细胞的侵袭能力
取200 μl细胞(5×105cells/ml)加入上室,下室加入含20%胎牛血清的1640培养基700 μl,于37℃培养24 h。将膜下面的细胞与1%多聚甲醛混合,0.2%结晶紫溶液染色15 min。显微镜计数进入膜下的细胞数,随机取10个视野,计算平均值。实验重复3次。
1.9 双荧光素酶报告基因分析
采用生物信息学软件TargetScan选择PLCD1基因,采用双荧光素酶报告基因实验验证。分别构建野生型PLCD1-Wt和突变型PLCD1-Mut重组质粒,并将重组质粒与miRNA-191 Inhibitor或miRNA-191 NC共转染至PC-3细胞中,置于37℃培养箱继续培养48 h,收集并裂解细胞,使用双荧光素酶报告基因分析。
1.10 统计学处理
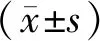
2 结果
2.1 miRNA-191在不同前列腺癌细胞株中的表达水平
本研究通过RT-qPCR法检测PC-3、DU-145、LNCa P、22RU1 4种人前列癌细胞系及RWPE-2细胞中miRNA-191的表达水平,发现与RWPE-2细胞相比,人前列癌细胞中miNRA-191的表达水平显著升高(P<0.05),且PC-3细胞中miNRA-191的表达水平较其他3种细胞系显著上调(P<0.05,表1)。因此,本实验选择PC-3细胞系用于后续研究。
Tab. 1 Expressions of miRNA-191 in different prostate cancer cell n=3)
2.2 各组细胞增殖能力比较
与空白对照组相比,miRNA-191 Inhibitor组细胞增殖受到抑制(P<0.05),而miRNA-191 NC组细胞增殖能力差异无统计学意义(P>0.05);与miRNA-191 NC组相比,miRNA-191 Inhibitor组细胞增殖能力显著降低(P<0.05,表2)。
Tab. 2 Comparison of PC-3 cell proliferation ability, migration and invasion in Different Groups n=3)
2.3 miRNA-191对PC-3细胞迁移及侵袭能力的影响
与空白对照组相比,miRNA-191 Inhibitor组细胞相对划痕宽度增加,细胞侵袭水平显著降低(P<0.05),而miRNA-191 NC组细胞相对划痕宽度和细胞侵袭水平差异无统计学意义(P>0.05);与miRNA-191 NC组相比,miRNA-191 Inhibitor组细胞相对划痕宽度增加,穿膜细胞数显著减少(P<0.05,表2,图1)。
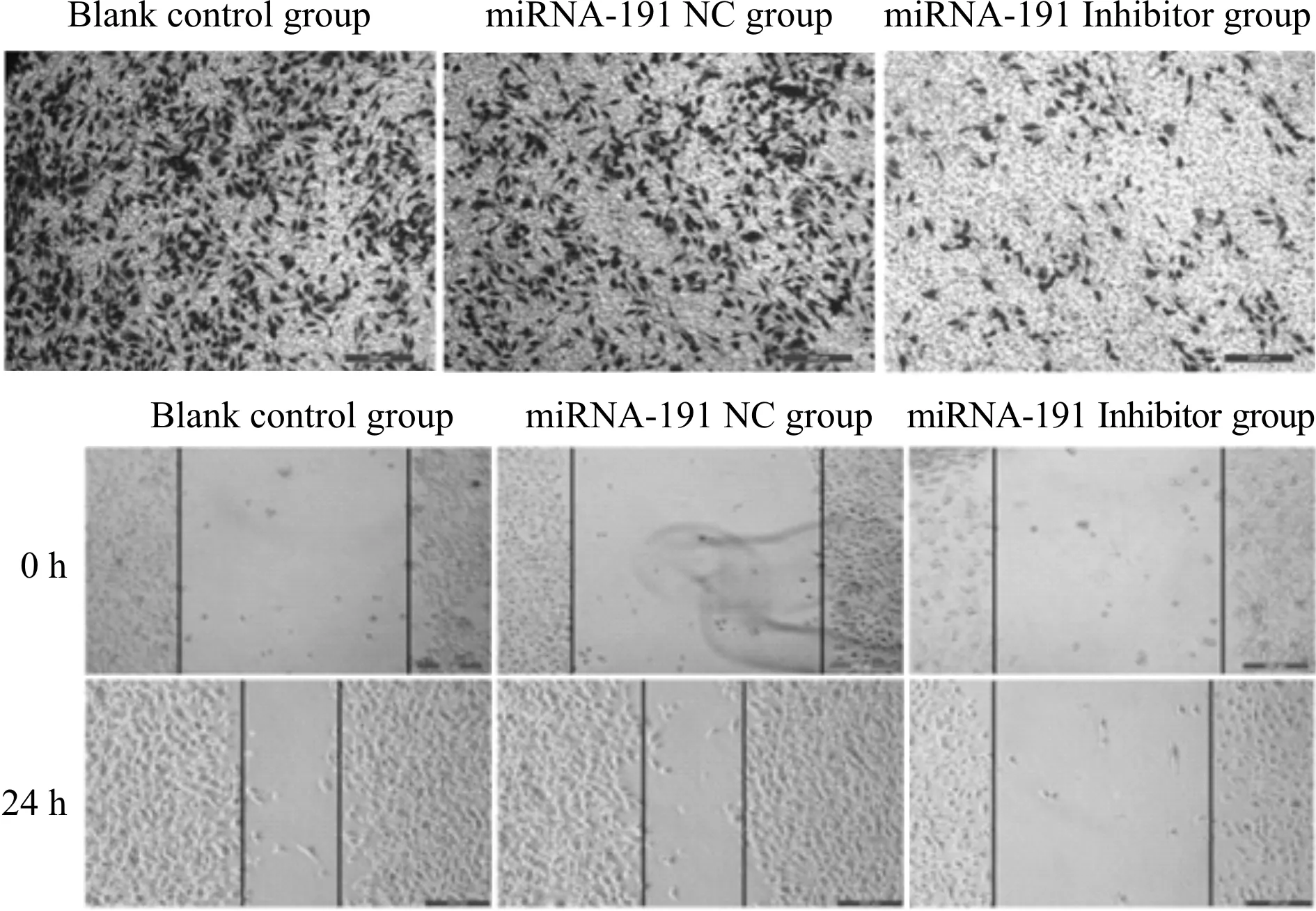
Fig. 1 Effects of miRNA-191 on migration and invasion of PC-3 cells
2.4 双荧光素酶报告基因实验验证miRNA-191与PLCD1的靶向关系
miRNA-191与PLCD1基因3’UTR存在互补结合位点,miRNA-191和PLCD1能够靶向结合,见图2。双荧光素酶活性检测结果显示,转染野生型PLCD1基因表达载体WT-3’UTR后再转染miRNA-191 Inhibitor细胞的荧光素酶活性与再转染miRNA-191 NC组显著升高(P<0.05);而转染突变型PLCD1基因表达载体Mutant-3’UTR后,再转染miRNA-191 Inhibitor的PC-3细胞荧光素酶活性差异无统计学意义(P>0.05,表3)。

Fig. 2 miRNA-191 targeted combination with PLCD1 3'UTR

Tab. 3 Effect of microRNA191 on migration and invasion of PC-3 cells
2.5 各组PLCD1蛋白及mRNA表达水平
与空白对照组相比,miRNA-191 Inhibitor组细胞中PLCD1蛋白及mRNA表达水平显著升高(P<0.05),而miRNA-191 NC组细胞中PLCD1蛋白及mRNA表达水平差异无统计学意义(P>0.05);与miRNA-191 NC组相比,miRNA-191 Inhibitor组细胞中PLCD1蛋白及mRNA表达水平显著升高(P< 0.05,表4,图3。)
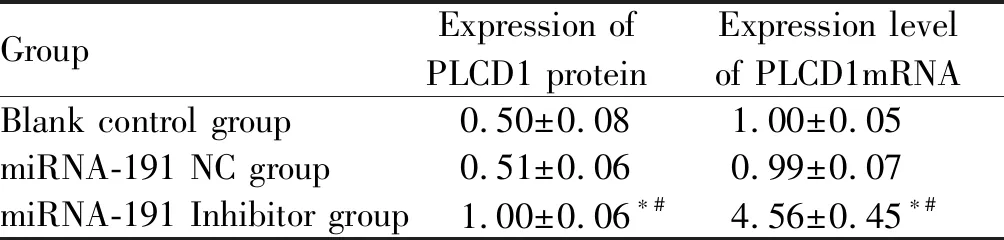
Tab. 4 Expression levels of PLCD1 protein and mRNA in each group
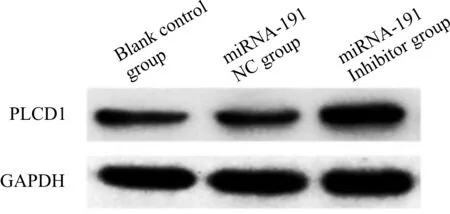
Fig. 3 Expression level of PLCD1 protein in each group
3 讨论
前列腺癌是泌尿外科最具挑战性的恶性肿瘤之一,随着血清前列腺特异性抗原(PSA)筛查的普及,前列腺癌的发病率呈逐年上升趋势,但其具体病因尚不明确。因此,了解参与前列腺癌发生发展的关键基因,深入探讨前列腺癌的相关分子机制[10-11],对前列腺癌的防治具有重要意义。miRNA-191在多种癌症中呈高表达,可促进癌细胞增殖、抑制凋亡,并启动上皮间质转化,并在肿瘤的发生发展过程中发挥重要作用[12-15]。磷脂酶C(PLC)在激素分泌、神经递质传递、生长因子信号、膜转运等胞内信号通路中发挥重要作用。PLCD1基因编码的酶能够调节能量代谢、钙稳态及胞内信号通路,其在许多肿瘤中被确定为抑癌基因,包括食管鳞状细胞癌、胃癌及乳腺癌等[16-17]。
本研究通过RT-PCR法检测PC-3、DU-145、LNCa P、22RU1 4种人前列癌细胞系及RWPE-2细胞中miRNA-191的表达水平,发现与RWPE-2细胞相比,人前列癌细胞中miNRA-191的表达水平显著升高,且PC-3细胞中miNRA-191的表达水平较其他3种细胞系显著上调。因此,本研究选择PC-3细胞系作为研究对象用于后续研究。在转染miRNA-191抑制剂后,PC-3细胞PLCD1表达水平较空白对照组和miRNA-191 NC group组显著升高。进一步采用生物信息学验证miRNA-191与PLCD1的靶向关系,结果发现,转染野生型PLCD1基因表达载体WT-3’UTR后再转染miRNA-191 Inhibitor细胞的荧光素酶活性与再转染miRNA-191 NC group组显著升高;而转染突变性PLCD1基因表达载体Mutant-3’UTR后,再转染miRNA-191 Inhibitor的PC-3细胞荧光素酶活性差异没有统计学意义。因此,PLCD1基因是miRNA-191的靶基因。
miRNAs是一类可对基因表达进行转录后调控的分子,通过靶向作用mRNA的3’UTR,降解靶mRNA或者抑制其翻译,调节细胞增殖、凋亡、转移等多种生物功能,其作为人类癌症的诊断生物标志物发挥着至关重要的作用[18]。有研究报道,miRNA-191在人乳腺癌细胞中特别是ER(+)乳腺癌中高表达,转染miRNA-191抑制体后,MCF-7细胞增殖、侵袭能力明显受到抑制[19];另有研究发现,PLCD1作为重要的增殖抑制基因,可阻碍细胞周期的进程进而抑制细胞增殖。转入PLCD1可促进CAPAN-1和BXPC-3胰腺癌细胞的凋亡并使细胞周期阻滞于G0/G1期,同时抑制其增殖、侵袭和迁移[20]。Mu等[21]研究发现PLCD1可通过诱导G2/M细胞周期停滞和凋亡,在体外对人乳腺癌细胞具有显著的抗增殖作用。本研究在转染miRNA-191抑制剂后,PC-3细胞增殖能力受到抑制,相对划痕宽度增加、细胞侵袭个数减少;提示miRNA-191可促进PC-3细胞的增殖、迁移和侵袭能力。
综上所述,PLCD1基因是miRNA-191的下游靶基因,其表达被miRNA-191抑制。miRNA-191在前列腺癌中发挥癌基因的作用,可通过靶向调控PLCD1对PC-3细胞的增殖、迁移和侵袭具有一定的促进作用。因此,miRNA-191作为潜在前列腺癌miRNA治疗的候选基因提供了重要的依据。
