甲状腺素对动脉瘤性蛛网膜下腔出血大鼠脑缺氧诱导因子-1α表达的影响及其机制*
2020-03-20刘窗溪韩国强高方友谌鸿斌徐晓钟
冉 卉, 尹 浩, 刘窗溪, 韩国强, 高方友, 谌鸿斌, 付 航, 徐晓钟, 黎 涛, 马 骏△
(1. 铜仁市人民医院神经外科, 贵州 铜仁 554309; 2. 贵州省人民医院神经外科, 贵州 贵阳 550002; 3. 清镇市人民医院神经外科, 贵州 贵阳 551400; 4. 毕节市中医院神经外科, 贵州 贵阳 551700; 5. 赣州市人民医院神经外科, 贵州 贵阳 341000)
SAH的发病率在所有脑血管意外中仅次于脑梗死及高血压脑出血,主要由动静脉畸形破裂、动脉瘤破裂等疾病导致,其中动脉瘤破裂所致SAH占70%[1-2]。动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)患者预后较差,且患者发病的平均年龄多在50岁左右,是对其家庭沉重的打击。缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)是细胞在转录水平协调缺氧变化的核转录复合体,是介导细胞内低氧反应的最主要的调节因子。HIF-1表达增高后可通过多种靶基因发挥后续多种生物学效应,从而改善蛛网膜下腔出血预后。
aSAH患者即使经过介入栓塞、开颅手术后神经功能得以康复,但是甲状腺激素水平紊乱仍可严重影响其认知能力和生活质量[3-4]。Ma J等[5-7]发现,部分动脉瘤性蛛网膜下腔出血后患者存在一定程度的甲状腺激素紊乱和认知能力障碍,通过补充甲状腺素可改善患者预后。在脑缺血研究中发现,甲状腺素对新生大鼠缺氧缺血性脑损伤有一定保护作用,甲状腺素的补充可促进HIF-1α的表达,是通过激活PI3K/Akt信号通路而实现的[8]。目前对于aSAH后补充甲状腺素治疗及其相关机制的研究尚鲜有文献报道。为阐明aSAH后补充甲状腺激素的作用及其对HIF-1α的影响机制故开展本研究,本研究利用颈内动脉穿刺法建立SAH大鼠模型,探讨T4甲状腺素是否能够对动脉瘤性蛛网膜下腔出血后大鼠脑损伤起保护作用,及其对HIF-1α表达的影响及可能的作用途径,为临床上应用T4干预动脉瘤性蛛网膜下腔出血提供动物实验证据。
1 材料与方法
1.1 实验动物与主要仪器、试剂
72只SPF级健康雄性SD大鼠,8周龄,[重庆医科大学实验动物中心提供,实验动物生产许可证号:SCXK(渝)2018-0003;实验动物使用许可证号:SYXK(渝)2018-0003],体重(300±20)g,。严格遵循动物伦理,本试验经院伦理委员会审批通过,审批号: 伦审(动物)2015-045号。T4 (美国sigma公司)、HIF-1α兔(美国immunoway公司)、p-Akt兔(美国immunoway公司)、MaxVision TM HRP-Polymeranti-Mouse/Rabbit IHC Kit 羊(武汉bioswamp公司)、TUNEL试剂盒(美国Roche公司)。
1.2 甲状腺素溶液的配置
德国Sigma公司产的左甲状腺素粉末100 mg,溶解在含0.4 mol/L NaOH的600 ml/L 的乙醇溶液,稀释成1 g/L 的浓溶液,后用PBS缓冲剂稀释100倍成0.01 g/L。
1.3 实验分组
实验动物随机分为4组(n=18):蛛网膜下腔出血组(SAH组)、蛛网膜下腔出血+甲状腺素干预组(SAH+T4组)、蛛网膜下腔出血+溶剂组(SAH+溶剂组)、假手术组。颈内动脉穿刺法建立SAH模型,SAH+T4干预组及SAH+生理盐水组:建模成功后即刻予大鼠腹腔注射3 μg/100 g T4及等体积溶剂,每隔24 h一次,连续3 d。假手术组在建立模型过程中尼龙线不刺破血管壁。建模前后均行以Loeffler 5分制评分法行神经行为学评分。抓住大鼠背部时,能够正常运动并且在5 s内翻身为5分,自主运动减少但5 s内仍能翻身为4分;翻身时间大于5 s为3分,不能翻身为2分,不能运动为1分。
1.4 标本采集
各组6只经4%水合氯醛(0.1 ml/kg)腹腔注射麻醉后,以多聚甲醛心脏灌注法处死后迅速开颅取脑,将鼠脑放在4%多聚甲醛内固定,4℃冰箱保存24 h,用于免疫组化及凋亡检测;石蜡包埋切片行免疫组化染色检测HIF-1α及p-Akt蛋白、6只用TUNEL法检测大脑皮层凋亡情况,。各组6只大鼠4%水合氯醛(0.1 ml/1kg)腹腔注射麻醉,麻醉起效后迅速开颅取全脑,以干湿重法进行脑水肿含量检测。凋亡率=tunel阳性细胞数/视野所有细胞数×100%;脑含水量=[(湿重-干重)/湿重]×100%。HIF-1α以细胞核或胞浆内有棕黄色颗粒为阳性表达;p-Akt以胞浆内或胞膜有棕黄色颗粒为阳性表达。每个标本随机选取5张片各取2个视野,显微镜下计数凋亡阳性细胞。
1.5 统计学处理
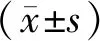
2 结果
2.1 甲状腺素对大鼠脑组织形态学的影响
SAH组及SAH+T4组、SAH+溶剂组大鼠的脑组织肿胀明显,肿胀程度肉眼不易区分,均在颅底及Willis环附近蛛网膜下腔可见暗红色血凝块,假手术组大鼠脑组织则未见明显血凝块,SAH+T4组蛛网膜下腔出血情况较SAH组及SAH+溶剂组减轻(图1,见彩图页Ⅳ)。大鼠建模术后行颅脑CT平扫:SAH组、SAH+T4组及SAH+溶剂组大鼠颅脑CT平扫可见脑池内高密度影,假手术组颅内则未见明显密度增高影,证实大鼠建模成功,SAH+T4组密度增高影也较SAH组及SAH+溶剂组减轻(图2)。
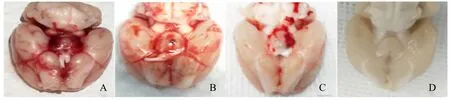
Fig.1 Brain tissue after internal carotid artery puncture
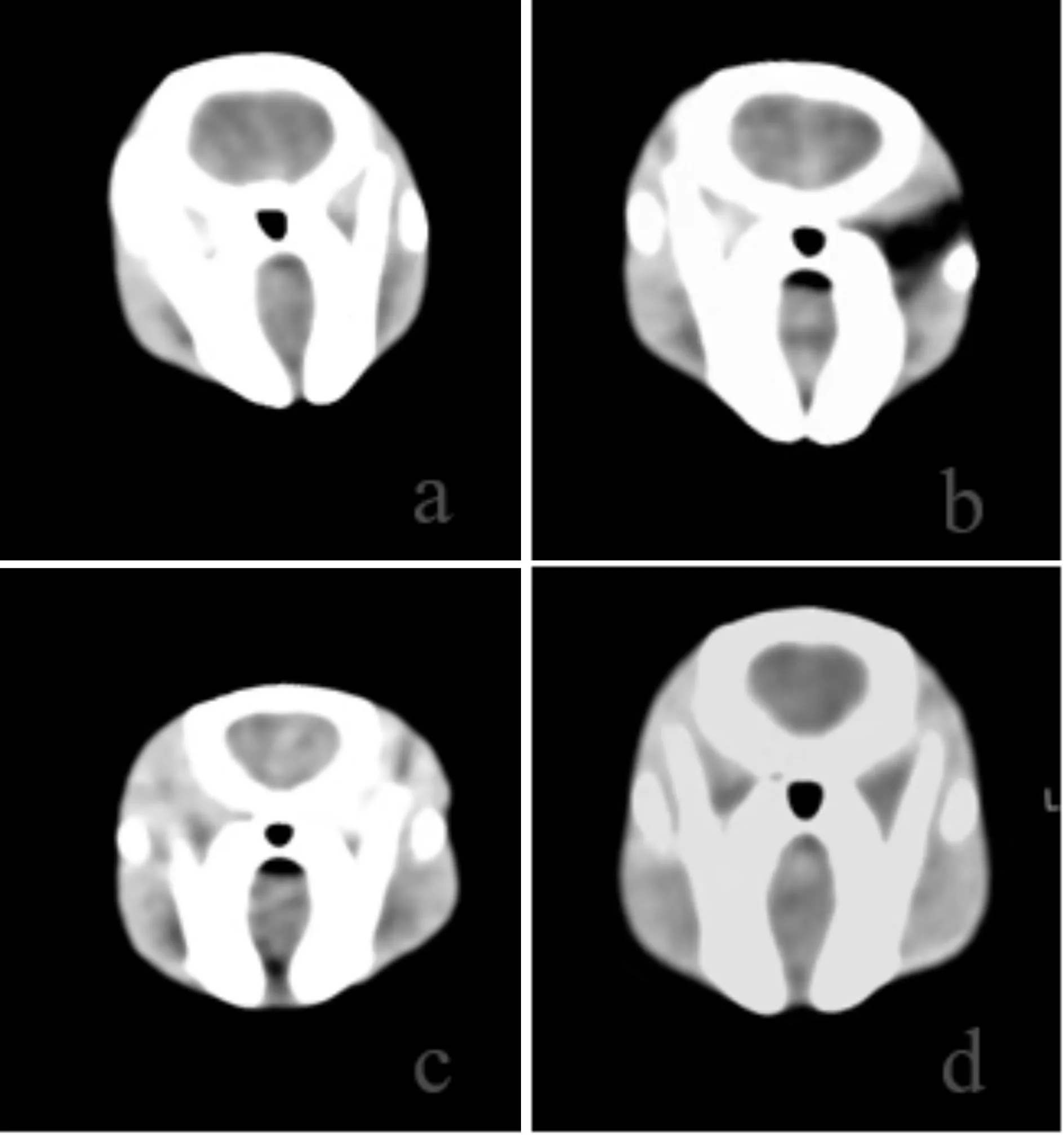
Fig. 2 CT scan after internal carotid artery puncture
2.2 甲状腺素对大鼠脑含水量与神经行为学评分的影响
结果表明,SAH组、SAH+T4组脑含水量较假手术组明显增多(P<0.05);SAH+溶剂组脑含水量与SAH组比较未见明显差异(P>0.05);SAH+T4组脑组织含水量较SAH组明显减少(P<0.05)。神经行为学评分以Loeffler的5分制评分法为标准,主要观察大鼠自主活动的变化。术前各组大鼠神经行为学评分各为5分,未见神经功能缺失;假手术组大鼠术后未见明显神经功能障碍,SAH组、SAH+T4组及SAH+溶剂组术后神经功能缺失表现轻则自主活动减少,重则不能运动。建模后:SAH组较假手术组神经行为学评分降低(P<0.05),较SAH+溶剂组比较未见明显差异(P>0.05),SAH+T4组则较SAH组神经行为学评分增高(P<0.05),较假手术组经行为学评分降低(P<0.05)。SAH组细胞凋亡率较假手术组明显增加(P<0.05),SAH+T4组细胞凋亡率较SAH组明显减少(P<0.05,表1)。
2.3 大鼠脑大脑皮层HIF-1α蛋白、p-Akt蛋白水平
免疫组化法检测HIF-1α蛋白,阳性细胞的细胞质呈棕黄色,HIF-1α蛋白表达:假手术组可见少量HIF-1α蛋白表达,较SAH组比较明显减少(P< 0.05);SAH组及SAH+溶剂组可见大量HIF-1α蛋白表达,两者之间未见明显差异(P>0.05);SAH+T4组HIF-1α蛋白表达较SAH组明显增多(P<0.05)。免疫组化法检测p-Akt蛋白,阳性细胞的细胞质呈棕黄色,p-Akt蛋白:假手术组可见少量p-Akt蛋白表达,较SAH组比较明显减少(P<0.05);SAH组及SAH+溶剂组可见大量p-Akt蛋白表达,两者之间未见明显差异(P>0.05);SAH+T4组p-Akt蛋白表达较SAH组明显增多(P<0.05,图3,4,表1,图3,4见彩图页Ⅳ)。
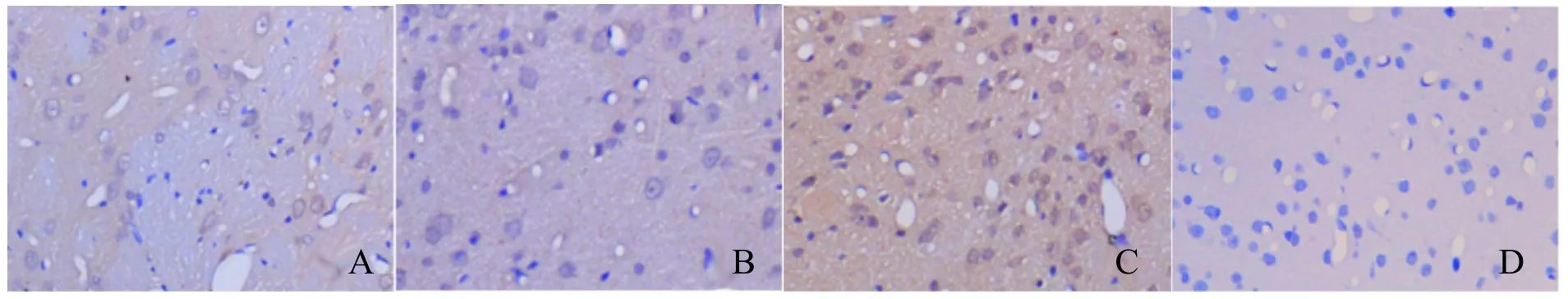
Fig.3 Expression of HIF-1αprotein(SP ×200)
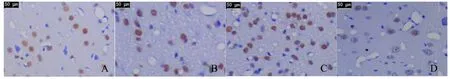
Fig.4 Expression of p-Akt protein(SP ×200)

Tab. 1 brain water content, neuroethology assessment, apoptosis index,HIF-1α, p-Akt of rats n=6)
3 讨论
动脉瘤性蛛网膜下腔出血后可出现甲状腺素激素分泌减少现象,并且出现不同程度的记忆力减退,以及嗜睡等症状为主要表现的甲状腺素紊乱症状[9]。文献报道,补充T4治疗可在一定程度上改善患者预后。HIF-1α作为重要的低氧反应因子在很多组织器官的缺血、低氧反应中起着重要作用。研究表明,慢性低氧小鼠睾丸组织HIF-1α的高表达可引起生精细胞凋亡增加[10];心肌细胞中HIF-1α的表达可协同Bcl-2家族凋亡相关蛋白的表达,在低氧导致的心肌细胞凋亡中发挥重要作用[11]。在对于神经系统疾病的研究中发现,新生大鼠缺氧缺血性脑损伤在使用T4治疗可通过激活PI3K/Akt信号通路促进HIF-1α的表达,而HIF-1α表达增加后可作用于靶基因发挥脑保护作用[12]。有关甲状腺激素在出血性疾病中是否能通过上调HIF-1α产生后续生物学作用的研究甚少,对于出血性疾病蛛网膜下腔出血中大鼠使用甲状腺素干预后脑组织缺氧诱导因子-1α表达的变化,以及其机制目前尚鲜有文献报道。因此本实验拟通过建立动脉瘤性蛛网膜下腔出血大鼠模型,以甲状腺素作为干预因素,检测干预后大鼠脑组织内的 HIF-1α蛋白、p-Akt蛋白、脑组织含水量、细胞凋亡等的变化情况,初步探讨可能的机制。
本实验中结果表明,SAH组脑含水量较假手术组明显增多,SAH组较假手术组神经行为学评分降低,SAH组可以见到大量凋亡细胞,其凋亡率较假手术组明显增大,由此证明蛛网膜下腔出血可导致大鼠神经行为障碍、脑水肿加重、凋亡增大。
在aSAH后甲状腺激素紊乱患者的临床研究中发现,甲状腺激素替代治疗能够改善动脉瘤性蛛网膜下腔出血慢性期甲状腺功能低下患者的部分认知能力,改善患者的预后[13]。在本实验中发现,SAH+T4组脑含水量较SAH组明显减少,SAH+T4组较SAH组神经行为学评分增高,SAH+T4组凋亡率较SAH组明显减小,证明使用T4治疗可改善大鼠动脉瘤性蛛网膜下腔出血后神经行为学评分、减轻脑水肿、减少细胞凋亡。通过对大鼠动脉瘤性蛛网膜下腔出血后T4治疗的研究得到了与临床应用的类似结果,从动物学实验方面为T4治疗改善aSAH的预后提供了依据。
为探讨T4替代治疗是否能通过促进HIF-1α表达发挥脑保护作用及其机制,实验中对脑组织蛋白HIF-1α表达水平,p-Akt蛋白表达水平进行了检测。HIF-1是由HIF-1α和HIF-1β组成的异源二聚体,其活性主要由HIF-1α调控。HIF-1α能够调节数以百计的靶基因的表达,与其结合后由HIF-1α参与转录,可起到促血管的新生、细胞增殖与凋亡调节等作用[14]。据文献报道,HIF-1α可通过上调Bcl-2而抑制细胞凋亡[15],通过抑制凋亡保护神经细胞。PI3K/Akt信号通路是重要的细胞代谢通路,PI3K通过丝氨酸-苏氨酸激酶Akt激活成为PIP3。Akt与PIP3结合并自胞浆转移至胞膜,最终Akt被激活为p-Akt,p-Akt是PI3K/Akt信号通路的重要标志[16]。研究表明,缺氧时PI3K/Akt信号通路被激活,p-Akt表达增加,HIF-1α表达也相应增加[17],提示了p-Akt作为标志物与HIF-1α表达相关,p-Akt可上调HIF-1α表达水平。本实验中可见,T4干预aSAH后大鼠脑细胞HIF-1α蛋白及p-Akt蛋白较SAH组明显增多;SAH组及SAH+溶剂组虽可见p-Akt蛋白表达,但两者之间未见明显差异。表明补充T4使PI3K/Akt信号通路活化,p-Akt蛋白表达增加,从而上调脑组织蛋白HIF-1α表达水平。T4干预可能通过PI3K/Akt信号通路介导,上调脑组织蛋白HIF-1α表达水平发挥后续生物学效应,从而减轻细胞凋亡、脑水肿,改善神经行为障碍,起到脑保护作用。
目前对于aSAH后补充甲状腺素对HIF-1α表达的影响,以及其激活机制的研究尚鲜有文献报道,本实验研究对改善aSAH预后的治疗提供了新的思路。然而T4替代治疗以改善aSAH患者预后的相关机制仍不十分清楚,因此进一步开展相关分子机制的研究,将对未来改善aSAH患者的预后提供新的治疗思路和治疗靶点。
