鳖甲育肝颗粒对乙醇性肝纤维化大鼠的影响*
2020-03-16韦凌霞丁茂鹏王志旺刘雪枫庞亚蓉
韦凌霞, 丁茂鹏, 王志旺, 刘雪枫, 庞亚蓉, 郭 玫
(甘肃中医药大学, 兰州 730000)
肝纤维化(hepatic fibrosis, HF)是肝脏在慢性炎症过程中的修复反应。随着全球酒精食用量的迅速增加,乙醇性肝纤维化(ethanol-induced hepatic fibrosis, EHF)已经成为肝病之纤维化的主要病因之一。环磷腺苷效应元件结合蛋白(cAMP-response element binding protein , CREB)是环磷酸腺苷(Cyclic adenosine monophosphate, cAMP)的下游分子,其作为肝纤维化的关键靶点受到了很多关注。据报道,在HF过程中,CREB与肝星状细胞(hepatic stellate cell,HSC)的激活增值、炎证因子的释放、细胞外基质的沉积及肝纤维化发生发展有密切的关系[1-2]。研究显示,HF过程能够在有效治疗手段下发生逆转,一旦形成肝硬化则预后不甚理想[3],故抗HF是治疗多种肝病的主要治疗目的,而中医药在治疗HF等慢性疾病过程中有明显的优势。中医认为病邪耗伤阴血、相火妄动引起肝阴不足是HF的基础矛盾,然淤血聚于肝脉,血瘀之症渐显,故阴虚气滞、血瘀癥积是HF过程的基础病机,因此在“体阴而阴不足”中医理论指导下[4],在育阴软肝、化瘀消癥治法指导下[5]拟定鳖甲育肝颗粒,其由柴胡、黄芩、山茱萸、鳖甲、白芍、牡丹皮等中药制成,对慢性肝炎、HF有明显的治疗作用[6],本次实验采用乙醇来复制HF大鼠模型,探讨鳖甲育肝颗粒的抗EHF作用及其对CREB的影响,为鳖甲育肝颗粒治疗EHF提供理论依据。
1 材料与方法
1.1 药品与试剂
甘肃中医药大学药理学教研室提供的鳖甲育肝颗粒(BiejiaYuganGranule, BYG),批号:20181206;西双版纳版纳药业责任有限公司生产的秋水仙碱片(Colchicine),国药准字:H53021369,批号:20190203。南京建成生物工研究所生产的羟脯氨酸(Hydroxyproline, Hyp),批号:20190502;北京博奥森生物技术有限公司生产的α-平滑肌肌动蛋白(α-smooth muscle actin, α-SMA)、环磷腺苷效应元件结合蛋白(CREB)免疫组化试剂盒,批号:YT5121、YP0075。其余试剂均为分析纯。
1.2 仪器
赛多利斯仪器有限公司生产的BS1103型电子分析天平,日本Olympus生产的CH-212型光学显微镜,成都泰盟科技有限公司生产的BI-2000型医学图像分析系统。
1.3 动物
SPF级SD雄性大鼠,体重200~230 g,中国农业科学院的兰州兽医研究所提供,实验动物质量合格证号SCXK(甘)2015-0001。甘肃中医药大学的实验动物中心饲养,实验动物设施使用许可证号SYXK(甘)2015-0005。
1.4 分组、造模及给药
将大鼠随机分为空白对照组(Con)、模型对照组(ET)、鳖甲育肝颗粒对照组(BYG)、秋水仙碱组(ET+COL)、鳖甲育肝颗粒低剂量组(ET+LBYG)和鳖甲育肝颗粒高剂量组(ET+HBYG)(n=8),采用梯度乙醇灌胃法来复制肝纤维化大鼠模型[7],大鼠第1~4周灌胃5 g/(kg·d)乙醇,第5~8周灌胃7 g/(kg·d)乙醇,第9~12周灌胃9 g/(kg·d)乙醇,第13~24周灌胃9.5 g/(kg·d)乙醇,其中乙醇剂量计算采用下列公式:乙醇剂量(g) = 无水乙醇体积(ml)×预配乙醇浓度(%)×0.8(g/ml),其中空白对照组与鳖甲育肝颗粒对照组大鼠灌胃等量纯净水。在复制模型的同时每天灌胃相应药物:鳖甲育肝颗粒对照组灌胃鳖甲育肝颗粒5.55 g/kg、秋水仙碱组灌胃秋水仙碱1.0×10-4g/kg、鳖甲育肝颗粒低剂量组灌胃鳖甲育肝颗粒1.85 g/kg、鳖甲育肝颗粒高剂量组灌胃鳖甲育肝颗粒5.55 g/kg连续给药24周。其中空白对照组与模型对照组按10 ml/kg灌胃等量纯净水。
1.5 取材、测定指标
实验第169日,麻醉后处死大鼠,手术摘取肝脏后用生理盐水冲洗,立即观察脏器宏观变化并计算肝脏宏观变化指数(macropathological index of liver, LMPI),具体半定量标准如下,肝脏表面颜色:鲜红色计0分,浅红色计1分,浅黄色计2分,棕黄色计3分;肝脏质地软硬:质地柔软计0分,质地较柔软计1分,质地较硬计2分,质地变硬计3分;肝脏表面光滑程度:光滑细腻计0分,光滑偶见细颗粒计1分,表面有粗颗粒计2分,表面弥漫性结节计3分。在固定位置取肝组织3份,第1份肝组织精密称重,干燥至恒重后称重,计算肝组织含水量;第2份肝组织,采用ELISA法严格按照试剂盒说明书测定Hyp及胶原蛋白含量;第3份肝组织用多聚甲醛固定,切片经HE染色或α-SMA、CREB免疫组化染色,在镜下观测肝组织纤维化病理变化以及α-SMA、CREB的表达水平。
1.6 统计学处理
2 结果
2.1 鳖甲育肝颗粒对乙醇性肝纤维化大鼠肝脏宏观变化的影响
如图1所示,空白对照组大鼠肝脏颜色鲜红,质地柔软,表面光滑,边缘锐利,呈正常肝组织形态;模型对照组大鼠肝脏表面粗糙呈弥漫性结节状,棕黄色,边缘变钝,质脆易碎。经鳖甲育肝颗粒治疗后,大鼠肝脏上述肝脏宏观变化得到明显改善。对肝脏宏观变化进行半定量分析,结果显示,模型对照组肝脏宏观变化指数显著升高,与空白对照组比较有统计学意义(P<0.01);在鳖甲育肝颗粒的干预下,肝脏宏观变化指数明显降低,与模型对照组比较有统计学意义(P<0.01,表1)。
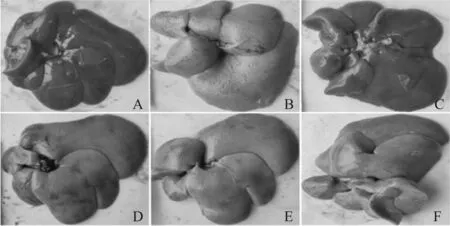
Fig. 1 Effect of BYG on macroscopical changes of liver in EHF rats
2.2 鳖甲育肝颗粒对乙醇性肝纤维化大鼠肝组织含水量的影响
模型对照组大鼠肝组织含水量显著升高,与空白对照组比较有统计学意义(P<0.01);鳖甲育肝颗粒高、低剂量组大鼠肝组织含水量明显下降,与模型对照组比较有统计学意义(P<0.05, 0.01,表1)。
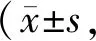
Tab. 1 Effects of BYG on LMPI and water content in liver tissue of EHF rats n=8)
2.3 鳖甲育肝颗粒对乙醇性肝纤维化大鼠肝组织病理学的影响
在光学显微镜放大倍数为100倍时观察,空白对照组大鼠肝小叶结构清晰,肝板呈索状排列,脂肪细胞及胶原沉积少见。模型对照组大鼠肝纤维组织增生明显且相互牵拉,致使肝小叶结构扭曲,肝细胞多见变性、坏死,并有大量脂肪细胞。鳖甲育肝颗粒各剂量组大鼠肝组织上述纤维化病理变化出现不同程度改善(图2)。
2.4 鳖甲育肝颗粒对乙醇性肝纤维化大鼠肝组织α-SMA表达的影响
大鼠肝组织α-SMA表达镜下呈棕褐色颗粒状,对其表达水平进行半定量分析,表2结果显示,模型对照组α-SMA表达的平均光密度值显著增加,与空白对照组比较有统计学意义(P<0.01)。鳖甲育肝颗粒各剂量组α-SMA表达水平明显下降,与模型对照组比较有统计学意义(P<0.05, 0.01);其中鳖甲育肝颗粒高剂量组下降更加明显(P<0.01,图3,表2)。
2.5 鳖甲育肝颗粒对乙醇性肝纤维化大鼠肝组织Hyp含量的影响
模型对照组大鼠肝组织中Hyp的含量显著增加,与空白对照组比较有统计学意义(P<0.01)。鳖甲育肝颗粒各剂量组肝组织Hyp的含量明显下降,与模型对照组比较有统计学意义(P<0.01);与鳖甲育肝颗粒低剂量组比较,鳖甲育肝颗粒高剂量组下降幅度更大(P<0.05,表2)。
2.6 鳖甲育肝颗粒对乙醇性肝纤维化大鼠肝组织CREB表达的影响
图4显示,大鼠肝组织中CREB的表达呈棕褐色颗粒状,对其表达水平进行半定量分析,表2结果显示,模型对照组CREB表达的平均光密度值显著增加,与空白对照组比较有统计学意义(P<0.01);鳖甲育肝颗粒各剂量组CREB表达明显降低,与模型对照组比较有统计学意义(P<0.01)。
Fig. 4 Effect of BYG on the expression of CREB in the liver tissues of EHF rats (×40)
Tab. 2 Effects of BYG on the expressions of α-SMA and Hyp in liver tissues of EHF rats n=8)
3 讨论
肝纤维化(HF)是急性肝病后期或慢性肝病过程中肝组织的基本病理变化过程,在多种病理因素的刺激下肝纤维组织增生、沉积并相互牵拉,使肝小叶结构扭曲变形,肝细胞功能紊乱而变性、坏死,代谢障碍而出现大量脂肪细胞[8]。在肝病、HF的过程中,过量饮酒是目前最主要的诱发因素之一,进入体内的乙醇约有90%在肝脏中转化为乙醛,乙醛通过抑制脂肪酸氧化代谢、促进脂肪酸合成而诱发乙醇性脂肪肝;线粒体受损及物质代谢紊乱激活氧化应激反应,肝组织在反复的“创伤-修复”过程中发生炎症反应(即乙醇性肝炎);持续的代谢紊乱与炎症反应激发肝星状细胞(hepatic stellate cell, HSC)转化为肌成纤维细胞(myofibroblasts, MFB),合成大量纤维蛋白并沉积于肝组织而引起乙醇性肝纤维化(EHF)[9],在HSC激活并转化为MFB的过程中可特异性表达α-平滑肌肌动蛋白(α-SMA),α-SMA收缩使蛋白排列成具有可收缩功能的形式,从而使肝组织在大量纤维蛋白的协同作用下相互牵拉,致使肝细胞功能紊乱而变性、坏死,肝小叶结构扭曲变形,故MFB表达α-SMA是HF过程中产生过量ECM的标志性产物[10]。而胶原纤维主要由胶原蛋白构成,羟脯氨酸(Hyp)常被认为是胶原蛋白的特有成分,肝组织Hyp含量可间接反映肝纤维化的程度。在HF的治疗过程中,中医药逐渐显示出明显的优势,在“体阴而阴不足”中医理论的指导下拟定的鳖甲育肝颗粒(BYG),由山茱萸、牡丹皮、柴胡、黄芩、白芍、鳖甲等药物组成,具有育阴调肝、软肝散积之效,临床上对慢性肝炎、HF有明显的疗效[6]。本次实验采用梯度乙醇灌胃法来复制酒精性肝纤维化大鼠模型,实验24周观察测定相关指标。结果发现模型组大鼠肝脏表面粗糙呈弥漫性结节状,显棕黄色,边缘变钝,质脆易碎,肝脏含水量也显著升高,肝组织病检可见肝纤维组织增生,肝索排列紊乱,肝小叶结构扭曲,肝细胞变性、坏死,并有大量脂肪细胞,肝纤维化特征明显,表明造模成功。给予BYG干预后,肝脏在表面颜色、质地软硬及光滑程度等方面得到明显改善,肝脏宏观变化指数明显下降,肝组织纤维化病理变化出现不同程度的改善,肝组织含水量、Hyp及α-SMA明显下降,提示BYG对EHF有明显的治疗作用。
cAMP/PKA/CREB信号通路是目前研究的经典通路之一,在腺苷酸环化酶催化下生成的cAMP可激活PKA,活化的PKA使环磷腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)磷酸化,p-CREB入核诱导相应的基因转录,从而引发生物学效应[11]。以前对CREB及其信号通路的研究主要局限于神经系统,近年来研究显示,cAMP/PKA/CREB信号通路与HF过程中的HSC激活及纤维蛋白表达有密切的关系[1]。乙醇可通过诱导HSC激活并释放腺苷受体(AR)来使cAMP的含量升高,从而引起下游PKA、CREB等相关分子表达上调[12]。如咖啡因可通过抑制肝星状细胞cAMP的转化,通过cAMP/PKA/CREB信号通路而发挥抗HF的作用[13]。在本次研究结果显示,BYG各剂量均可下调CREB的表达而缓解肝纤维化,降低α-SMA的表达水平,其作用强度与秋水仙碱相当,且其疗效有一定的量效关系。提示抑制CREB的活性是BYG抗EHF的机制之一,至于BYG对cAMP/PKA/CREB信号通路其他关键蛋白及其相关的活性因子的影响尚需进一步研究。
