川楝素对人胃癌细胞MKN-45中CTPS细胞蛇形成的影响及其机制*
2020-03-20张伟伟邵淑丽
陈 雯, 张伟伟,2△, 潘 阳, 刘 畅, 邵淑丽,2
(1. 齐齐哈尔大学生命科学与农林学院, 2. 抗性基因工程与寒地生物多样性保护黑龙江省重点实验室, 齐齐哈尔 161006)
川楝素(toosendanin, TSN)是从楝属植物树皮中提取出来的一种三萜烯类物质,研究证明,其通过诱导细胞分化以及细胞凋亡从而具有抗肿瘤作用[1]。在肝癌、结直肠癌、乳腺癌等癌细胞中,川楝素可诱导细胞周期阻滞和凋亡,以及对PI3K/Akt、MEK/Erk、MAPK/JNK通路的抑制[2, 3]。在对胶质母细胞瘤(GBM)的研究中表明,TSN通过雌激素受体(ER)依赖的机制选择性地抑制U87和C6细胞的癌细胞增殖,诱导细胞凋亡[4]。在TSN诱导细胞凋亡过程中,细胞对核酸的需求量明显减少,然而TSN与核酸合成的关系尚鲜有报道。
CTP合成酶(CTP synthase, CTPS)是生物体内合成CTP途径中的关键限速酶,在DNA、RNA的合成以及磷脂代谢过程中起着重要作用,对细胞增殖具有一定的影响[5]。在肿瘤细胞中,CTPsyn表达水平升高并且与细胞增殖能力增加有关[6]。当CTPS表达升高时其在细胞内可以形成一种保守的无膜丝状结构,该丝状结构被命名为“细胞蛇”[7]。目前为止,研究表明有多种代谢酶均可形成细胞蛇结构,例如从头合成尿苷三磷酸(GTP)的限速酶肌苷一磷酸脱氢酶(IMPDH)、乙酰辅酶A羧化酶等[8-10]。DON(6-重氮-5-氧代-L-正亮氨酸)是一种谷氨酰胺类似物,其可以有效地诱导CTPS形成细胞蛇结构[8]。MPA(抑制剂霉酚酸)是一种广泛使用的免疫抑制剂,其可以诱导IMPDH形成细胞蛇结构[11, 12]。在人肝癌细胞中有CTPS细胞蛇的存在[13]。当TSN诱导胃癌细胞凋亡时,核酸的需求量降低,CTPS是否会组装成CTPS细胞蛇进而降低CTPS酶的活性尚不清楚。
原癌基因c-Myc(MYC)参与肿瘤发生中异常的核苷酸合成。已有研究证明,在多种癌细胞中MYC基因的表达水平均升高[14]。研究表明,在果蝇的卵泡细胞中MYC表达升高时诱导CTPsyn形成CTPS细胞蛇[6];川楝素对胃癌细胞中MYC基因表达的影响尚不清楚,是否通过改变MYC基因的表达影响胃癌细胞中CTPS细胞蛇的形成尚鲜有报道。因此本实验以人胃癌细胞MKN-45为研究对象,探讨川楝素、MYC与胃癌细胞中CTPS细胞蛇之间的关系,以期为有效治疗胃癌提供新的思路。
1 材料与方法
1.1 细胞与抗体
人胃癌细胞MKN-45购于北纳生物有限公司,CTPS一抗和二抗Alexa Fluor 488-conjugated goat anti-rabbit-IgG购自北京博奥森生物技术有限公司。
1. 2 主要试剂
川楝素购自北京索莱宝科技有限公司。DON、MPA购自Sigma公司。DAPI染液购自生工生物工程(上海)股份有限公司。RPMI-1640培养基购自Gibco公司。4%多聚甲醛、CCK-8试剂盒、抗荧光淬灭封片液购自碧云天生物公司。胎牛血清购自Biological Industries Israel Beit-Haemek Ltd公司。
1.3 细胞培养
选用含有20 %胎牛血清的1640培养基,于37 ℃、5 % CO2饱和湿度培养箱中培养MKN-45细胞。
1.4 诱导CTPS细胞蛇形成
配制1 mmol/L DON和1 mmol/L MPA分别作用MKN-45细胞6 h,然后利用免疫荧光对CTPS细胞蛇的形态进行检测。
1.5 CTPS细胞蛇形成检测
取对数生长期的MNK-45细胞,转移至含有细胞爬片的孔板中,根据具体需要处理细胞一段时长后,吸去培养基,加入2 ml的PBS清洗细胞1~2次后弃液体,然后加入2 ml 4%-多聚甲醛4℃固定30 min。用PBST(PBS+曲拉通X-100)于4℃摇床清洗细胞3次,每次5 min;加入2 ml 封闭液(PBST+牛血清白蛋白)于室温封闭1 h;加入10 μl CTPS一抗于湿盒中4℃孵育过夜。加入2 ml PBST清洗细胞,弃液体后加入10 μl二抗于室温避光孵育1 h;冲洗细胞后加入50 μl DAPI染液室温避光孵育3 min,冲洗细胞后将细胞爬片扣放在滴有抗荧光淬灭封片液的载玻片上,避光保存。利用Leica TCS SP8激光共聚焦显微镜观察CTPS细胞蛇形态。
1.6 细胞增殖能力检测
取对数生长期的MNK-45细胞,加入终浓度为0 nmol/L、20 nmol/L、40 nmol/L、60 nmol/L、80 nmol/L、100 nmol/L的TSN,分别培养24 h、48 h、72 h。利用CCK-8试剂盒在酶标仪在波长为450 nm时的吸光度(D)值,通过公式:细胞存活率=[(实验组平均D值-空白组平均D值)/(对照组平均D值-空白组平均D值)]×100%,计算得出细胞存活率。
1.7 qRT-PCR检测MYC基因表达
取对数生长期的MNK-45细胞,加入终浓度为80 nmol/L的TSN分别作用细胞24 h、48 h、72 h;收集细胞提取总RNA,并反转录成cDNA。反应体系为25 μl Hotstart Fluo-PCR mix、21 μl ddH2O、2 μl cDNA和上下游引物各1 μl。MYC基因上游引物序列为:5’-GGG AGG CTA TTC TGC CCA TT-3’,下游引物序列为:5’-GCG GGA GGC TGG TTT TCC-3’;内参基因β-actin上游引物序列为:5’-TCA CCC ACA CTG TGC CCC ATC TAC GA-3’,下游引物序列为:5’-CAG CGG AAC CGC TCA TTG CCA ATG G -3’,采用2-ΔΔCt计算基因相对表达量。
1.8统计学处理
2 结果
2.1 MKN-45细胞中可形成CTPS细胞蛇
分别用DON 和MPA处理后细胞中CTPS可形成丝状的细胞蛇结构(图1,单线箭头所示)。此外还观察到少量环状或C状CTPS细胞蛇(双线箭头所示),CTPS细胞蛇可在细胞质和细胞核中形成(三角箭头所示,图1,见彩图页Ⅰ)。
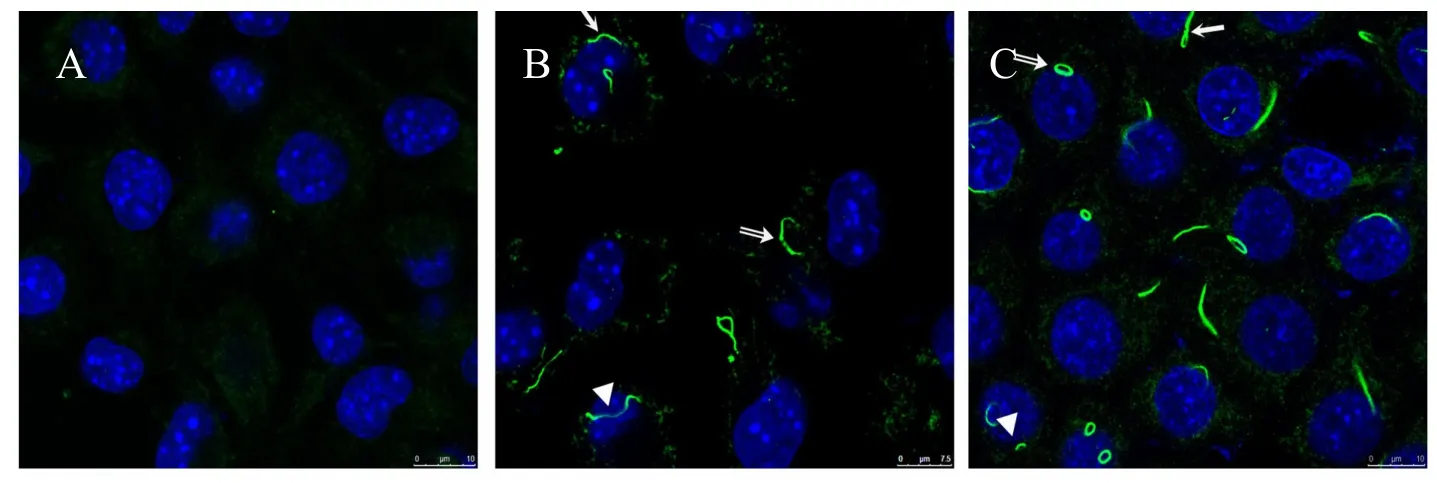
Fig.1 The morphology of CTPS cytoophidia in MKN-45 cell(Scale bar=10 μm)
2.2 TSN对胃癌细胞生长及CTPS细胞蛇形成的影响
2.2.1 TSN对胃癌细胞生长的影响 TSN在浓度为20~100 nmol/L之间可显著抑制 MKN-45细胞的生长。如表1所示,随TSN药物浓度的增加细胞增殖率呈下降趋势,而且培养时间越长抑制效果越明显,呈浓度一效应依赖关系。

Tab. 1 The effects of TSN on the proliferation rate of MKN-45 cell (%, n=3)
2.2.2 TSN对CTPS细胞蛇形成的影响 分别利用终浓度为0 nmol/L、60 nmol/L、80 nmol/L、120 nmol/L的TSN处理细胞72 h后,利用免疫荧光检测然后通过激光共聚焦显微镜观察CTPS细胞蛇形成情况,结果如图2所示。与对照组相比不同浓度的TSN均可诱导CTPS形成细胞蛇,其中浓度为80 nmol/L的TSN诱导形成的CTPS细胞蛇数量最多(图2,见彩图页Ⅱ)。
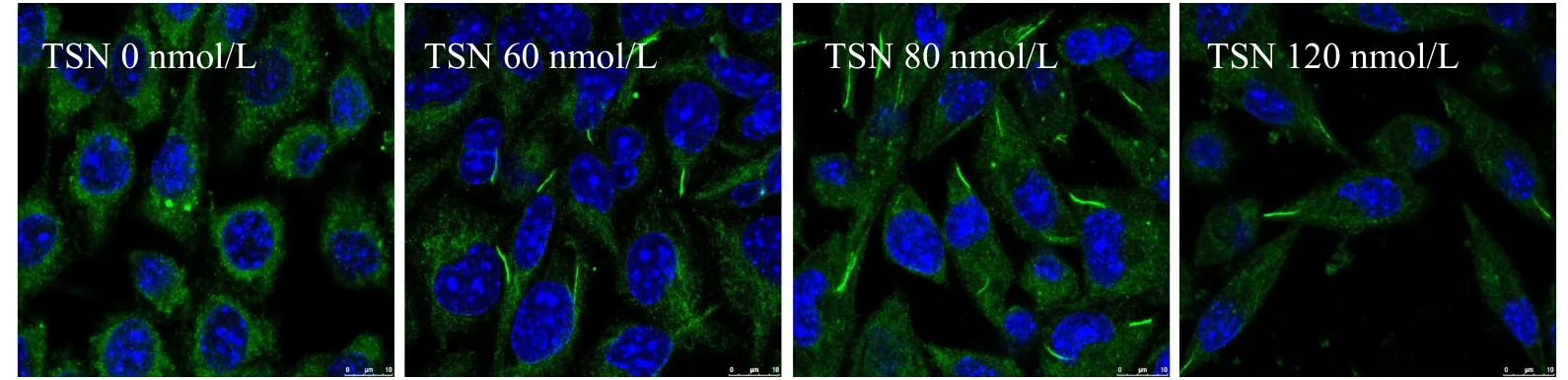
Fig.2 The effects of TSN on the CTPS cytoophidia of MKN-45 cell(Scale bar=10 μm)
2.2.3 TSN处理不同时间对CTPS细胞蛇形成的影响 利用终浓度为80 nmol/L 的TSN分别处理细胞24 h、48 h、72 h;然后利用免疫荧光检测然后通过激光共聚焦显微镜观察细胞内CTPS细胞蛇形态,结果如图3所示。随时间的延长,细胞中的CTPS细胞蛇数量逐渐增加(图3,见彩图页Ⅱ)。
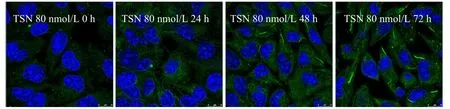
Fig.3 The effects of 80 nmol/L TSN on the CTPS cytoophidia of MKN-45 cell(Scale bar=10 μm)
2.3 TSN对MYC基因表达的影响
80 nmol/L TSN作用细胞24 h后MYC基因mRNA相对表达量为0.350±0.023,与对照组相比MYC mRNA表达明显降低(P<0.05);作用细胞48 h后MYC基因mRNA相对表达量为1.647±0.068(P<0.05),与对照组相比MYC mRNA表达明显升高(P<0.01);作用细胞72 h后MYC基因mRNA相对表达量为1.106±0.024(P<0.05),与对照组相比MYC mRNA表达无明显差异。
3 讨论
目前,天然产物在抑制肿瘤细胞增殖方面取得了较为显著研究进展,例如白扁豆多糖可抑制细胞增殖,并通过Bax-Bcl-2-caspase3 通路诱导人胃癌细胞发生凋亡[15]、杨芽黄素可通过影响TRAIL和PI3K/AKT信号通路诱导前列腺癌细胞凋亡[16]、黄芩素可能通过抑制ERK-FAK信号通路抑制口腔鳞癌细胞的增殖以及侵袭[17]。川楝素(TSN)从楝属植物根皮中提取的一种三萜化合物,具有杀虫,镇痛和抗炎的特性,此外,研究表明,TSN对癌细胞存活和增殖至关重要的多种途径具有抑制作用[18, 19]。川楝素可促进肺癌细胞发生凋亡抑制细胞的增殖[20],呈剂量与时间依赖性。本研究表明,TSN明显抑制了MKN-45细胞的增殖,但川楝素影响细胞存活和增殖的机制尚不十分清楚。
细胞蛇代表了一种新型的细胞内区室,其在生物中参与细胞代谢。细胞蛇第一个已知的组分是CTP合酶,该酶是以谷氨酸作为N源,将UTP和ATP从头形成CTP的关键限速酶[5]。CTPS活性与某些疾病密切相关,例如在白血病、肝癌和结肠癌等癌细胞中CTPS活性明显升高[10]。在果蝇癌症模型中敲低CTPS可减少肿瘤形成,这表明CTPS在癌症代谢中具有功能性作用[21]。在酿酒酵母细胞中CTPS聚合形成细胞蛇后增加CTPS的酶活性[22]。在体外培养的哺乳动物细胞内,当CTPS聚合形成细胞蛇时CTPS的催化活性被抑制[23]。本实验结果表明,不同浓度的TSN可诱导CTPS形成细胞蛇,浓度为80 nmol/L的TSN处理组中细胞蛇形成效果最为显著,而浓度为120 nmol/L的TSN处理组中细胞蛇数量明显减少,其可能原因是TSN浓度过高导致细胞死亡明显,存活的细胞较少从而影响细胞蛇的形成。为了进一步验证最佳作用时间,本实验利用浓度为80 nmol/L的TSN分别处理细胞24 h、48 h、72 h,实验结果显示,TSN作用72 h时细胞中细胞蛇数量明显多于其余实验组,但TSN诱导CTPS形成细胞蛇的可能机制尚不清楚。
碱性螺旋-环-螺旋转录因子MYC(c-Myc)是癌基因和关键的发育调节因子。c-Myc在许多不同肿瘤中表达上调,参与多达80%的人类癌症[14]。同样,CTPsyn水平在肿瘤细胞中经常显示为升高状态,并且中国仓鼠肿瘤中CTPsyn基因座内的聚集突变与增殖能力增加有关。已有研究表明,CTPS启动子上具有MYC的结合位点[24],而CTP syn表达水平影响着CTPS细胞蛇的形成。进一步研究表明,MYC表达量升高促进CTPS细胞蛇的组装[6]。为了研究MYC在TSN诱导CTPS细胞蛇形成中的作用,本实验检测了TSN作用不同时间MYC mRNA的表达变化,结果表明TSN作用24 h其表达下降,可能是由于TSN作用初期细胞增殖被抑制而MYC又参与癌细胞的核酸合成,因此该基因的表达有所降低,此时CTPS细胞蛇的形成并不明显。TSN作用48 h时细胞中CTPS细胞蛇的数量增多,同时MYC的表达升高,原因可能是MYC促进CTPS基因的表达进而加快CTPS细胞蛇的组装。但当TSN作用72 h时MYC的表达升高恢复到原有水平,可能是由于CTPS细胞蛇数量达到一定程度并且细胞凋亡现象明显,此时不需要MYC的辅助调节。
综上所述,TSN抑制胃癌细胞增殖,其通过调节MYC基因的表达进而影响CTPS细胞蛇的形成。而CTPS细胞蛇在胃癌细胞增殖中的具体作用仍需进一步研究,可为癌症治疗提供新思路。
