多囊卵巢综合征患者身体成分分析的临床价值
2020-03-19周文杰浦丹华陶新城从静常小霞夏静吴洁
周文杰,浦丹华,陶新城,从静,常小霞,夏静,吴洁
(南京医科大学第一附属医院/江苏省人民医院,江苏省妇幼保健院,南京 210029)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是多发于青春期和育龄期女性的内分泌和代谢性疾病,病因复杂,发病率占育龄妇女的5%~10%[1]。常见临床表现为月经紊乱、高雄激素体征或雄激素水平升高、不孕等,可伴有肥胖、胰岛素抵抗、血脂紊乱等代谢异常,是2型糖尿病、心脑血管疾病和子宫内膜癌发病的高危因素[2-3]。
流行病学数据显示,PCOS患者中超重、肥胖比例高达50%,且多以腹型肥胖为主[4-7]。体重指数(body mass index,BMI)是反映人体营养状况及评估和诊断肥胖程度的指标,但不能准确反映人体肌肉、脂肪组织等成分的比例,在临床应用中存在局限性。生物电阻抗法(bioelectrical impedance analysis,BIA)对身体成分的分析可更准确地评估患者的体型、脂肪含量、体脂肌肉比例等营养状况。本文通过对PCOS患者及正常对照女性进行身体成分分析,比较两组对象一般情况、体脂肪相关指标(全身脂肪含量、内脏脂肪面积、体脂率)、细胞外水分率、骨骼肌及骨矿物质含量等,探讨PCOS患者的体型、脂肪分布及营养状况等对疾病的影响,以更好地指导临床实践中PCOS患者的治疗及健康管理。
资料与方法
一、研究对象
收集2018年6月至2019年8月在江苏省人民医院/江苏省妇幼保健院妇科内分泌门诊就诊的PCOS患者123例(PCOS组),初诊年龄20~35岁,以及同期月经正常、年龄匹配的生育年龄女性121例(对照组)。收集研究对象的一般情况及临床特征,并进行身体成分测定。本研究经江苏省人民医院伦理委员会批准,患者均签署知情同意书。
二、研究方法
1.育龄期PCOS诊断标准:根据2011年中国PCOS的诊断标准[8],符合以下条件:(1) 疑似PCOS:月经稀发或闭经或不规则子宫出血是诊断的必需条件,并且符合以下2项中的1项:①高雄激素表现或高雄激素血症;②超声表现为多囊卵巢(polycystic ovarian morphology,PCOM)。(2)确诊PCOS:具备上述疑似PCOS诊断条件后还须排除其他可能导致高雄激素和排卵异常的疾病才能确定PCOS的诊断。
2.人体测量指标:晨起空腹测定身高、体重及BMI。BMI=体重(kg)/身高(m)2,参照中国肥胖问题工作组数据汇总分析协作组提出的分类,BMI<18.5 kg/m2为体重过轻,18.5≤BMI<23.9 kg/m2为正常,24≤BMI<27.9 kg/m2为超重,BMI≥28 kg/m2为肥胖[9]。
3.身体成分测定:采用人体成分分析仪(InBody S10),以BIA为原理进行身体成分测定。分析仪为八电极,多频率(1、50、100、250和500 kHz),800 μA交流电,对人体进行分段测定,同时测定电阻和电抗,得到四肢和躯干各部位的肌肉、脂肪组织比例,区分细胞内、细胞外的水分。测试期间,受试者需保持安静,禁止进行剧烈的或对抗性动作,所有操作均由营养专科医师进行。
三、统计学分析
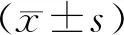
结 果
一、两组患者一般情况比较
两组患者的年龄、身高及体重均无统计学差异(P>0.05);PCOS组123例,其中超重及肥胖患者94例(76.42%);对照组121例,其中超重及肥胖患者91例(75.21%)。采用Pearson卡方检验,显示两组超重及肥胖的发生率无统计学差异(P>0.05),但PCOS组患者的BMI、体脂相关指标(全身脂肪含量、内脏脂肪面积、体脂率)均显著高于对照组(P<0.05),两组对象的骨骼肌含量、细胞外水分率及骨矿物质含量未见明显差异(P>0.05)(表1)。
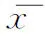
表1 两组患者一般情况及身体成分比较(±s)
注:与对照组比较,*P<0.05;VFA:内脏脂肪面积;ECW:细胞外水分;TBW:身体总水分;ECW/TBW:细胞外水分率;BMC:骨矿物质含量;BMR:基础代谢率
二、根据BMI分层比较PCOS患者与对照组身体成分情况
将BMI<24 kg/m2的PCOS患者29例与对照组30例进行比较,结果显示PCOS组的BMI、体脂相关指标(全身脂肪含量、内脏脂肪面积、体脂率)仍明显高于对照组(P<0.05),两组对象的骨骼肌含量、细胞外水分率及骨矿物质含量未见明显差异(P>0.05)(表2)。将BMI≥24 kg/m2的94例PCOS患者与91例对照组妇女进行比较,显示PCOS组的BMI、全身脂肪含量及内脏脂肪面积显著高于对照组(P<0.05),腰臀比、体脂率、骨骼肌含量、细胞外水分率及骨矿物质含量未见明显差异(P>0.05)(表3)。
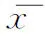
表2 BMI<24 kg/m2 PCOS组与对照组身体成分比较(±s)
注:与对照组比较,*P<0.05
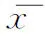
表3 BMI≥24 kg/m2 PCOS组与对照组身体成分比较(±s)
注:与对照组比较,*P<0.05
讨 论
传统上应用BMI评估患者体型和体脂分布存在一定局限性。人体成分分析仪通过BIA法测定人体肌肉和脂肪组织等不同成分的含量,并得到内脏脂肪面积、腰臀比、体脂率等数据,与BMI相比,可更好地用于体型判断、营养状况评定和某些疾病的预后判断。本研究结果显示,PCOS患者与对照组的年龄、身高及体重均无统计学差异,但BMI明显高于对照组;身体成分分析显示,PCOS患者中超重及肥胖的发生率较高,其全身脂肪含量及体脂率均明显高于对照组,且主要为中心性肥胖,表现为内脏脂肪面积与腰臀比增加。即使是BMI在正常范围内的PCOS患者,与对照组相比,仍具有较高的全身脂肪含量、内脏脂肪面积和体脂率。因此,仅依靠BMI来评估身体健康状况不完全可靠,应结合身高、体重、BMI及身体成分分析结果多指标综合评估。
PCOS患者中超重和肥胖,尤其是腹型肥胖的发生率较高。前期研究表明,雄激素易致腹部脂肪组织堆积[10-11]。此外,中心性脂肪的堆积可诱发胰岛素抵抗(insulin resistance,IR)和高胰岛素血症,而胰岛素又可进一步刺激卵巢雄激素的产生,加重高雄激素血症。研究证实,与BMI相似的对照组妇女相比,PCOS患者脂肪组织中含有较多不典型形态的脂细胞,其功能也存在明显异常,主要表现为胰岛素刺激下的葡萄糖摄取能力下降[12-13]。另一项针对PCOS患者的研究显示,无论是否存在超重或肥胖,胰岛素在脂肪细胞中刺激葡萄糖利用的反应性和敏感性均有所降低,主要表现为葡萄糖转运蛋白4(GLUT4)表达下降引起的葡萄糖转换率的降低[14-15]。
在临床中存在较高比例的正常体重PCOS 患者合并IR。一项针对亚裔 PCOS 人群的研究发现,胰岛素受体基因 Exon17+168 715 C>T(1 058位点)的多态性频率明显升高,并且在非肥胖亚组中差异更加明显,提示“瘦型”PCOS可能具有特殊的遗传表型[16]。对PCOS患者的另一项系统评价表明,PCOS患者中代谢综合征的发病率高于对照组女性,且其发病率与肥胖的严重程度相关[17]。腹部皮下脂肪和内脏脂肪含量与IR、炎症、代谢综合征以及心血管疾病的发病风险呈正相关[18-19]。腹型肥胖,尤其是内脏脂肪的过度堆积,对代谢性疾病和心血管疾病发病风险的预测价值更高。
PCOS确切的发病机制目前尚不清楚,可能由遗传、炎症、心理因素和社会环境等多方面的共同作用导致[20]。PCOS患者的治疗不能只考虑月经和生育方面的问题,还要关注其远期并发症的预防,针对PCOS人群建立长期个性化的健康管理方案,对与并发症有关的临床指标做到定期随访,达到疾病诊治和预防相结合的目的。
另外,由于内分泌紊乱、体形变化、不孕等多方面因素的作用,造成PCOS患者的心理负担加重,生命质量降低。研究发现,PCOS患者在心态上易产生抵触、烦躁焦虑、抑郁等情绪,甚至出现病态心理,严重影响女性的自信心和尊严感,进一步影响到家庭生活和社会交往等[21-22]。对于有暴饮暴食、自卑、有形体担忧的肥胖PCOS患者,通过有效的生活方式干预和减脂指导,并提供良好的社会支持,可改善患者的心理状态,避免产生形体焦虑。
综上所述,本研究结论初步提示PCOS患者的体脂含量明显高于对照组,尤其是内脏脂肪的增加,这可以导致IR。无论BMI正常与否,都建议PCOS患者进行身体成分检测,以此为依据做出生活方式的调整和体脂管理,对改善PCOS患者的内分泌环境及远期并发症均有重要的临床意义。
