早期妇科肿瘤术后患者IVF治疗的临床观察分析
2020-03-19李颖纪亚忠石礼红
李颖,纪亚忠,石礼红
(同济大学附属同济医院生殖医学中心,上海 200065)
随着细胞学筛查、妇科超声、磁共振等诊断技术的进步以及人们保健意识的增强,早期妇科肿瘤患者的生存率逐渐提高,预后获得了明显改善。经积极治疗后的早期宫颈癌(IA~IB1)患者5年无病生存率>85%[1-2],卵巢交界性肿瘤和生殖细胞肿瘤患者的5年无病生存率高达90%以上[3],整体存活率接近100%[4]。另一方面,妇科肿瘤的发病率逐年提高并呈年轻化趋势,而随着现代社会发展生育年龄却不断被推迟,越来越多的女性在确诊肿瘤时尚未完成生育计划。妇科肿瘤手术和放化疗如同“双刃剑”,在减灭肿瘤的同时,对女性的卵巢功能乃至生育能力产生显著不良影响,患者接受治疗后常合并不孕,因此,妇科恶性、交界性肿瘤年轻患者治疗后的生育问题值得我们共同关注和重视。本文收集了2013年8月至2019年8月在本中心接受体外受精-胚胎移植(IVF-ET)助孕的早期妇科肿瘤保留生育功能术后患者5例,包括宫颈癌2例、卵巢交界性肿瘤、未成熟畸胎瘤及无性细胞瘤各1例,并根据年龄、体重指数(BMI)等在同时期个体匹配10例无手术史不孕症患者作为对照组,比较两组患者的基本资料、促排卵情况、胚胎培养结果及临床结局。并将肿瘤术后组中成功分娩的4例患者分为宫颈癌术后和卵巢肿瘤术后两个亚组,与对照组的母胎预后情况进行比较分析。
资料与方法
一、研究对象及分组
肿瘤术后组纳入了2013年8月至2019年8月在本中心接受体外受精-胚胎移植(IVF-ET)助孕的早期妇科肿瘤术后合并不孕症患者5例,包括宫颈癌3例、卵巢交界性肿瘤、未成熟畸胎瘤及无性细胞瘤各1例。5例患者均进行了保留生育功能的手术治疗,其中2例宫颈癌IB1期患者行广泛宫颈切除+盆腔淋巴结清扫术,病理均为鳞癌;1例交界性肿瘤患者行患侧附件切除术,病理为交界性浆液性肿瘤,术后予以紫杉醇/卡铂(TC)方案腹腔内化疗1个疗程;2例卵巢生殖细胞肿瘤患者均行双侧卵巢肿瘤切除术,术后病理分别为未成熟畸胎瘤和无性细胞瘤,后者术后予以博来霉素/依托泊苷/顺铂(BEP)方案化疗3个疗程。5例患者均无复发,其中4例患者成功分娩,按肿瘤类型分为宫颈癌术后和卵巢肿瘤术后两个亚组,每组各2例患者。
对照组为与肿瘤术后组患者同时期、既往无手术史的IVF患者,按年龄、BMI等与肿瘤术后组中患者进行个体匹配,匹配比例为1∶2。
二、IVF促排卵方案
1.自然周期取卵:在月经周期的第9或第10天,阴道超声监测卵泡自发生长情况,当卵泡直径达到14 mm左右时,每日监测血LH、E2、P,卵泡直径达到18 mm或LH峰出现时予人绒毛膜促性腺激素(HCG,珠海丽珠制药)4 000~6 000 U扳机,34~36 h后行取卵术。
2.微刺激方案:月经周期第2~5天开始口服枸橼酸氯米芬(CC,法地兰,高特制药,塞浦路斯)100 mg/d,第5天始加用促性腺激素(gonadotropins,Gn),Gn种类包括注射用尿促卵泡素(丽申宝,珠海丽珠制药)和人绝经期促性腺激素(HMG,乐宝得,珠海丽珠制药)两种药物,启动剂量为75~150 U/d,CC和Gn均至扳机日停止,根据当日血清E2水平,注射HCG 4 000~8 000 U扳机,34~36 h后行取卵术。
3.拮抗剂方案:于月经周期第2~3天检测女性基础激素水平、阴道超声监测窦卵泡数目,Gn启动剂量为150~300 U,在Gn使用的第5~6天根据激素水平及卵泡生长情况,当最大卵泡平均直径达到13~14 mm或者血清E2水平达到1 480 pmol/L添加拮抗剂注射用醋酸西曲瑞克(思则凯,百特,德国)0.25 mg/d,当有2个主导卵泡平均径线达到18 mm或3个卵泡平均径线达到17 mm以上时,根据当日血清E2水平,注射HCG 4 000~8 000 U扳机,34~36 h后行取卵术。
4.长方案:于促排前一周期的黄体中期,应用长效促性腺激素释放激素激动剂(注射用醋酸亮丙瑞林,贝依,珠海丽珠制药)1.25~3.75 mg,皮下注射。于降调第14天检测女性激素水平及阴道超声监测窦卵泡数目、大小和子宫内膜厚度以确定是否达到降调节标准,Gn启动剂量为150~225 U,用药的第4~6天及以后每天或隔天通过阴道超声监测卵泡发育,同时检测女性激素水平。依照卵泡发育速度和血清E2水平上升的情况来调整药物剂量。当有2个优势卵泡平均径线达到18 mm或3个优势卵泡平均径线达到17 mm以上时,根据当天血清E2水平,注射HCG 4 000~8 000 U扳机,34~36 h后行取卵术。
三、FET内膜准备方式和黄体支持
FET的内膜准备方式按照本科室常规进行,主要为自然周期(natural cycle,NC)和激素替代周期(hormone replacement treatment,HRT)两种方案;当阴道超声提示子宫内膜厚度≥8 mm时转化内膜准备移植,3 d后解冻分裂期胚胎,5 d后解冻囊胚。NC方案排卵后予以口服地屈孕酮(达芙通,雅培,美国),10 mg,3次/d;HRT周期为月经第3天起口服雌二醇地屈孕酮片红片(芬吗通,雅培,美国)2~3 mg,2次/d×14 d,检测至内膜达标后进行内膜转化,改黄片2~3 mg,2次/d,联合黄体酮阴道缓释凝胶(雪诺同,默克雪兰诺,瑞士)90 mg,1次/d,均用至移植后14 d查血HCG,阳性者移植28 d行阴道超声,见孕囊及原始心管搏动者为临床妊娠,继续黄体支持用药至移植后72 d。
四、观察及随访指标
观察指标包括:用药方案、Gn用量、获卵数、有效胚胎数、临床妊娠率、活产率。所有患者均电话、微信随访至2019年9月1日,并嘱患者定期行盆腔B超和妇科检查,妇科门诊就诊排除肿瘤复发。随访内容:产式、喂养方式、哺乳时间、转经时间、新生儿体重、有无畸形。
五、统计学方法
结 果
一、基本资料比较
本研究共纳入15例研究对象,肿瘤术后组5例,对照组10例。两组患者间年龄、BMI、不孕年限和基础性激素水平均无统计学差异(P>0.05),肿瘤术后患者窦卵泡数显著少于对照组,差异有统计学意义(P<0.01)(表1)。
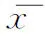
表1 肿瘤术后组与对照组基本资料比较(±s)
注:与对照组相比较,**P<0.01
二、促排情况比较
肿瘤术后组5例患者共行9个助孕周期(即取卵周期),对照组10例患者共行10个取卵周期,肿瘤术后组的促排卵方案主要采用自然周期(44.4%)和微刺激方案(33.3%),对照组主要采用长方案(80%);与对照组相比,肿瘤术后组的Gn天数和Gn总量均显著减少,差异有统计学意义(P<0.01)(表2)。
三、获卵及胚胎发育情况比较
与对照组相比,肿瘤术后组的获卵数、可用胚胎数、优质胚胎数显著减少,差异具有统计学意义(P<0.01);两组的受精率、卵裂率、优胚率无统计学差异(P>0.05)(表3)。
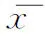
表2 肿瘤术后组与对照组促排情况比较[(±s),%]
注:与对照组相比较,**P<0.01
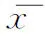
表3 肿瘤术后组与对照组获卵及胚胎发育情况比较[(±s),%]
注:与对照组相比较,**P<0.01
四、临床结局及母胎预后比较
肿瘤术后组共进行了6个移植周期,其中鲜胚移植周期占33.3%(2/6),冻胚移植周期占66.7%(4/6),每周期平均移植(1.83±0.41)枚胚胎,4个周期实现临床妊娠:2例单胎、2例双胎,均活产,无流产。对照组共进行了15个移植周期,其中鲜胚移植周期占26.7%(4/15),冻胚移植周期占73.3%(11/15),每周期平均移植(1.80±0.41)枚胚胎,11个周期实现临床妊娠:1个周期流产、10个周期活产(7例单胎、3例双胎)。两组的移植方式、平均移植胚胎数、妊娠率、流产率、活产率均无统计学差异(P>0.05)(表4)。
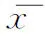
表4 肿瘤术后组与对照组移植及临床结局比较[(±s),%]
两组母胎预后分析显示,与对照组相比较,肿瘤术后组的分娩孕周、单胎出生体重、双胎出生体重显著降低,差异有统计学意义(P<0.05);两组的分娩方式、哺乳时间、产后转经和随访时间的差异均无统计学意义(P>0.05)(表5)。
宫颈癌术后亚组、卵巢肿瘤术后亚组和对照组的母胎预后分析显示,与对照组和卵巢肿瘤术后亚组相比,宫颈癌术后组的分娩孕周、哺乳时间和转经时间显著降低,早产率显著升高,均有统计学差异(P<0.05)(表6)。
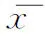
表5 肿瘤术后组与对照组母胎预后比较[(±s),%]
注:与对照组相比较,*P<0.05
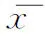
表6 宫颈癌术后与卵巢肿瘤术后亚组母胎预后比较[(±s),%]
注:与对照组相比较,*P<0.05;与卵巢癌术后亚组相比较,#P<0.05;a:其中1例宫颈癌术后患者因产后出血切除子宫,故无转经
讨 论
目前,妇科肿瘤发病率逐年上升并呈年轻化趋势。在宫颈癌患者中,35岁以下的患者占2%[5],45岁以下的患者占38.5%[3];卵巢肿瘤患者中,35岁以下的患者占1.5%~17%[5],20~40岁的育龄期妇女在卵巢交界性肿瘤中约占50%[6],恶性生殖细胞肿瘤在卵巢恶性肿瘤中占3%~5%,好发于青少年女性(<20岁)[7]。另一方面,晚婚晚育的社会趋势导致许多年轻女性在肿瘤治愈后仍未完成生育计划,因此早期妇科恶性、交界性肿瘤年轻患者治疗后的生育问题值得我们共同关注和重视。辅助生育技术能帮助接受了妇科肿瘤保留生育功能手术的不孕症患者实现生育愿望。
妇科恶性、交界性肿瘤对女性生育力的影响包括肿瘤对卵巢功能的破坏以及手术过程、放化疗对卵巢储备功能、生殖器官解剖结构和性功能的影响[8]。恶性肿瘤可通过调节内分泌及代谢影响卵母细胞质量从而损害生育力;同时,肿瘤患者携带的特定的突变基因也可能导致卵巢低反应[9]。盆腔手术可直接损伤卵巢组织及其血供从而影响卵巢储备功能。早期宫颈癌(IA2-IB1期)患者行广泛宫颈切除术虽保留了生育功能,但仍造成子宫解剖结构异常,导致不孕、流产、胎膜早破和早产等不良结局[10-11]。化疗药物可通过直接作用和下丘脑-垂体轴损伤卵巢功能,例如博来霉素、依托泊苷或4个周期的紫杉醇化疗均可造成患者中度风险不孕(永久闭经风险为40%~60%)[12]。本研究中早期妇科肿瘤术后组患者接受助孕治疗时平均年龄仅29.6岁,平均窦卵泡数则为4.4个,卵巢储备功能均较同龄女性明显减退。2例宫颈癌患者为鳞癌IB1期,均接受开腹广泛宫颈切除术治疗,一位宫颈癌患者术后6年至我科助孕治疗,发现宫颈管极短,宫颈口粘连,采取全麻下用Cook移植管金属内芯扩宫颈口后再行胚胎移植;另一位宫颈癌患者手术时间为2015年,较前位患者晚5年,宫颈管保留有一定长度,移植顺利,推测可能与手术技术进步有关;2例患者均提前分娩,可能与术后子宫解剖结构改变密切相关。2例卵巢肿瘤患者术后曾行化疗,其中卵巢交界性肿瘤患者行TC方案(紫杉醇+卡铂)腹腔化疗1个疗程,无性细胞瘤患者行BEP方案(博来霉素+依托泊苷+顺铂)化疗3个疗程,2例患者均于2008年接受手术和化疗,确诊年龄分别为22岁和17岁,开始助孕的年龄分别为27岁和28岁,窦卵泡数分别为5个和2个,与文献报道的化疗药物损害卵巢储备功能,且与剂量、类型、年龄相关性的观点相符[13-14]。
妇科恶性肿瘤保留生育能力的治疗方法主要有:保留生育功能的手术治疗、术中或术后生育力保存技术、术后的生育指导和辅助妊娠。目前卵巢生育力保存的生殖内分泌技术主要包括促性腺激素类似物(gonadotropin-releasing hormone agonist,GnRH-a)疗法抑制卵巢功能、胚胎冷冻、卵子冷冻、卵巢组织冷冻技术等[12,15]。胚胎冷冻技术目前已十分成熟,但因受到法律、宗教、伦理等多方面的限制,该技术目前只能应用于已婚患者,同时患者需在肿瘤治疗前接受促排卵治疗,因而可能延误患者治疗时机,而促排卵药物是否会对患者原发病产生影响,目前尚未定论。卵子及卵巢组织冻存技术可用于未婚及无性生活患者,但因其需要行阴道超声或手术治疗,患者接受度较低,目前国内尚未广泛开展。GnRH-a治疗不需促排卵及配偶参与、不影响治疗时机及方案、易于被患者接受,多项随机试验表明GnRH-a在化疗期间应用有保护卵巢功能作用,但具体机制尚不清楚,持续时间和对妊娠结局的影响仍有争议[16-17]。因此,妇科恶性、交界性肿瘤保留生育功能治疗愈后患者,若有生育要求,应及时进行生育指导,若合并不孕应积极助孕治疗。
肿瘤术后组共5例患者,其中4例进行了胚胎移植,共进行了6个周期,其中鲜胚移植周期占33.3%(2/6),冻胚移植周期占66.7%(4/6),4个周期实现临床妊娠并活产,无流产,双胎率50%,与对照组的活产率无显著差异,所有新生儿均未发现畸形,所有产妇至最后随访时间均无肿瘤复发。本研究的初步结果显示早期妇科肿瘤保留生育功能愈后患者IVF助孕有效且安全。2016年西班牙一项系统性回顾分析显示:妇科肿瘤患者经保留生育力治疗后,行IVF助孕能实现安全的妊娠[10];有文献研究表明,不孕症相关促排卵药物应用不增加卵巢癌、交界性肿瘤、宫颈癌风险[18]。本研究中两组患者的促排卵方案比较显示,对妇科肿瘤愈后患者应采取个体化的促排卵方案,伴卵巢功能减退的患者,自然周期和微刺激方案更为合适,助孕效果好且促排药物剂量较低,安全性更高。
国内外文献综述表明,宫颈根治术虽保留了生育功能,但可导致宫颈机能不全、晚期流产和早产的风险显著增加,宫颈环扎能起到一定的预防作用[19-20]。本研究结果显示宫颈癌术后亚组无论是与卵巢肿瘤亚组还是与对照组相比较,早产率高、分娩孕周较小、新生儿出生体重较低、哺乳和产后转经时间较短,且有统计学差异。本研究中两例宫颈癌愈后助孕患者均早产,其中单胎妊娠产妇产前多次阴道出血,单绒双羊分娩产妇因胎盘植入产后大出血行子宫动脉栓塞+子宫切除治疗,反思该产妇此次胎盘植入可能与之前9次流产史有关,本次为再婚,初婚时育有一女,现其所在家庭求子心切,本次分娩两名女婴,女方子宫切除后丧失生育功能,导致产后抑郁。遵照辅助生育技术中有利于患者、保护后代、伦理监督的原则,对此类情况特殊的高危患者应在充分评估患者的身心、家庭、孕期风险等全面情况的基础上,对夫妇进行充分的知情同意后,在伦理委员会的监督下开始助孕治疗,提倡单胚胎移植,注意与产科、胎儿医学科的会诊沟通,适时行宫颈环扎术,孕期和产后密切监护母胎情况,注重产妇心理疏导。
综上所述,早期妇科肿瘤保留生育功能术后合并不孕症患者行IVF助孕治疗有效且安全。由于妇科恶性或交界性肿瘤手术和术后放化疗可对女性患者的卵巢储备功能造成严重影响,对年轻患者应注重生育力的保护,术后合并不孕症患者应在充分全面评估和知情同意后采取积极助孕治疗。宫颈癌术后患者孕期应警惕产前和产后出血,加强孕期监护,延长孕周,改善母胎预后。
