种植体周围炎龈沟液中IL-1β、IL-6 和TNF-α 的表达
2020-03-19陈慧文张卫平陈景宜宋忠臣
陈慧文,胡 苡,张卫平,陈景宜#,宋忠臣#
1. 上海交通大学医学院附属第九人民医院· 口腔医学院牙周病科,国家口腔疾病临床研究中心,上海市口腔医学重点实验室,上海市口腔 医学研究所,上海 200011;2. 甘肃省兰州市口腔医院,兰州 730000
种植体周围炎是一种发生在口腔种植体周围组织的菌斑相关的病理状态,其临床特征表现为种植体周围黏膜出现炎症、探诊出血和/或溢脓、探诊深度(probing depth,PD)增加和/或黏膜边缘的退缩,影像学检查可观测到进行性的骨丧失[1]。种植体周围龈沟液的量及其细胞因子能够一定程度上反映种植体周围组织的炎症状况,可用于区别种植体周围组织的健康与疾病状态[2]。IL-1β、IL-6 和TNF-α 在炎症反应和免疫应答方面发挥着重要的作用,与种植体周围炎的发生、发展有密切联系。因此,本研究拟检测IL-1β、IL-6 和TNF-α 在种植体周围龈沟液中的含量并探讨其与种植体周围炎的关系。
1 资料与方法
1.1 临床资料
选择2019 年1 月—10 月在上海交通大学医学院附属第九人民医院牙周科就诊的种植修复患者24 例(共24 颗种植体);根据种植体周围情况,分为种植体周围炎组12 例[女5 例,男7 例,平均年龄(48.3±1.9)岁]和种植体周围健康组12 例[女8 例,男4 例,平均年龄(42.7±4.3)岁]。以该院行常规口腔检查的健康人群为健康天然牙对照组,共12 例[女7 例,男5 例,平均年龄(38.9±2.3)岁]。研究获得上海交通大学医学院附属第九人民医院伦理委员会审批(批号:SH9H-2019-T178-1),患者知情同意。
1.2 纳入标准
无全身系统性疾病;无吸烟、酗酒;未处于妊娠或哺乳期;纳入研究前6 个月内未进行任何抗生素、非甾体类药物及免疫抑制剂等药物治疗;种植修复体行使功能1 年及以上;种植体无咬合创伤。
1.3 诊断标准
1.3.1 种植体周围炎 轻柔探诊出血和/或探诊溢脓,PD ≥6 mm,以及以种植体骨内部分冠端为参照,牙槽骨吸收≥3 mm[3-4]。
1.3.2 种植体周围健康 种植体周围组织无炎症表现,探诊无出血,PD 不随时间的增加而增加,早期愈合后骨丧失水平<2 mm[5]。
1.3.3 健康天然牙 牙周组织无炎症表现,探诊无出血,无附着丧失及骨吸收。
1.4 PD 测量
种植体周探诊采用非金属牙周探针沿种植体长轴分别在颊(唇),舌面远中、正中、近中测量,每个种植体记录6 个位点的PD,取平均值。天然牙牙周探诊用UNC-15牙周探针探测指数牙(16、11、26、36、31、46),每个牙记录6 个位点,取平均值。
1.5 龈沟液采集和测量
每位受试者均备有1 支含1 mL 磷酸缓冲液(PBS)的1.5 mL EP 管及裁去尖端的灭菌吸潮纸尖(20 根/人)[6]。健康天然牙对照组每人取样至少6 颗牙(16、11、26、36、31、46),所选牙均无龋坏及牙髓、根尖病变,无咬合创伤。种植修复患者取样位点为种植体。小心去除待取部位的龈上菌斑、牙石,无菌干棉球隔湿;用气枪吹干牙面(10 s)后,将纸尖轻轻插入种植体或天然牙龈沟中,遇轻微阻力即止;30 s 后取出(收集过程中保证滤纸条不被血液、唾液及脓液污染;如被污染立即弃之不要,间隔20 min 后再取),游标卡尺测量并记录纸尖浸湿长度;将取完后的纸尖尽快放入相应EP 管封口,-80 ℃冻存[7]。
以移液枪吸取固定量的去离子水(0 ~2.0 μL,间隔0.1 μL),滴在无菌吸潮纸尖上,共20 组。测量滤纸浸湿长度,计算去离子水量和纸尖浸湿长度的标准曲线,以该标准曲线换算龈沟液体积[8]。
1.6 IL-1β、IL-6 和TNF-α 的检测
严格按照酶联免疫吸附试验(ELISA)试剂盒说明书检测IL-1β、IL-6 和TNF-α。所有试剂盒均由上海江莱生物科技有限公司提供。①取出冻存的龈沟液EP 管,室温下解冻;加入PBS 100μL,低温离心20 min(2 292×g,4 ℃)后取上清液;在ELISA 反应板上设标准孔,每孔加入50 μL 标准品(IL-1β 标准品质量浓度为0、20、40、80、160、320 pg/mL; IL-6 标准品质量浓度为0、10、20、40、80、160 pg/mL; TNF-α 标 准 品 质 量 浓 度 为0、40、80、160、320、640 pg/mL)。②分别设空白孔和待测样品孔,在样品孔中先加40 μL 样品稀释液,再加10 μL 待测样品,轻轻晃动摇匀。③每孔加入酶标试剂100 μL,空白孔除外;封板膜封板,37 ℃避光孵育60 min。④弃去液体,甩干,每孔加满洗涤液,静置30 s 后弃去,重复5 次,拍干。⑤每孔先后加入50 μL 显色剂A 液和50 μL 显色剂B 液,37 ℃避光孵育15 min。⑥每孔加入终止液50 μL 终止反应,此时蓝色变为黄色。⑦以空白孔调零,酶标仪检测吸光度[D (450 nm) ]。⑧以标准品浓度为横坐标,相应D (450 nm)值为纵坐标做标准曲线;根据标准曲线和稀释倍数计算各组样本的浓度。
1.7 统计学分析
2 结果
2.1 基本资料的比较
3 组受试者的年龄、性别构成比比较,差异无统计学意义(均P>0.05)。种植体周围炎组的PD 明显高于种植体周围健康组和健康天然牙对照组(均P<0.01);而种植体周围健康组与健康天然牙对照组的PD 比较,差异无统计学意义(P>0.05)。
种植体周围健康组和健康天然牙组的龈沟液量均显著低于种植体周围炎组(均P<0.01);种植体周围健康组的龈沟 液量高于健康天然牙组,差异有统计学意义(P<0.05)(表1)。
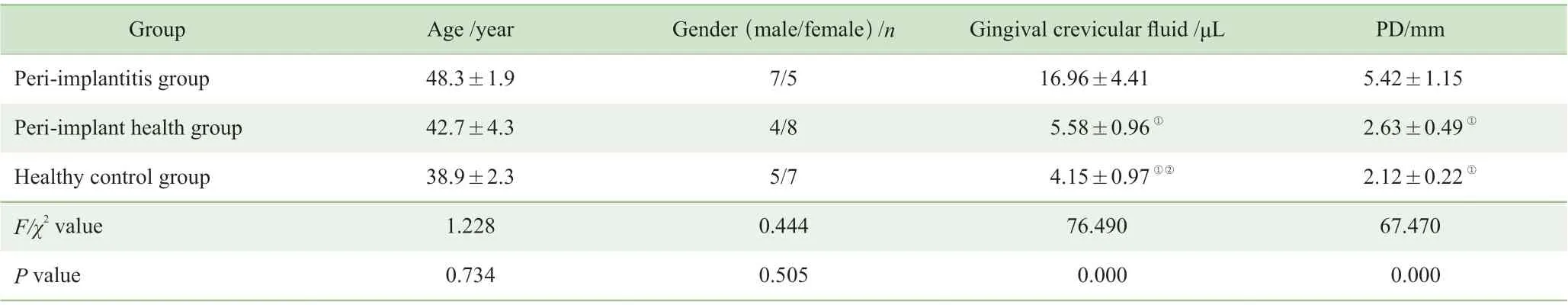
表1 3 组受试者的基本资料比较(n=12)Tab 1 Characteristics of basic data of the three groups (n=12)
2.2 各组龈沟液中IL-1β、IL-6 和TNF-α 含量比较
种植体周围炎组的IL-1β 和IL-6 含量均明显高于种植体周围健康组和健康天然牙对照组(均P<0.05),种植体周围健康组的IL-1β 和IL-6 含量均显著高于健康天然牙对照组(均P<0.05)。种植体周围炎组的TNF-α 表达水平与种植体周围健康组比较,差异无统计学意义(P>0.05);种植体周围健康组的TNF-α 含量高于健康天然牙组,但差异无统计学意义(P>0.05);种植体周围炎组的TNF-α含量显著高于健康天然牙对照组,差异有统计学意义(P<0.05)(表2)。
表2 各组龈沟液中IL-1β、IL-6 和TNF-α 含量比较(±s,n=12)Tab 2 Comparison of IL-1β, IL-6 and TNF-α levels in gingival crevicular fluid among different groups (±s, n=12)
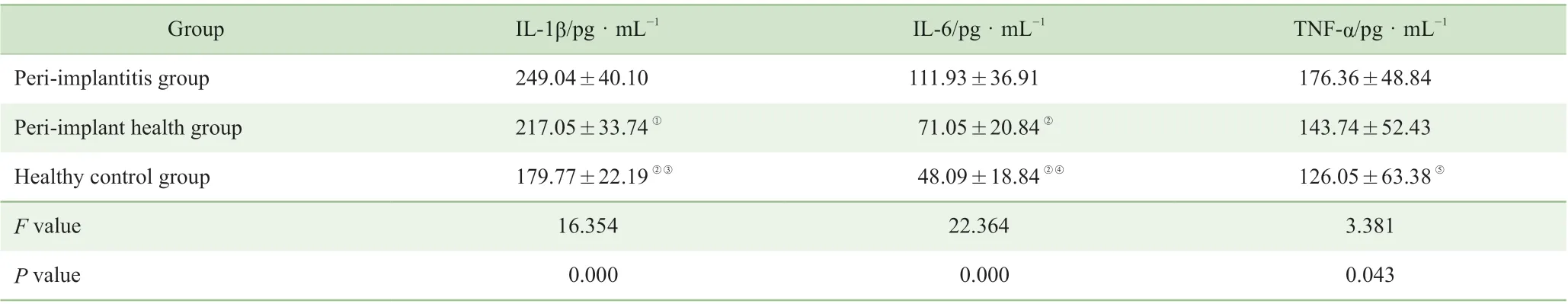
表2 各组龈沟液中IL-1β、IL-6 和TNF-α 含量比较(±s,n=12)Tab 2 Comparison of IL-1β, IL-6 and TNF-α levels in gingival crevicular fluid among different groups (±s, n=12)
Note: ①P=0.012, ②P=0.000, compared with peri-implantitis group; ③P=0.003, ④P=0.033, ⑤P=0.014, compared with peri-implant health group.
Group IL-1β/pg·mL-1 IL-6/pg·mL-1 TNF-α/pg· mL-1 Peri-implantitis group 249.04±40.10 111.93±36.91 176.36±48.84 Peri-implant health group 217.05±33.74① 71.05±20.84② 143.74±52.43 Healthy control group 179.77±22.19②③ 48.09±18.84②④ 126.05±63.38⑤F value 16.354 22.364 3.381 P value 0.000 0.000 0.043
2.3 龈沟液中IL-1β、IL-6 和TNF-α 的表达与龈沟液量和PD 的相关性分析
Pearson 相关性分析结果显示(表3),种植体周围炎组龈沟液中TNF-α 表达水平与PD 呈正相关(r=0.600, P=0.039)。
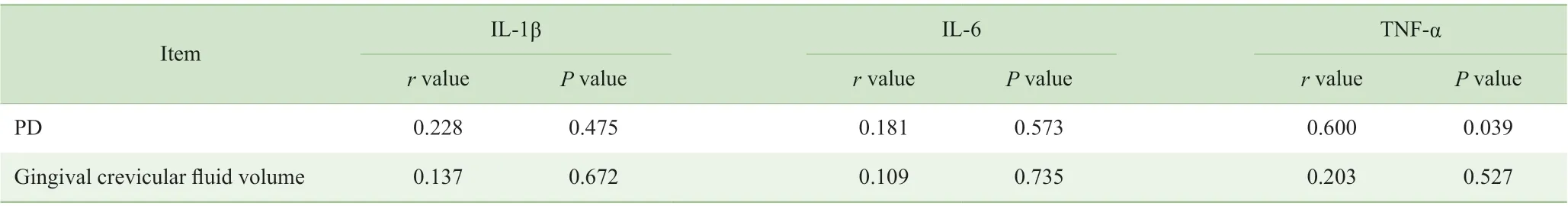
表3 种植体周围炎组龈沟液中IL-1β、IL-6 和TNF-α 表达与龈沟液量、PD 之间的相关性Tab 3 Correlation of IL-1β, IL-6 and TNF-α with gingival crevicular fluid volume and PD in peri-implantitis group
2.4 各组龈沟液量与PD 相关性分析
Pearson 相关性分析结果显示,各组龈沟液量与PD 呈正相关(r=0.819,P=0.000)。
3 讨论
种植体周围炎是发生在种植体周围组织的病理性状态,以种植体周围黏膜炎症及支持骨组织进行性吸收为特征[4]。大多数回顾性研究及动物实验发现,同牙周炎一样,黏膜下菌斑的持续形成会导致种植体周围严重的炎症和组织破坏[9-10]。宿主的免疫系统和致病菌在相互作用中会产生大量的细胞因子,这类细胞因子具有一定的免疫调节和效应功能,但其在种植体周围炎中的作用尚不明确。因此,细胞因子在种植体周围炎的发生、发展中的作用已受到口腔种植领域的重视。
目前,系统性回顾研究主要集中在种植体周围龈沟液检测到的各类细胞因子(如促炎、抗炎和破骨细胞生成相关因子)与趋化因子之间的关系[11]。IL-1β 是与种植体周围炎关系密切的重要炎症因子,可以抑制碱性磷酸酶的表达,抑制组织形成,激活破骨细胞,刺激破骨细胞产生前列腺素E2并导致牙槽骨丧失[12]。另外,IL-1β 还可以与其他炎症介质相互作用,如促进IL-6、TNF-α、细胞间黏附分子等细胞因子的表达,将炎症效应级联扩散,放大炎症反应,导致组织损伤加重。有研究[13]显示,种植体周围炎位点的IL-1β 表达水平较健康的种植位点显著增高,但种植体周围炎组与种植体周围黏膜炎组IL-1β 表达水平无显著差异。Schierano 等[14]研究表明,IL-1β 水平与种植体周围组织的炎症程度具有相关性;Sakai 等[15]发现IL-1β浓度与种植体周围骨组织的吸收有相关性,可作为检测种植体周围炎边缘骨吸收的敏感指标。本研究结果显示种植体周围炎位点的IL-1β 表达水平显著高于健康的种植位点和健康天然牙位点,且健康种植位点的IL-1β 也高于健康天然牙位点。该结果提示促炎症细胞因子IL-1β 参与了种植体周围炎症的发生、发展,可用于区别种植体周围健康和炎症状态[4]。
TNF-α 也是种植体周围炎研究的另一个关注焦点。种植体周围炎一个重要病理特征为炎症性骨吸收,主要与局部破骨细胞骨吸收功能亢进有关。目前认为TNF-α 介导骨吸收主要通过促进破骨细胞分化和抑制成骨细胞分化进行[16]。有研究[17-18]表明,种植体周围炎位点的TNF-α 水平较健康位点显著增高,这与本研究结果相似。TNF-α 含量与PD 呈正相关,PD 的增加提示种植体和周围组织的结合遭到了破坏,种植体周围炎症程度的加重,说明TNF-α表达水平与种植体炎症严重程度密切相关,可间接反映种植体周围组织健康状况。系统性研究[19]也提示,TNF-α可作为辅助标准帮助判断种植体周围炎症。另外,本研究中,种植体周围炎位点和健康种植体位点的TNF-α 水平无显著差异。TNF-α 能促进破骨细胞合成和减少骨基质钙化,促进骨质吸收,因此推测TNF-α 可能参与了种植体骨组织的改建。
与牙周炎相似,种植体周围位点的病变也以浆细胞和淋巴细胞为主;但多形核白细胞和巨噬细胞的比例较牙周炎组织更高,且浆细胞、巨噬细胞和中性粒细胞面积更广、数量更多、密度更高[18]。IL-6 主要由单核-巨噬细胞、淋巴细胞和内皮细胞在IL-1 和TNF-α 诱导下产生,可通过自分泌或旁分泌的方式在免疫应答方面发挥重要的作用,被认为是IL-1 和TNF-α 某些生物效应的放大因子[20]。有研究表明,IL-6 的表达水平与种植体周围炎活动期呈线性相关,且其水平随着病情加重而不断升高,其可上调破骨细胞中基质金属蛋白酶-3 的表达水平,促进牙槽骨吸收[21]。在犬种植体周围炎龈沟液中,IL-6 及TNF-α等炎症细胞因子参与了炎症过程,且与骨破坏相关,与天然牙周炎相似[22]。本研究结果显示,种植体周围炎症组龈沟液中的IL-6 水平与种植体周围健康组和健康天然牙对照组比较,显著升高,提示IL-6 参与了种植体周围炎的发生、发展,能够较好反映种植体周围组织的炎症状态;推测其可能通过对破骨细胞的作用,在种植体周围骨吸收破坏方面发挥了较大的作用。
PD 可以在一定程度上反映种植体健康状况。虽然目前无法确定与健康种植位点相关的探诊范围,但由于牙龈肿胀或探查阻力降低,在种植体周围组织炎症的存在下经常可以观察到PD 的增加[23]。龈沟液是一种来自牙周组织的炎症渗出液,牙周组织的变化可通过龈沟液成分的分析而获得早期的生物化学指征。龈沟液的流出量与该位点的炎症程度呈正比,牙龈健康者只有极少量的龈沟液[24],这与本研究中龈沟液量与PD 呈正相关相符。
综上所述,口腔种植体周围炎患者龈沟液中IL-1β、IL-6 和TNF-α 均显著升高,参与了种植体周围炎症的发生和发展,其中TNF-α 与种植体炎症严重程度密切相关,并可能参与了骨改建过程。
参·考·文·献
[1] Berglundh T, Armitage G, Araujo MG, et al. Peri-implant diseases and conditions: consensus report of workgroup 4 of the 2017 world workshop on the classification of periodontal and peri-implant diseases and conditions[J]. J Clin Periodontol, 2018, 45(Suppl 20): S286-S291.
[2] Khurshid Z. Salivary point-of-care technology[J]. Eur J Dent, 2018, 12(1): 1-2.
[3] Renvert S, Persson GR, Pirih FQ, et al. Peri-implant health, peri-implant mucositis, and peri-implantitis: case definitions and diagnostic considerations[J]. J Clin Periodontol, 2018, 45(Suppl 20): S278-S285.
[4] Schwarz F, Derks J, Monje A, et al. Peri-implantitis[J]. J Periodontol, 2018, 89: S267-S290.
[5] Thoma DS, Naenni N, Figuero E, et al. Effects of soft tissue augmentation procedures on peri-implant health or disease: a systematic review and metaanalysis[J]. Clin Oral Impl Res, 2018, 29: 32-49.
[6] 王丽娜. 吸烟对牙周基础治疗前后龈沟液中C 反应蛋白水平影响[J]. 医学信息, 2015(40):315-316.
[7] Payne JB, Reinhardt RA, Masada MP, et al. Gingival crevicular fluid IL-8: correlation with local IL-1 beta levels and patient estrogen status[J]. J Periodont Res, 1993, 28(6 Pt 1): 451-453.
[8] 黄仕禄, 牟雁东, 雍苓, 等. IL-1β 和TNF-α 在种植体和天然牙周围龈沟液中的比较研究[J]. 中国口腔种植学杂志, 2016, 21(1):1-5.
[9] Renvert S, Polyzois I. Risk indicators for peri-implant mucositis: a systematic literature review[J]. J Clin Periodontol, 2015, 42(Suppl 16): S172-S186.
[10] Meyer S, Giannopoulou C, Courvoisier D, et al. Experimental mucositis and experimental gingivitis in persons aged 70 or over. Clinical and biological responses[J]. Clin Oral Impl Res, 2017, 28(8): 1005-1012.
[11] Faot F, Nascimento GG, Bielemann AM, et al. Can peri-implant crevicular fluid assist in the diagnosis of peri-implantitis? A systematic review and metaanalysis[J]. J Periodontol, 2015, 86(5): 631-645.
[12] Patel RP, Amirisetty R, Kalakonda B, et al. Influence of smoking on gingival crevicular fluid interleukin 1β and interleukin-8 in patients with severe chronic periodontitis among a rural population in India[J]. Niger Med J, 2018, 59(4): 33-38.
[13] Duarte PM, Serrão CR, Miranda TS, et al. Could cytokine levels in the periimplant crevicular fluid be used to distinguish between healthy implants and implants with peri-implantitis? A systematic review[J]. J Periodont Res, 2016, 51(6): 689-698.
[14] Schierano G, Pejrone G, Brusco P, et al. TNF-alpha TGF-beta2 and IL-1beta levels in gingival and peri-implant crevicular fluid before and after de novo plaque accumulation[J]. J Clin Periodontol, 2008, 35(6): 532-538.
[15] Sakai A, Ohshima M, Sugano N, et al. Profiling the cytokines in gingival crevicular fluid using a cytokine antibody array[J]. J Periodontol, 2006, 77(5): 856-864.
[16] Böhm C, Derer A, Axmann R, et al. RSK2 protects mice against TNF-induced bone loss[J]. J Cell Sci, 2012, 125(Pt 9): 2160-2171.
[17] Darabi E, Kadkhoda Z, Amirzargar A. Comparison of the levels of tumor necrosis factor-α and interleukin-17 in gingival crevicular fluid of patients with peri-implantitis and a control group with healthy implants[J]. Iran J Allergy Asthma Immunol, 2013, 12(1): 75-80.
[18] Belibasakis GN, Charalampakis G, Bostanci N, et al. Peri-implant infections of oral biofilm etiology[J]. Adv Exp Med Biol, 2015, 830: 69-84.
[19] Faot F, Nascimento GG, Bielemann AM, et al. Can peri-implant crevicular fluid assist in the diagnosis of peri-implantitis? A systematic review and metaanalysis[J]. J Periodontol, 2015, 86(5): 631-645.
[20] Fathy SA, Mohamed MR, Ali MAM, et al. Influence of IL-6, IL-10, IFN-γ and TNF-α genetic variants on susceptibility to diabetic kidney disease in type 2 diabetes mellitus patients[J]. Biomarkers, 2019, 24(1): 43-55.
[21] 林益强, 冯云霞, 刘名艳, 等. 正畸治疗过程中支抗种植体周围龈沟液中IL-1β, IL-6, IL-8 的研究[J]. 实用口腔医学杂志, 2017, 33(6): 845-847.
[22] 孙志新, 张云涛. 口腔种植体周围炎与白细胞介素间的关系[J]. 国际口腔医学杂志, 2015, 42(2): 221-224.
[23] Fuchigami K, Munakata M, Kitazume T, et al. A diversity of peri-implant mucosal thickness by site[J]. Clin Oral Implants Res, 2017, 28(2): 171-176.
[24] Sharma CG, Pradeep AR. Gingival crevicular fluid osteopontin levels in periodontal health and disease[J]. J Periodontol, 2006, 77(10): 1674-1680.
