姜黄素对心脏停搏/心肺复苏大鼠肠黏膜损伤的抑制作用
2020-03-19王立峰陈俊杰李永宁李雪娇
王立峰,陈俊杰,李永宁,王 玲,王 磊,李雪娇
大连医科大学附属第一医院急诊科,大连 116011
随着心肺复苏(cardiopulmonary resuscitation,CPR)理论的发展及医疗水平的提高,心脏停搏(cardiac arrest,CA)的复苏成功率逐年上升,但多数患者恢复自主循环后仍死于心脏停搏后综合征(post-cardiac arrest syndrome,PCAS),即心脏停搏复苏后发生全身组织缺血/再灌注(ischemia/reperfusion,I/R)损伤,出现多脏器功能障碍综合征(multiple organ dysfunction syndrome,MODS)的病理生理过程,其中小肠往往成为心脏停搏后复苏最早发生I/R 损伤和MODS 的始动器官。CPR 后严重的胃肠道I/R损伤,可导致肠内细菌发生易位,引发肠源性脓毒症,甚至出现多脏器功能衰竭,导致患者病死率增加[1-2]。当前,PCAS 的治疗是临床上的一大难题,如何在早期改善肠道缺血及菌群易位已成为治疗PCAS 的关键因素[3-4]。姜黄素(curcumin)作为一种中药成分,具有抗炎、抗氧化、抗肿瘤、清除自由基等多种功效[5-7],但对CPR 后的肠道黏膜是否具有保护作用未见报道。为此本实验建立CA/CPR大鼠模型,研究姜黄素对肠黏膜组织的保护机制。
1 材料与方法
1.1 主要试剂和仪器
姜黄素、胱天蛋白酶3(caspase-3)抗体、缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、辣根过氧化物酶(HRP)标记的兔抗山羊IgG 二抗(Sigma 公司,美国),二甲基亚砜(天津博迪化工股份有限公司),血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白介素-6(interleukin-6,IL-6)的ELISA 试剂盒(R&D 公司,美国),超氧化物歧化酶(superoxide dismutase,SOD)活力检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、还原型谷胱甘肽(glutathione,GSH)检测试剂盒(武汉博士德生物工程有限公司),TUNEL 法细胞凋亡检测试剂盒(Roche 公司,瑞士)。动物呼吸机(Harvard 仪器公司,美国),透射电子显微镜(TEM,Hitachi 公司,日本)。
1.2 动物分组
SPF 级 雄 性Sprague-Dawley 大 鼠24 只, 体 质 量(320.6±20.5)g,由大连医科大学动物中心提供,饲养于大连医科大学附属第一医院中心实验室SPF 级动物房。实验动物生产许可证号为SCXK(辽)2020-0001,实验动物使用许可证号为SYXK(辽)2018-0007。大鼠随机分为4 组,即对照组(Sham 组)、姜黄素组(Cur 组)、CPR后肠I/R 损伤组(I/R 组)、姜黄素+CPR 后肠I/R 损伤组(Cur+I/R 组),每组6 只。Sham 组、Cur 组麻醉后行气管插管,股动脉、股静脉置管,不进行窒息和CPR 操作;I/R 组和Cur+I/R 组构建CA/CPR 模型;Cur+I/R 组于CPR 开始前1 min 腹腔注射姜黄素(二甲基亚砜作为溶剂)100 mg/kg,同一时间Cur 组腹腔注射相同剂量姜黄素,Sham 组、I/R 组注射相同体积的二甲基亚砜。所有实验动物相关操作均获得大连医科大学附属第一医院实验动物使用和管理委员会批准。
1.3 CA/CPR 模型的构建
采用窒息法建立大鼠CA/CPR 模型。术前12 h 禁食(不禁水),10%水合氯醛按0.3 mL/100 g 腹腔注射麻醉,将大鼠固定于手术台上后给予气管切开置管,接呼吸机。24G 留置针行股动脉、股静脉插管监测血压,建立静脉通路,心电监护描记Ⅱ导联心电图,待大鼠血压和心率稳定后,于呼吸末夹闭气管插管至心搏骤停。心脏停搏判定标准:心电图呈心室纤颤(室颤)、停搏或无脉性电活动(PEA)波形,收缩压<25 mmHg(1 mmHg=0.133 kPa)[8]。心脏停搏5 min 后开放气道,呼吸机机械通气(通气频率80 次/min,潮气量6 mL/kg,吸入氧浓度21%),并同时给予人工胸外按压(按压深度为胸廓前后径的1/3,频率为160 次/min),股静脉快速推注肾上腺素(0.02 mg/kg)和5%碳酸氢钠(1 mg/kg), 持续监测并记录心电图直至自主循环恢复(restoration of spontaneous circulation,ROSC)。ROSC 标准:心电图出现正常QRS 波群;心前区触及心脏搏动;平均动脉压(mean arterial pressure,MAP) >60 mmHg,并且至少维持5 min 以上。ROSC 后停止按压,记录时间,采集参数,大鼠血液循环稳定后撤呼吸机,大鼠改为吸氧,连续监测血流动力学。CPR 持续6 min 无效者放弃复苏。
1.4 标本采集
ROSC 后6、12、24 h 尾静脉采血1 mL,同时腹腔注射等体积生理盐水,805×g 离心20 min,取上清液,保存于-80 ℃冰箱备用。ROSC 后24 h 处死大鼠,切取大鼠回肠2.5 cm(距回肠末端约8 cm),4 ℃生理盐水中清洗后备用。
1.5 各项指标检测方法
1.5.1 大鼠血清中TNF-α、IL-6 质量浓度的测定 取大鼠血清于4 ℃复融,检测血清TNF-α、IL-6 的质量浓度,按照ELISA 试剂盒说明书操作。
1.5.2 大鼠肠组织MDA、GSH 含量及SOD 活力测定 取肠组织约100 mg 进行研磨,取组织匀浆,805×g离心20 min,取上清液,按照试剂盒说明,测定MDA、GSH 含量及SOD 活力。每个样本重复3 次。
1.5.3 大鼠肠组织病理学分析 将肠组织于10%中性多聚甲醛溶液中固定,经过逐级乙醇脱水,二甲苯透明,浸蜡,石蜡包埋后,将组织块切成4 μm 薄片,经脱蜡、水化、蒸馏水冲洗等,行苏木精-伊红(hematoxylin-eosin,H-E)染色,在显微镜下观察肠黏膜组织形态学变化情况。
1.5.4 肠黏膜上皮细胞凋亡检测 取石蜡包埋肠组织切取3 μm 厚度的切片6 张,经二甲苯脱蜡,梯度乙醇脱水,PBS 冲洗,每片加25 μL TUNEL 反应液于37 ℃温箱中孵育60 min。经PBS 冲洗,每片加25 μL 碱性磷酸酶抗体,于37 ℃温箱中孵育10 ~30 min,再次PBS 冲洗,每片加1 ~2 滴底物显色液BCIP/NBT,室温下孵育30 min,PBS 冲洗。经苏木精复染,盐酸乙醇分化,中性树胶封片后在光学显微镜下观察凋亡蛋白表达情况(凋亡细胞核呈棕色或棕黄色),于200 倍镜下随机选取5 个视野,计数每个视野中凋亡细胞数和总细胞数,以凋亡细胞数占总细胞数的百分比为凋亡指数(apoptotic index)。
1.5.5 Western blotting 检测caspase-3 和HIF-1α 的表达 取 肠组织用裂解液RIPA 裂解,高速离心后提取回肠组织总蛋白。应用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE)进行蛋白质分离,上样后在12%聚丙烯酰胺凝胶中进行电泳,以电转膜方法将蛋白质转移至醋酸纤维素膜上,5%脱脂奶粉封闭2 h,加入山羊抗大鼠caspase-3 和抗HIF-1α 的一抗(均1:200 稀释)进行杂交,再用兔抗山羊HRP-IgG 二抗(1:500)标记,DAB 显色。结果在图像分析系统中进行分析。
1.5.6 肠黏膜上皮超微结构的观察 取回肠标本(约1 mm3)固定于3%戊二醛的缓冲液中,PBS 冲洗后于1%四氧化锇酸固定1 ~2 h。组织逐级乙醇脱水,树脂包埋,常规超薄切片(厚度70 nm),用4%醋酸双氧铀和0.4%柠檬酸铅固定,通过TEM 观察黏膜上皮细胞及细胞间紧密连接的情况。
1.6 统计学分析
2 结果
2.1 大鼠一般生存状态和复苏后相关指标
4 组大鼠的术前呼吸频率、心率、MAP 之间差异不明显,均无统计学意义(均P>0.05)。Cur+I/R 组与I/R组在模型构建过程中的窒息时间、肾上腺素用量、CPR至ROSC 时间相比较,差异无统计学意义(均P>0.05)。Sham 组和Cur 组大鼠全部存活至术后24 h;I/R 组和Cur+I/R 组大鼠均复苏成功,ROSC 后24 h 均仅各存活 5 只。4 组存活率之间差异无统计学意义(P>0.05,表1)。
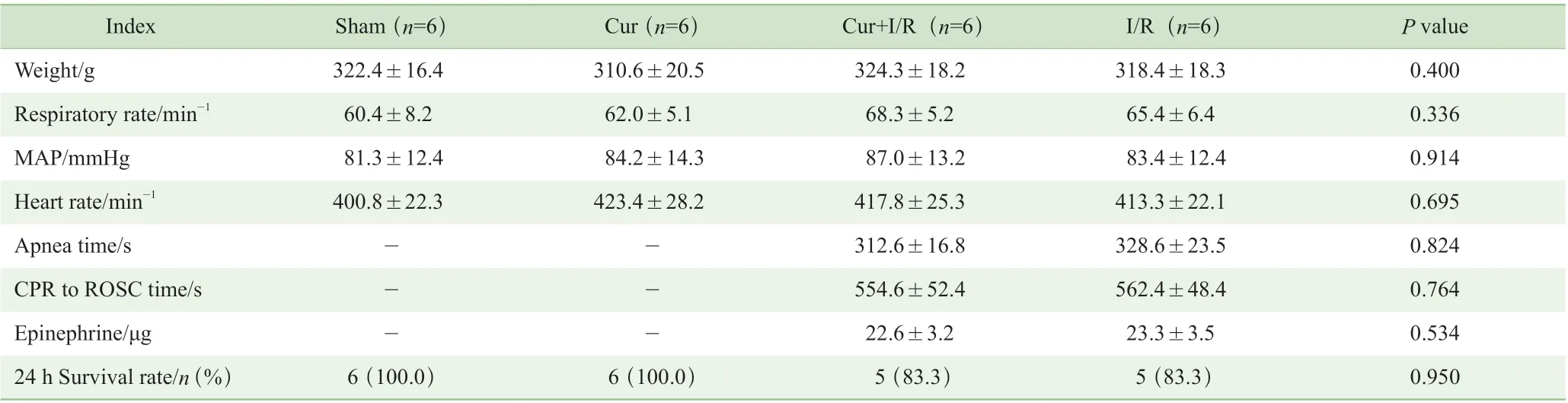
表1 各组大鼠的基线特征及模型构建过程中的相关指标Tab 1 Baseline characteristics of rats in each group and related indexes during model construction
2.2 血清中炎症因子TNF-α、IL-6 的浓度
在ROSC 后6 h、12 h、24 h 检 测 炎 症 因 子TNF-α、IL-6 的浓度发现,Sham 组与Cur 组几乎无变化,且2 组间 无 明 显 差 异。Cur+I/R 组 和I/R 组 在6 h 时TNF-α 和IL-6 均处于高表达水平,随着时间推移表达水平逐渐降低,但仍显著高于Sham 组(均P<0.01);Cur+I/R 组的TNF-α和IL-6 与I/R 组比较,均显著降低(均P<0.05,图1)。
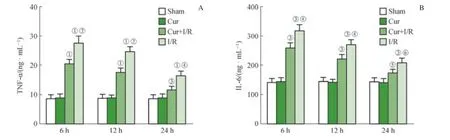
图1 大鼠ROSC 后不同时间血清中炎症因子TNF-α 和IL-6 的浓度Fig 1 Concentrations of inflammatory factors TNF-α and IL-6 in rats serum in different periods after ROSC
2.3 肠组织中MDA、GSH 浓度及SOD 活力水平
通过检测肠组织中MDA 浓度发现,Cur+I/R 组显著低于I/R 组(P<0.05),但显著高于Sham 组(P<0.01);而Cur+I/R 组的SOD 活力和GSH 浓度显著高于I/R 组(均P<0.05),低于Sham 组(均P<0.01,图2)。
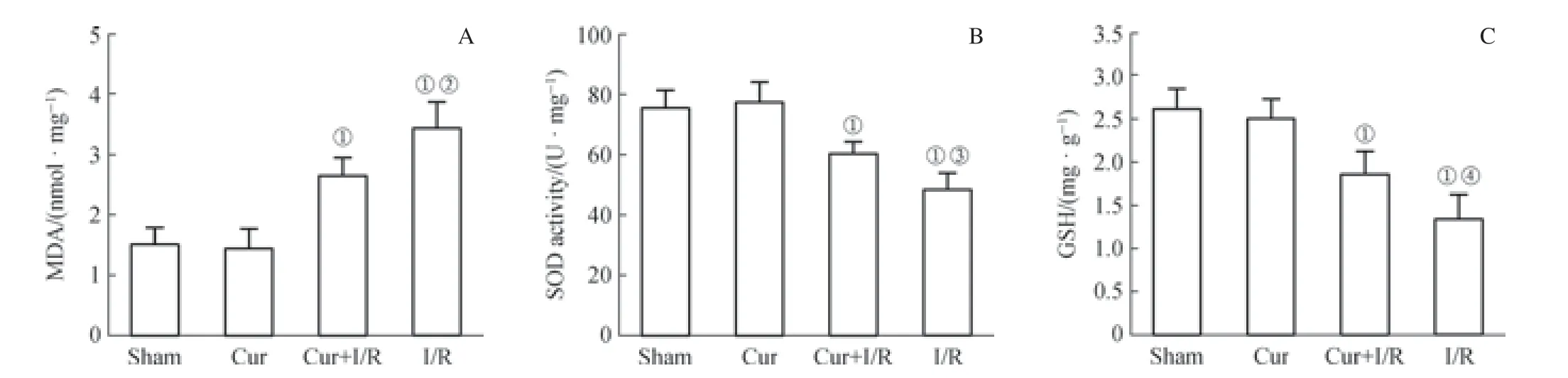
图2 大鼠ROSC 后24 h 肠组织中MDA 和GSH 浓度及SOD 活力水平Fig 2 MDA and GSH concentrations and SOD activity 24 h after ROSC in intestinal tissues of rats
2.4 肠黏膜组织病理学变化
大鼠肠组织经H-E 染色后在镜下观察发现,I/R 组可见肠黏膜水肿,炎症细胞浸润,绒毛顶端上皮脱落、粘连,中央乳糜管扩张,固有层裸露、破溃;而Cur+I/R 组肠黏膜出现少量绒毛顶端上皮脱落,固有层轻度水肿,较I/R 组明显减轻。Sham 组和Cur 组肠各层结构清晰,黏膜表层完整,腺体排列整齐(图3)。
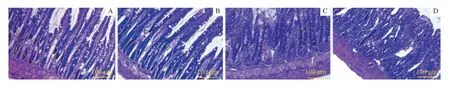
图3 大鼠ROSC 后24 h 肠组织H-E 染色(×200)Fig 3 H-E staining results of intestinal tissues of rats 24 h after ROSC (×200)
2.5 肠黏膜上皮细胞凋亡情况
TUNEL 法检测大鼠回肠黏膜显示,Cur+I/R 组肠黏膜凋亡细胞多集中于缺血、缺氧敏感的肠绒毛的顶部, I/R 组肠黏膜上皮凋亡细胞呈棕褐色,在肠绒毛表面均有分布;Cur+I/R 组的凋亡指数较I/R 组显著降低(P<0.05),但仍较Sham 组显著升高(P<0.01)。Sham 组和Cur 组肠黏膜凋亡细胞较少(图4)。
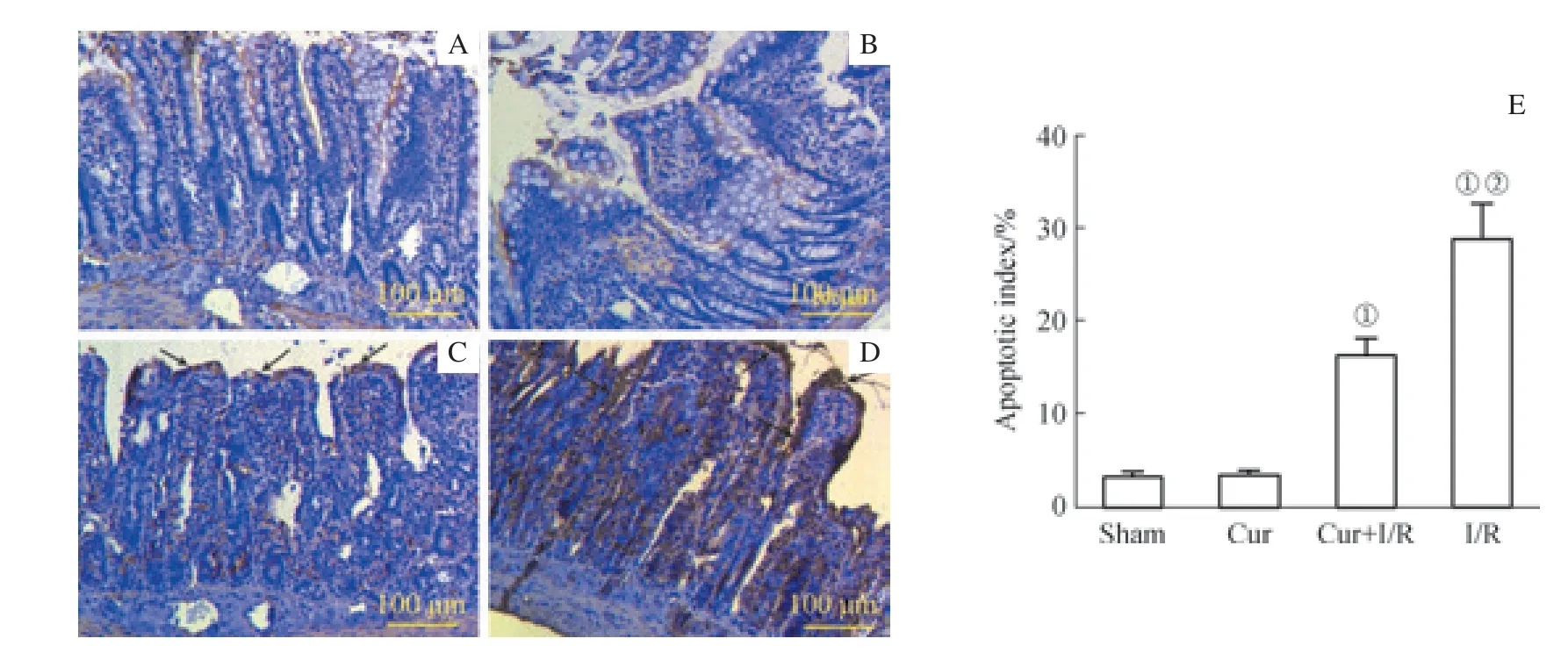
图4 TUNEL 法检测大鼠ROSC 后24 h 肠黏膜上皮细胞凋亡情况与凋亡指数(×200)Fig 4 TUNEL detection of intestinal mucosal epithelial cell apoptosis and apoptotic indexes of rats 24 h after ROSC (×200)
2.6 肠组织中caspase-3 和HIF-1α 的表达
Sham 组和Cur 组caspase-3 蛋白表达较低;Cur+I/R组caspase-3 蛋白表达显著低于I/R 组(P<0.05),高于Sham 组(P<0.01)。Sham 组和Cur 组HIF-1α 蛋白表达较低;Cur+I/R 组HIF-1α 蛋白表达显著高于I/R 组和Sham组(均P<0.05,图5)。
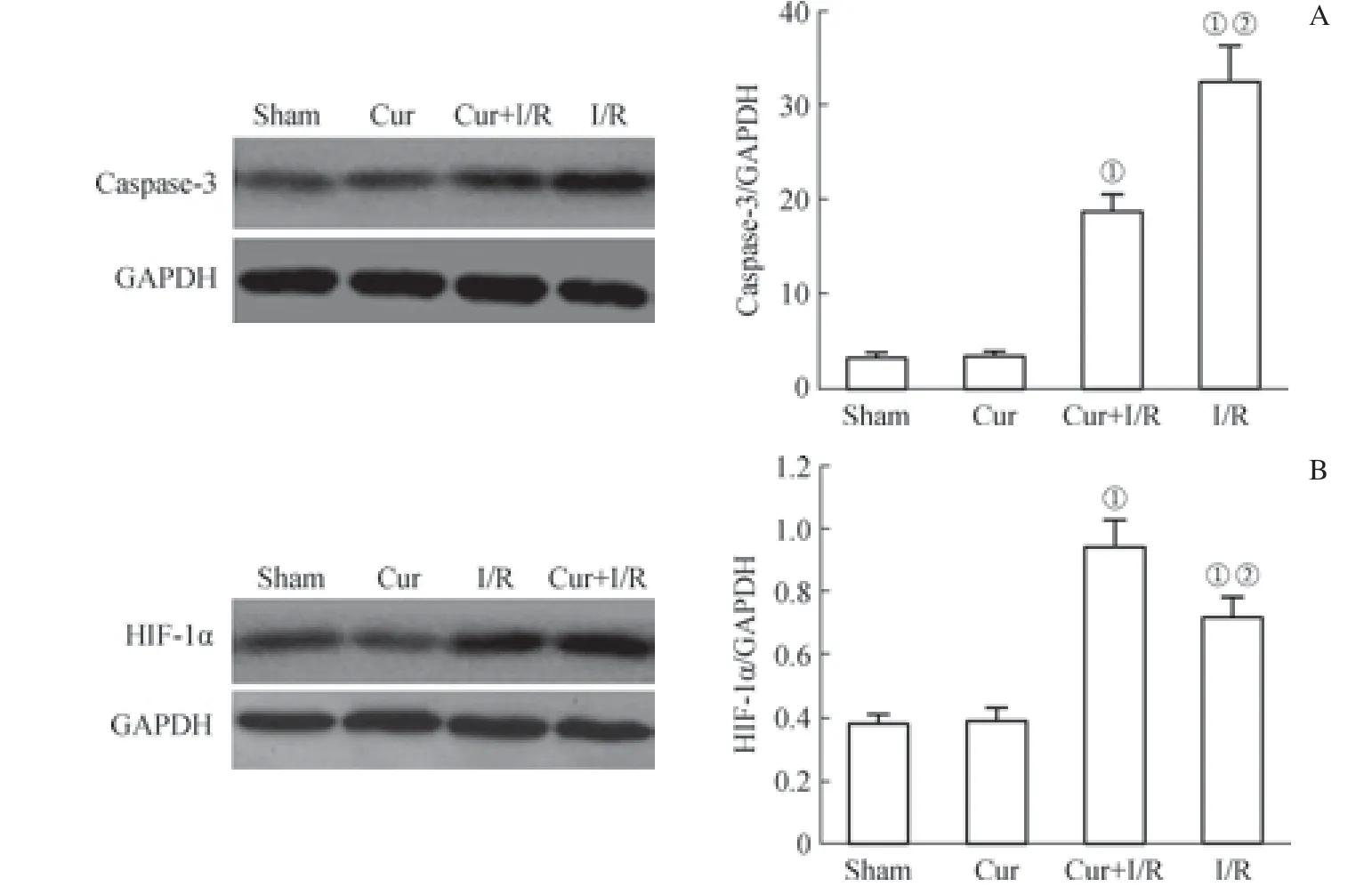
图5 Western blotting 检测大鼠ROSC 后24 h 肠组织中caspase-3 和HIF-1α 蛋白表达Fig 5 Detection of caspase-3 protein expression in intestinal tissues of rats 24 h after ROSC by Western blotting
2.7 肠组织超微结构变化
TEM 下观察,Sham 组肠黏膜上皮细胞排列紧密,细胞表面微绒毛丰富,排列有序,下方桥粒结构清晰,连接紧密,游离面细胞器丰富,有大量线粒体分布,细胞侧面连接复合体结构完整;Cur 组上皮细胞呈高柱状,表面微绒毛排列规则,桥粒结构清晰,特点与Sham 组相似;Cur+I/R 组肠黏膜上皮细胞微绒毛排列密集、有序,结构清晰,细胞间的连接复合体完整,细胞器形态大致正常;I/R 组肠黏膜上皮细胞微绒毛排列稀疏,欠规则,绒毛倒伏,彼此紧密连接的肠黏膜上皮结构被破坏,出现内质网脱颗粒现象,线粒体空化、嵴断裂(图6)。

图6 TEM 下大鼠ROSC 后24 h 肠组织超微结构(×20 000)Fig 6 Ultrastructure of intestinal tissues of rats 24 h after ROSC under TEM (×20 000)
3 讨论
临床上CPR 的成功率近年来逐渐升高,但复苏后的I/R 损伤及感染仍是死亡的主要原因,其中机制与肠道菌群失调、易位,炎症因子、氧自由基及内毒素释放导致肠黏膜上皮细胞凋亡及自主神经功能紊乱等密不可分[9-11]。CPR 后肠黏膜处于缺血再灌注状态,绒毛顶端最敏感、易受损伤,可出现绒毛脱落、细胞变性坏死及黏膜损伤出血,肠道通透性增加,继而细菌及其毒素移位至血液循环诱发脓毒症甚至多脏器功能衰竭[12-14]。姜黄素是从姜科植物的根茎中提取的一种天然化合物,它可以抑制炎症反应、降低活性氧簇、抑制巨噬细胞活性和蛋白激酶的表达,对机体组织炎症损伤有着显著的治疗作用[15-19]。本实验发现,ROCS 后I/R 组大鼠回肠黏膜水肿,炎症细胞浸润,绒毛顶端上皮脱落、粘连,上皮细胞结构损伤明显,而Cur+I/R 组肠黏膜出现少量绒毛顶端上皮脱落,固有层轻度水肿,较I/R 组明显减轻,说明姜黄素对大鼠CA/CPR 后肠上皮细胞具有一定保护作用。
TNF-α 是由单核巨噬细胞和活化的T 淋巴细胞分泌的早期炎症因子和免疫调节因子,在肠道损伤炎症级联反应中起核心作用;IL-6 是二级炎症反应介质的诱导物,能反映感染的严重程度及预后[20]。相关研究[8]表明,CPR后1 ~3 d,心、脑等重要器官功能逐步得到改善,而肠黏膜屏障损伤及血清中促炎介质TNF-α、IL-6、IL-8 等表达却明显增加,易继发全身炎症反应综合征(systemic inflammatory response syndrome,SIRS), 进 而 出 现MODS。本实验发现,CPR 后I/R 组6、12、24 h 血清中TNF-α 和IL-6 均呈高表达,提示受损肠黏膜存在持续炎症反应,而Cur+I/R 组中TNF-α、IL-6 的水平明显降低,表明姜黄素可抑制促炎因子的释放。
在ROSC 后,微循环再灌注过程中产生大量氧自由基是器官损伤的重要环节。本研究显示,I/R 组脂质过氧化产物MDA 含量显著升高,而抗氧化应激相关的SOD 活力和GSH 含量明显降低,说明ROSC 后肠黏膜上皮细胞存在着显著的脂质过氧化现象,且清除氧自由基的能力明显不足。而在姜黄素干预下CPR 后大鼠肠黏膜组织中MDA 含量下降,SOD 活力上升、GSH 含量上调,证实了姜黄素可通过清除氧自由基,抑制肠黏膜组织氧化应激反应,改善细胞内氧化还原状态,从而保护肠黏膜免受过度氧化应激引起的损伤。
肠黏膜上皮细胞凋亡是ROSC 后肠道I/R 损伤的另一个重要因素[21-22]。本实验发现,I/R 组TUNEL 染色后肠黏膜上皮和固有层细胞凋亡明显增加,凋亡指数升高,以及凋亡蛋白caspase-3 的表达上调,均提示肠上皮细胞发生凋亡;而且TEM 下可见I/R 组肠上皮细胞内线粒体空化、嵴断裂,以及脱颗粒现象。有研究[23-24]证实,姜黄素能通过上调肠上皮细胞中抗凋亡基因B 淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的表达,抑制caspase-3 的活化,从而减轻肠上皮细胞的凋亡程度。本研究结果显示,Cur+I/R 组凋亡细胞数量减少,caspase-3 蛋白表达水平低于I/R 组,TEM 下可见肠黏膜上皮细胞损伤程度较I/R 组明显减轻,说明姜黄素具有抑制CA/CPR 后肠上皮细胞凋亡、保护肠黏膜屏障的作用。
在CPR 过程中,肠黏膜作为缺氧敏感器官,往往是心脏停搏后缺血性损伤最早受累的部位。近年来,研究[25]表明,HIF-1α 作为低氧适应和病理反应中的一种特异性中介因子,在肠黏膜缺氧状态下持续激活,其表达上调可产生一系列病理生理变化,从而修复和维持肠黏膜屏障功能。姜黄素在缺氧条件下可调节HIF-1α 活性[26-27]。在本实验中Cur+I/R 组HIF-1α 活性明显高于I/R 组,说明姜黄素可在ROSC 后24 h 的肠道内促HIF-1α 表达上升,对CPR后肠黏膜缺血给予保护性作用,而其中的机制尚未可知,需要在今后工作中进一步探索。
本实验研究表明,姜黄素能有效减轻CA/CPR 后大鼠肠黏膜损伤,通过抑制炎症介质释放、清除氧自由基、抑制肠上皮细胞凋亡、上调HIF-1α 表达等方面对肠黏膜起保护作用,有望成为临床上CPR 后患者保护肠道屏障功能的潜在药物。但本研究样本数量偏少,检测炎症及凋亡指标有限,这有待于下一步的研究中完善。
参·考·文·献
[1] Li X, Ling YH, Cao ZM, et al. Targeting intestinal epithelial cell-programmed necrosis alleviates tissue injury after intestinal ischemia/reperfusion in rats[J]. J Surg Res, 2018, 225: 108-117.
[2] Bertoni S, Ballabeni V, Barocelli E, et al. Mesenteric ischemia-reperfusion: an overview of preclinical drug strategies[J]. Drug Discov Today, 2018, 23(7): 1416-1425.
[3] Ueda T, Takagi T, Katada K, et al. The protective effect of orally administered redox nanoparticle on intestinal ischemia-reperfusion injury in mice[J]. Biochem Biophys Res Commun, 2018, 495(2): 2044-2049.
[4] Cagin YF, Atayan Y, Sahin N, et al. Beneficial effects of dexpanthenol on mesenteric ischemia and reperfusion injury in experimental rat model[J]. Free Radic Res, 2016, 50(3): 354-365.
[5] Yucel AF, Kanter M, Pergel A, et al. The role of curcumin on intestinal oxidative stress, cell proliferation and apoptosis after ischemia/reperfusion injury in rats[J]. J Mol Histol, 2011, 42(6): 579-587.
[6] Bereswill S, Muñoz M, Fischer A, et al. Anti-inflammatory effects of resveratrol, curcumin and simvastatin in acute small intestinal inflammation[J]. PLoS One, 2010, 5(12): e15099.
[7] Larmonier CB, Midura-Kiela MT, Ramalingam R, et al. Modulation of neutrophil motility by curcumin: implications for inflammatory bowel disease[J]. Inflamm Bowel Dis, 2011, 17(2): 503-515.
[8] Pan H, Chen D, Liu BB, et al. Effects of sodium hydrosulfide on intestinal mucosal injury in a rat model of cardiac arrest and cardiopulmonary resuscitation[J]. Life Sci, 2013, 93(1): 24-29.
[9] Wang GZ, Yao JH, Li ZL, et al. miR-34a-5p inhibition alleviates intestinal ischemia/reperfusion-induced reactive oxygen species accumulation and apoptosis via activation of SIRT1 signaling[J]. Antioxid Redox Signal, 2016, 24(17): 961-973.
[10] Xing JH, Lu J. HIF-1α activation attenuates IL-6 and TNF-α pathways in hippocampus of rats following transient global ischemia[J]. Cell Physiol Biochem, 2016, 39(2): 511-520.
[11] Kocael A, Inal BB, Guntas G, et al. Evaluation of matrix metalloproteinase, myeloperoxidase, and oxidative damage in mesenteric ischemia-reperfusion injury[J]. Hum Exp Toxicol, 2016, 35(8): 851-860.
[12] Nadatani Y, Watanabe T, Shimada S, et al. Microbiome and intestinal ischemia/reperfusion injury[J]. J Clin Biochem Nutr, 2018, 63(1): 26-32.
[13] Santos CH, Aydos RD, Nogueira Neto E, et al. Evaluation of pulmonary reperfusion injury in rats undergoing mesenteric ischemia and reperfusion and protective effect of postconditioning on this process[J]. Braz J Cardiovasc Surg, 2015, 30(5): 533-537.
[14] He XM, Zheng YQ, Liu SZ, et al. MiR-146a protects small intestine against ischemia/reperfusion injury by down-regulating TLR4/TRAF6/NF-κB pathway[J]. J Cell Physiol, 2018, 233(3): 2476-2488.
[15] Onder A, Kapan M, Gümüş M, et al. The protective effects of curcumin on intestine and remote organs against mesenteric ischemia/reperfusion injury[J]. Turk J Gastroenterol, 2012, 23(2): 141-147.
[16] Nurullahoglu-Atalik KE, Okudan N, Belviranli M, et al. Role of curcumin in mesenteric ischemia-reperfusion injury in rats[J]. Bratisl Lek Listy, 2012, 113(8): 465-470.
[17] Zu G, Zhou TT, Che NW, et al. Salvianolic acid A protects against oxidative stress and apoptosis induced by intestinal ischemia-reperfusion injury through activation of Nrf2/HO-1 pathways[J]. Cell Physiol Biochem, 2018, 49(6): 2320-2332.
[18] McFadden RM, Larmonier CB, Shehab KW, et al. The role of curcumin in modulating colonic microbiota during colitis and colon cancer prevention[J]. Inflamm Bowel Dis, 2015, 21(11): 2483-2494.
[19] Meng Z, Yan C, Deng Q, et al. Curcumin inhibits LPS-induced inflammation in rat vascular smooth muscle cells in vitro via ROS-relative TLR4-MAPK/NF-κB pathways[J]. Acta Pharmacol Sin, 2013, 34(7): 901-911.
[20] Yang Z, Zhang XR, Zhao Q, et al. Knockdown of TNF-α alleviates acute lung injury in rats with intestinal ischemia and reperfusion injury by upregulating IL-10 expression[J]. Int J Mol Med, 2018, 42(2): 926-934.
[21] Hu QY, Ren HJ, Ren JN, et al. Released mitochondrial DNA following intestinal ischemia reperfusion induces the inflammatory response and gut barrier dysfunction[J]. Sci Rep, 2018, 8(1): 7350.
[22] Yang K, Luo Y, Lu S, et al. Salvianolic acid B and ginsenoside Re synergistically protect against Ox-LDL-induced endothelial apoptosis through the antioxidative and antiinflammatory mechanisms[J]. Front Pharmacol, 2018, 9: 662.
[23] Song WB, Wang YY, Meng FS, et al. Curcumin protects intestinal mucosal barrier function of rat enteritis via activation of MKP-1 and attenuation of p38 and NF-κB activation[J]. PLoS One, 2010, 5(9): e12969.
[24] Jia ZZ, Lian WS, Shi HF, et al. Ischemic postconditioning protects against intestinal ischemia/reperfusion injury via the HIF-1α/miR-21 axis[J]. Sci Rep, 2017, 7(1): 16190.
[25] Shi YH, Fang WG. Hypoxia-inducible factor-1 in tumour angiogenesis[J]. World J Gastroenterol, 2004, 10(8): 1082-1087.
[26] Kannan KB, Colorado I, Reino D, et al. Hypoxia-inducible factor plays a gut-injurious role in intestinal ischemia reperfusion injury[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 300(5): G853-G861.
[27] Kai S, Tanaka T, Daijo H, et al. Hydrogen sulfide inhibits hypoxia- but not anoxia-induced hypoxia-inducible factor 1 activation in a von hippel-lindau-and mitochondria-dependent manner[J]. Antioxid Redox Signal, 2012, 16(3): 203-216.
