热带土壤中解淀粉芽孢杆菌HNU1的鉴定及发酵条件优化
2020-03-15符可芯杨叶曾耿狄
符可芯, 杨叶, 曾耿狄
(1.海南大学生命科学与药学院, 海口 570228; 2.海南大学植物保护学院, 海南省热带生物资源可持续利用重点实验室, 海口 570228)
铜(Cu)是生物体必需的微量元素,Cu 缺乏或过量都会影响动植物和人类的生长发育[1-2]。在农业生产中,为了提高作物产量大量使用含铜化肥和农药,其不合理使用导致土壤中Cu浓度增加[3-4],土壤中铜的含量过高导致生态环境发生恶化[5]。在污染土壤中的Cu经植物吸收后,可抑制植物的光合作用,导致其生长迟缓和叶萎黄[1,6-7]。铜污染食品经人类食用后可在人体内过量累积导致人体机能受到损伤,引发疾病[4]。研究表明,在人体内高浓度铜可损伤其消化道引起急性胃肠炎,损伤呼吸道引起肺部感染等疾病[8]。土壤重金属污染危及生态环境安全以及人类健康,因此,对其进行修复具有重大意义。
目前,利用微生物修复土壤重金属污染是土壤治理的研究热点,具有广阔的发展前景。微生物具代谢途径丰富多样性,并进化出多种抵抗重金属毒性的机制,如微生物可通过生物累积、生物矿化、生物吸附和生物转化等机制对重金属进行吸附、沉淀、氧化和还原,因此,可以利用微生物对重金属的抗性机制对环境中的重金属污染进行修复[9]。在微生物修复重金属污染的研究中,细菌类微生物以芽孢杆菌为主。该类细菌产芽孢,好氧或兼性厌氧,抗逆性强,可在极端环境下生存[10]。研究报道,芽孢杆菌对Cu2+、Cd2+、Cr3+、Cu2+、Pb2+等多种重金属具有抗性,在含有重金属的培养基中可正常生长[11-12]。Kumari等[13]从我国新疆一个酸性铜矿尾矿分离得到三株芽孢杆菌,对Cu、Cr、Pb、Cd、Sb 和Ni六种重金属都具有较强的抗性。康薇等[14]分离得到一株芽孢杆菌TLSB-2-K,对铜的最高耐受浓度为700 mg·L-1,该菌株分别在铜浓度为200和300 mg·L-1的培养基中胁迫培养30 h后,菌体铜含量分别为2 078.2 mg·kg-1和2 188.4 mg·kg-1,具有较高的铜吸附能力。芽孢杆菌在土壤环境中广泛存在,是被广泛研究的生防微生物之一,也是重金属污染的微生物修复技术中的重要微生物资源。
微生物修复法具有来源广、成本低、操作简单、无二次污染等优点[9,15-16]。由于微生物本身的性质特点,微生物修复法也存在局限性。微生物受环境温度、pH及营养物质等条件的影响,在土壤环境中不易存活及繁殖,导致微生物对重金属污染土壤的修复效果不稳定。如何提供微生物菌种适宜的营养物质及生存环境条件在微生物修复法技术存在着重要地位。笔者在前期工作中分离得到1株铜富集细菌HNU1菌株,采用生理生化和分子生物学鉴定HNU1菌株为解淀粉芽孢杆菌。以HNU1菌株的生物量为评估指标,对该菌的培养基成分和摇瓶发酵条件进行优化,确定该菌的最适培养基成分及最适培养条件,为进一步开发为微生物肥料及其应用奠定基础。
1 材料与方法
1.1 试验材料
1.1.1菌种和质粒 HNU1菌株由海南大学热带农林学院微生物实验室从海南儋州分离并保存。大肠杆菌感受态DH5α菌株和pMD18-T载体均购自TaKaRa公司。
1.1.2主要试剂和仪器 DNA 凝胶回收纯化试剂盒(Ver 2.0)、PCR 反应用的各种试剂均购自大连TaKaRa公司(日本);DNA 提取用试剂盒购自天根生化科技(北京)有限公司。
LB基础培养基(1 L):蛋白胨10 g、酵母提取物5 g、氯化钠10 g、pH 7.0~7.2。
全自动生物显微镜(LEICA DM6B),广东省中科进口有限公司(德国);紫外分光光度计(T6新世纪),北京普析通用仪器有限责任公司。
1.2 菌株鉴定
在LB平板上对HNU1菌株的菌落边缘、形状和颜色等形态特征进行观察,进行革兰氏染色、淀粉水解反应、甲基红反应、V-P反应、吲哚反应、糖类发酵试验、脲酶反应、硝酸盐还原反应和柠檬酸盐利用反应等生理生化试验[17]。
将HNU1菌株接种至LB液体培养基,在30 ℃、160 r·min-1震荡培养18 h,用1.5 mL离心管吸取1 mL菌液,12 000 r·min-1离心2 min,弃上清,获得菌体沉淀。利用TIANGEN细菌基因组DNA 提取试剂盒提取HNU1菌株的基因组DNA。以基因组DNA为模板,用正向引物27F(5′-AGAGTTTGATCCTGGCTGGCTCAG-3′)和反向引物1492R(5′-GGTTACCTTGTTACGACTT-3′)进行PCR反应,扩增菌株的16S rDNA序列[18]。PCR扩增产物经0.8%琼脂糖凝胶电泳 后,用DNA 胶回收试剂盒进行纯化回收。回收产物连接到18T载体并转化到大肠杆菌的感受态细胞中。将转化后的感受态细胞进行恢复培养后,吸取微量菌液涂布在含有氨苄抗生素的LB平板上,在37 ℃下培养12~24 h。待平板上长出菌落后,挑取形态较大的菌落进行菌落PCR反应,1%琼脂糖凝胶电泳检测,挑取具有阳性电泳条带的菌落,在含有氨苄抗生素的LB液体培养基中培养12 h后,吸取适量菌液送至测序公司进行测序。测序由赛默飞世尔科技(中国)有限公司完成。从EzTaxon-server(http://eztaxon-e.ezbiocloud)获得与HNU1菌株亲缘关系相近的菌株16S rDNA序列,利用Mega 7.0 软件构建系统发育树[19]。
1.3 培养条件优化
1.3.1温度 以LB液体培养基为发酵培养基,装液量为20 mL(锥形瓶容量为50 mL),121 ℃灭菌 20 min。以1%(体积分数)的接种量接种至培养液中,设定温度为20、25、30、37、40、45、50 ℃,180 r·min-1振荡培养24 h,每个处理3次重复,用紫外可见分光光度计测定菌液在600 nm处的OD值。
1.3.2pH 用灭菌的0.1 mol·L-1HCl和 0.1 mol·L-1NaOH 将培养基的pH分别调至4.0、5.0、6.0、7.0、8.0、9.0、10.0,在最适温度、180 r·min-1振荡培养24 h,每个处理3次重复,测定OD600值。
1.3.3接种量 将培养基调至最适pH,在培养基中分别加入0.1%、0.5%、0.7%、1%、1.5%、2%的种子液,在最适温度、180 r·min-1振荡培养24 h,每个处理3次重复,测定OD600值。
1.3.4转速 将培养基调至最适pH,按最适的接种量接种,分别调节摇床转速为 120、150、180、210、240 r·min-1,在最适温度下震荡培养24 h,每个处理3次重复,测定OD600值。
1.3.5装液量 将培养基调至最适pH,用50 mL的锥形瓶依次装有 10、20、25、30、40 mL培养液,按最适接种量接种,在最适温度、最适转速的条件下振荡培养24 h,每个处理3次重复,测定OD600值。
1.4 培养基成分优化
选用LB培养基作为基础培养基,进行培养基成分优化的单因素筛选试验。
1.4.1碳源及其浓度 分别添加1%的葡萄糖、玉米淀粉、马铃薯淀粉、麦芽糖、蔗糖作为LB培养基中的碳源,以不加碳源为对照,将上述处理的培养基 pH 调至7.0,装液量为20 mL(锥形瓶容量为50 mL),121℃灭菌 20 min。以0.1%的接种量接种至锥形瓶中,置于37 ℃、180 r·min-1振荡培养24 h,每个处理3次重复,测定OD600值。
确定培养基的最佳碳源之后,改变基础培养基中最佳碳源的浓度,氮源和无机盐组分不变,来进一步研究不同浓度的碳源对菌株生长的影响,每个处理重复3次。
1.4.2氮源及其浓度 分别添加1.5%的KNO3、(NH4)2SO4、牛肉浸膏、胰蛋白胨、酵母粉、酵母粉+胰蛋白胨(两种氮源的比例为1∶2)等氮源,替换LB培养基中的氮源,以不加氮源为对照,其他条件和测定方法同1.4.1。
确定培养基的最佳氮源之后,改变基础培养基中最佳氮源的浓度,碳源和无机盐组分不变,来进一步研究不同浓度的氮源对菌株生长的影响,每个处理重复3次。
1.4.3无机盐及其浓度 分别以 1%的 CaCl2、KH2PO4、MgSO4、NaCl作为培养基中的无机盐,以不添加无机盐为对照,其他条件和测定方法同1.4.1。
确定培养基的最佳无机盐之后,改变基础培养基中最佳无机盐的浓度,碳源和氮源组分不变,来进一步研究不同浓度的无机盐对菌株生长的影响,每个处理重复3次。
1.5 正交试验设计
以单因素试验中筛选出的蔗糖为碳源,酵母粉和蛋白胨为氮源,MgSO4为无机盐,根据 L9(34)正交表进行4因素3水平的正交试验(表1),获得HNU1菌株生长的最优培养基组合,并验证优化培养基组合对菌株生物量的提高效果。

表1 正交试验因素与水平
1.6 数据统计与分析
采用SAS9.2软件对数据进行统计分析,用origin2018软件作图。
2 结果与分析
2.1 菌株鉴定
2.1.1分子生物学鉴定 HNU1菌株的16S rDNA基因序列测序结果表明,其大小为1 472 bp。将测序得到的16S r DNA基因序列上传至NCBI中,获得GenBank序列登记号为 MK583944。将测序获得的序列在EzTaxon-server(http://eztaxon-e.ezbiocloud)进行相似性分析,结果表明,菌株HNU1与暹罗芽孢杆菌(Bacillussiamensis)的相似性为99.73%,与枯草芽孢杆菌(Bacillussubtilissubsp.subtilis)的相似性为99.73%,与解淀粉芽孢杆菌(Bacillusamyloliquefaciens)的相似性为99.59%。利用 MEGA7.0 软件,采用邻接法构建系统发育树,结果显示菌株HNU1与B.siamensis和B.amyloliquefaciens亲缘关系最近(图1)。
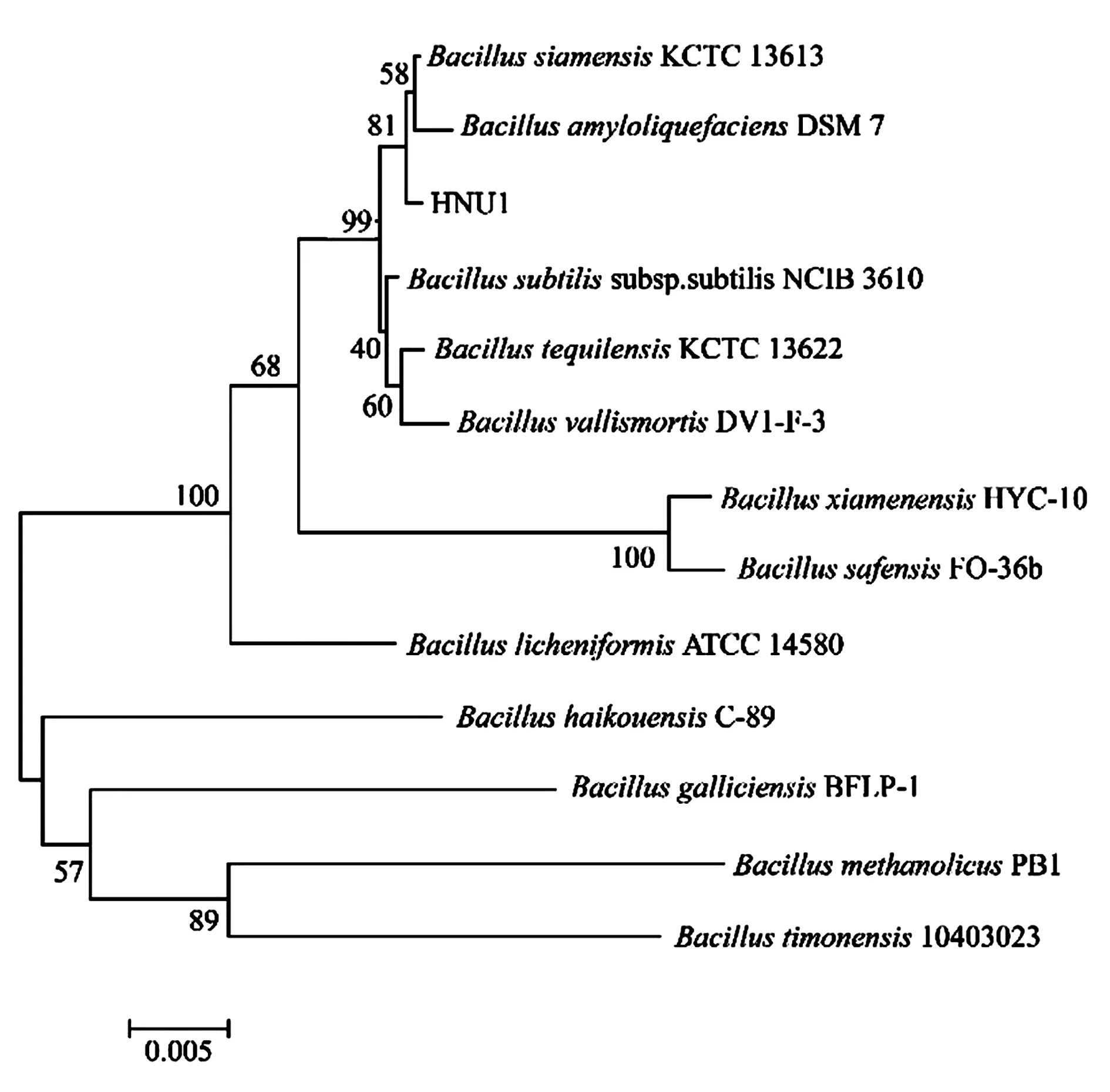
图1 菌株HNU1的16S rDNA系统发育树
2.1.2形态学和生理生化鉴定 通过菌落形态观察发现,菌株在37 ℃培养24 h后,在LB平板上形成圆形或近似圆形菌落,菌落前期表面光滑湿润、边缘整齐、稍有光泽的乳白色,后期表面粗糙、边缘不整齐;在显微镜下观察的菌体形态为短杆状,两端钝圆。根据HNU1菌株的系统发育树分析结果显示B.siamensis和B.amyloliquefaciens与HNU1菌株的亲缘关系最近,对比HNU1菌株与B.siamensis和B.amyloliquefaciens[20]的生理生化特性(表2),结果显示HNU1菌株的生理生化特征与B.amyloliquefaciens一致,根据以上结果判断HNU1菌株为解淀粉芽孢杆菌(B.amyloliquefaciens)。

表2 菌株HNU1的生理生化特性
2.2 菌株的培养条件优化
2.2.1初始pH对菌株生长的影响 由图2可知,在初始pH<5和pH>9时,HNU1菌株生长缓慢。初始pH在5~8之间,OD值均达到2.30以上,说明菌株在pH 5~8之间都能很好的生长。初始pH 8.0时,菌株的OD值显著高于其他pH,因此HNU1菌株的最适pH为8.0。
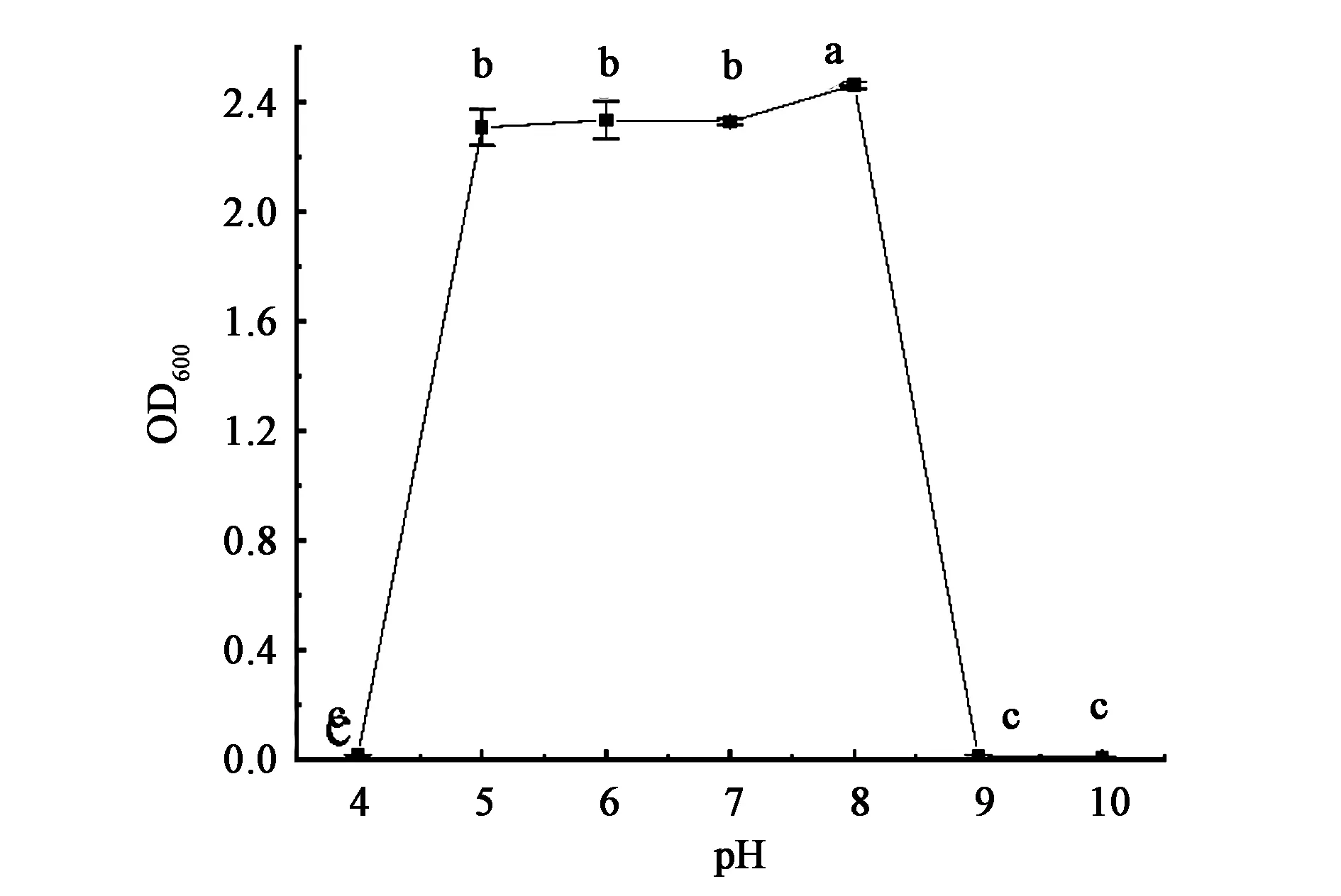
注:图中不同字母表示差异在P<0.05水平具有统计学意义。
2.2.2温度对菌株生长的影响 由图3可知,菌株在20~50 ℃的温度范围内均可生长,说明菌株对温度的适应性较宽。在30~40 ℃时菌体生长良好,在37 ℃时菌株的生长最好,其OD值显著高于其他温度。高于45 ℃时,菌体生长缓慢,OD值迅速下降。由此可以得出,菌株生长的最适温度为37 ℃。
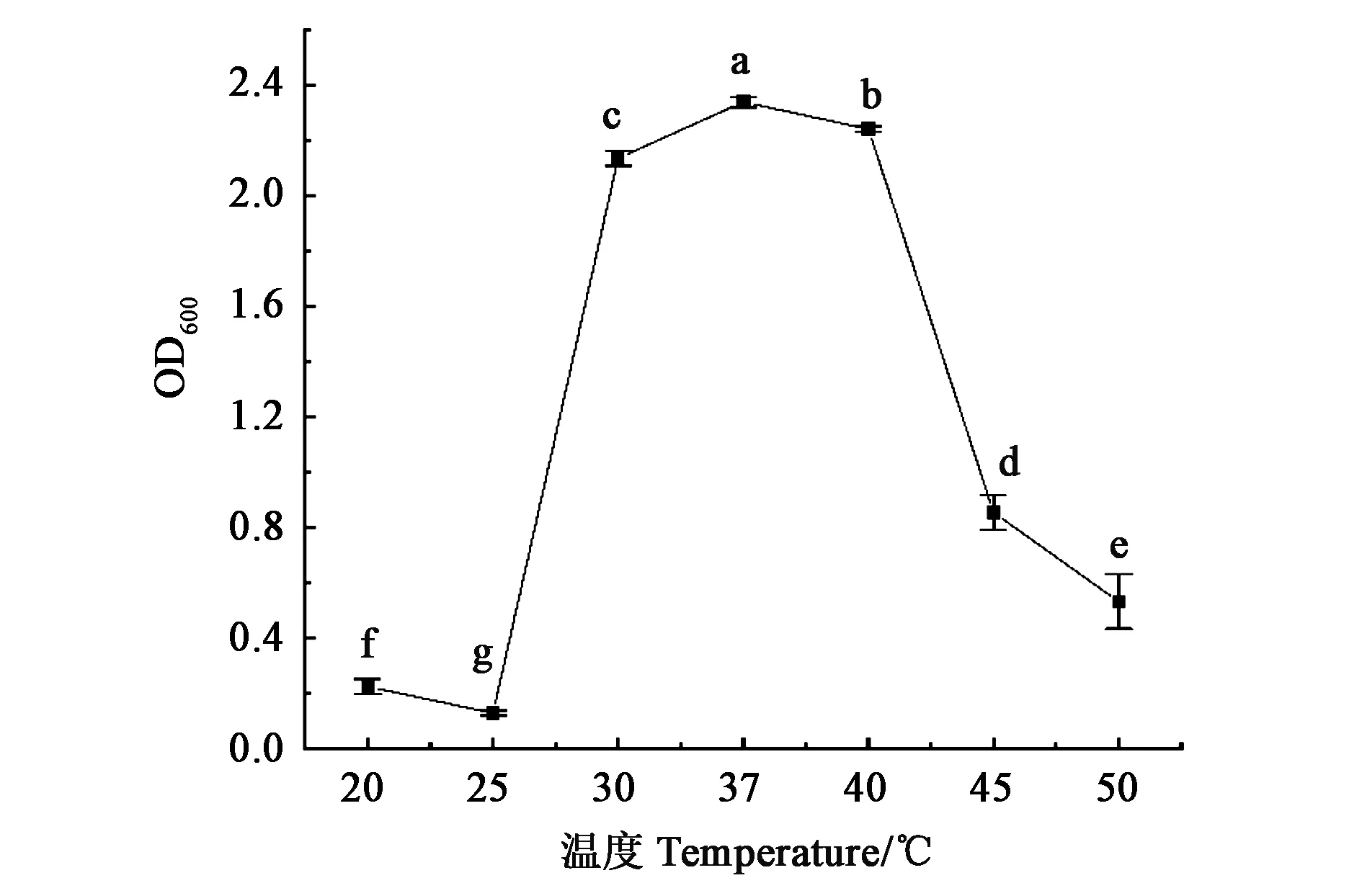
注:图中不同字母表示差异在P<0.05水平具有统计学意义。
2.2.3接种量对菌株生长的影响 由图4可知,在0.1%~3%范围内,随着接种量的增加菌株的生物量逐渐降低,接种量超过3%之后,菌株生物量的差异趋于平稳,以0.1%接种量处理时,菌株的生物量最高,显著高于其他接种量,因此最佳接种量为0.1%。

注:图中不同字母表示差异在P<0.05水平具有统计学意义。
2.2.4转速对菌株生长的影响 如图5所示,转速在120~240 r·min-1之间菌株均可以正常生长。随着转速的增加,菌株的生物量呈先上升后下降的趋势。转速为180 r·min-1时,菌株的生物量与其他转速无显著性差异,为了节约成本,以180 r·min-1为最适转速。
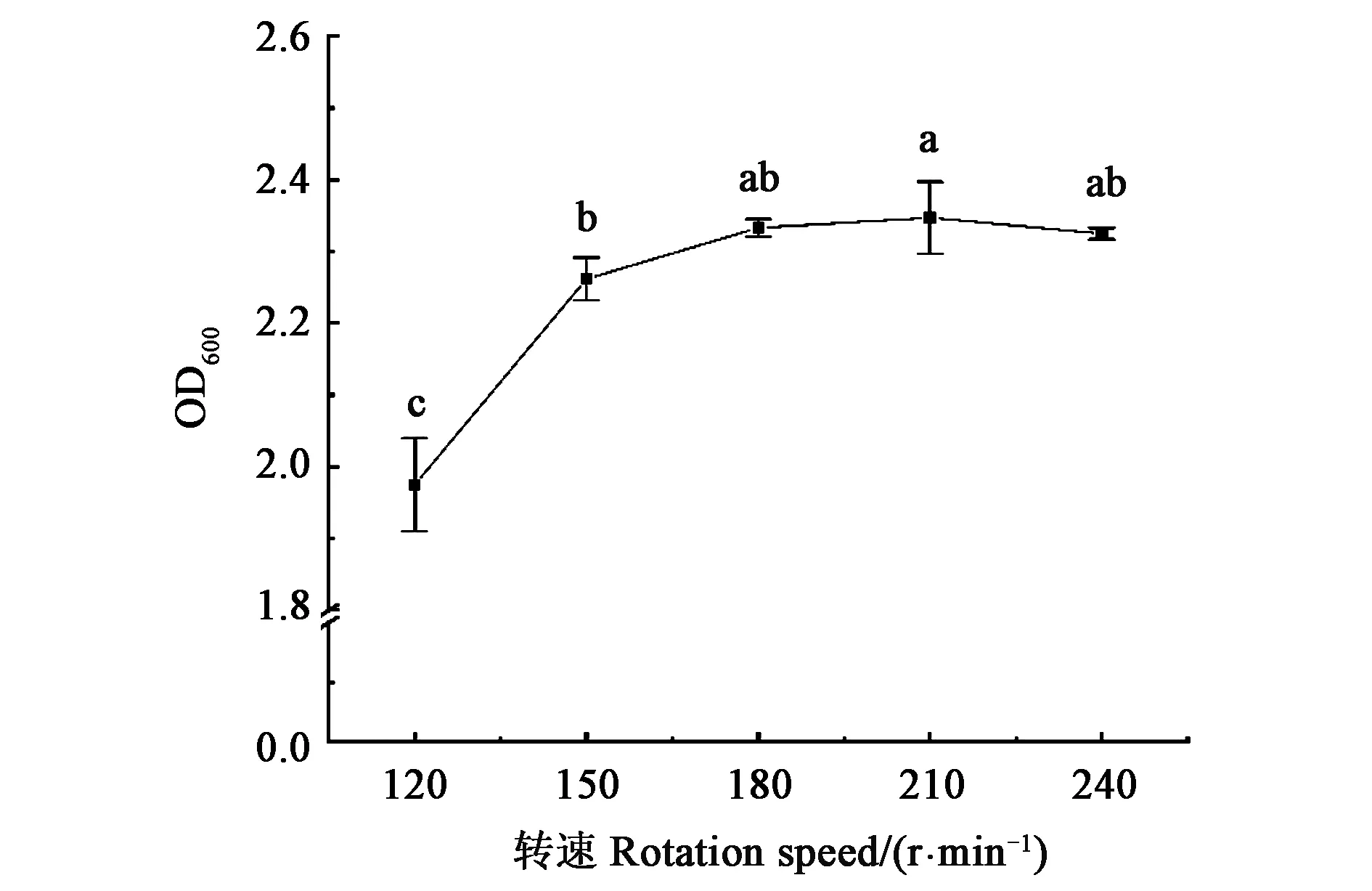
注:图中不同字母表示差异在P<0.05水平具有统计学意义。
2.2.5装液量对菌株生长的影响 如图6所示,随着装液量的增加,菌株的生物量呈下降趋势,试验结果表明,菌株发酵的最佳摇瓶装液量为50 mL摇瓶中装液20 mL,即50 mL摇瓶中最佳装液量为20 mL。

注:图中不同字母表示差异在P<0.05水平具有统计学意义。
2.3 培养基成分对菌株生长的影响
2.3.1碳源及其浓度对菌株生长的影响 从图7可以看出,HNU1菌株均能利用葡萄糖、蔗糖、麦芽糖、玉米淀粉、马铃薯淀粉等碳源,以麦芽糖为碳源时菌体生长最旺盛,蔗糖次之,以玉米淀粉为碳源时菌株的生物量最小,说明玉米淀粉不利于菌株的生长。麦芽糖市场价较高,考虑到以后工业化生产的成本,选择蔗糖为碳源。随着蔗糖浓度的增加,菌株的生物量逐渐降低,以蔗糖浓度为1 g·L-1时,菌株的生物量达到最大。

注:图中不同字母表示差异在P<0.05水平具有统计学意义。
2.3.2氮源及其浓度对菌株生长的影响 从图8可以看出,以无机氮源为培养基氮源时菌株生长量低,与对照组无显著差异。以酵母粉+胰蛋白胨(1∶2)组合的氮源为培养基氮源时菌株的生长量显著高于其他氮源。另外,在以酵母粉、蛋白胨、牛肉膏三种有机氮源两两组合为培养基氮源时,以A2组合为氮源时,菌株生物量最大,且显著高于其他组合,选择该组合为培养基的最适氮源。当氮源浓度为9 g·L-1时,菌株生长量最高,且显著高于其他浓度,氮源浓度高于9 g·L-1时,菌株的生长量趋向于平稳,因此氮源的最适浓度为9 g·L-1。
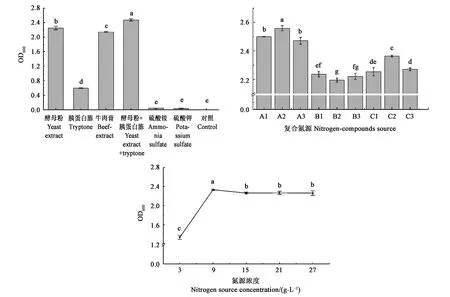
注:A1、A2、A3分别表示酵母粉与胰蛋白胨的比例为1∶1、1∶2、2∶1;B1、B2、B3分别表示酵母粉与牛肉膏的比例为1∶1、1∶2、2∶1;C1、C2、C3分别表示牛肉膏与胰蛋白胨的比例为1∶1、1∶2、2∶1。图中不同字母表示差异在P<0.05水平具有统计学意义。
2.3.3无机盐及其浓度对菌株生长的影响 从图9可以看出,以MgSO4为培养基的无机盐时菌株的生物量最大,显著高于其他无机盐,选择MgSO4作为最佳无机盐。当MgSO4的浓度为5 g·L-1时,菌株的生物量显著高于其他浓度,确定优化培养基中MgSO4的最适浓度为5 g·L-1。

注:图中不同字母表示差异在P<0.05水平具有统计学意义。
2.4 正交试验结果分析
根据单因素试验结果,采用L9(34)正交试验对碳源、氮源和无机盐等组分的配比进行优化。正交试验统计结果见表3。由表3可知,各组分影响HNU1菌株生物量的主次顺序为D>B>C>A,最优的培养组合为A2B3C2D2。结合单因素试验结果得出,HNU1菌株的最优培养基配比为蔗糖2.0 g·L-1、酵母粉4.0 g·L-1、蛋白胨6.0 g·L-1、MgSO45.0 g·L-1。利用优化培养基对HNU1菌株进行液体发酵培养后,测定发酵液的OD600值为2.398,显著高于正交试验中的9种组合,说明该优化培养基能显著提高HNU1菌株生物量。
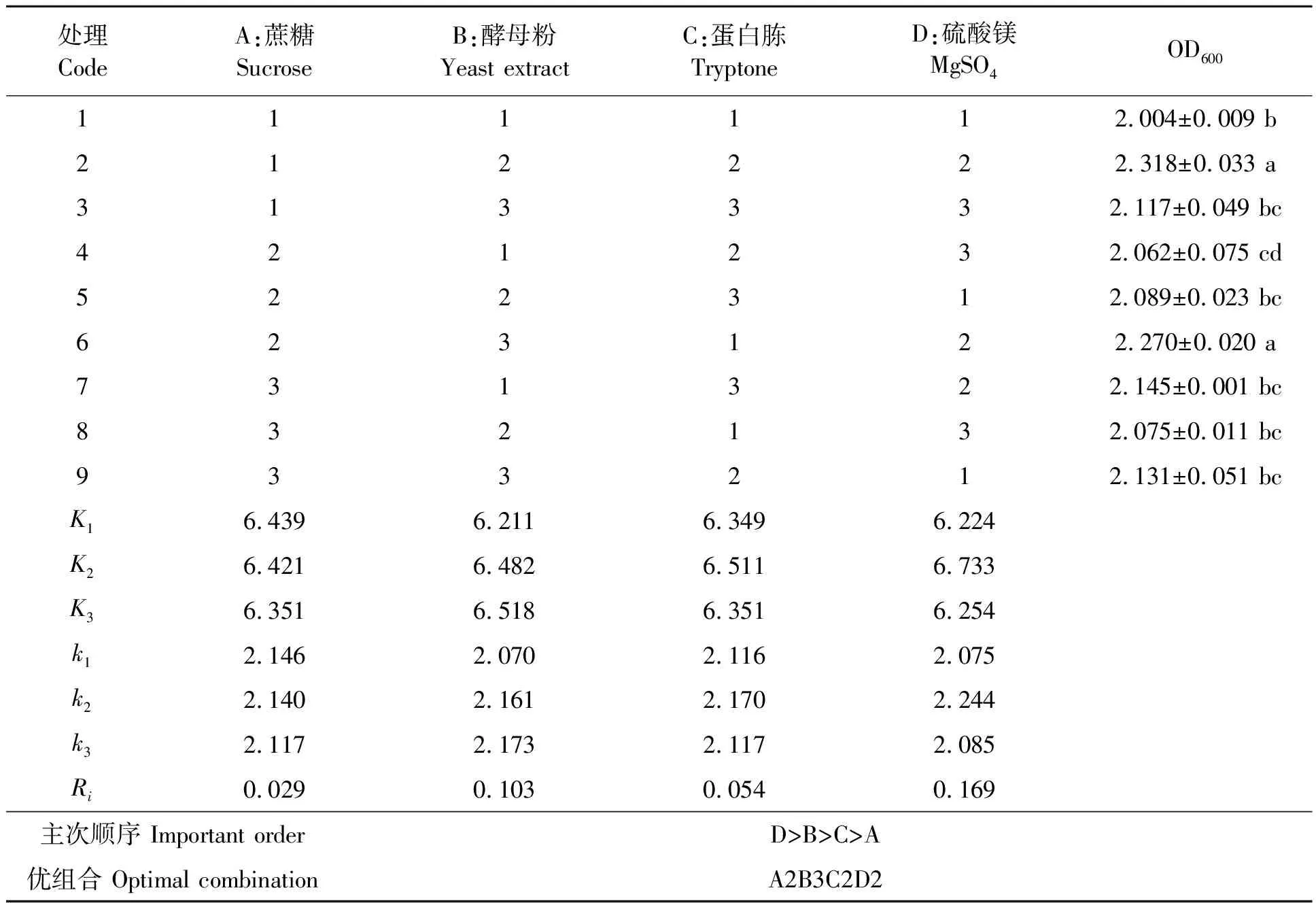
表3 培养基各组分配比优化的正交试验统计结果
3 讨论
化肥、农药的大规模使用不仅导致土壤中的重金属浓度增加,同时也出现土壤肥力降低,生态环境恶化,产品质量下降等问题[21]。大多数重金属(镉、铬、铅等)在低浓度时对生物体具有很高的毒性,在环境中不易被降解,能通过食物链在生物体内累积并危害其健康[9]。芽孢杆菌内产芽孢,抗逆性强,是广泛存在自然界中的非致病细菌,对人畜及环境安全无害,对多种病原菌均有抑制作用。解淀粉芽孢杆菌在防治植物病害中的研究报道较多,解SD-32对黄瓜白粉病菌和灰霉病菌具有良好的抑制作用[22],Kc-38对芒果炭疽病菌和枯萎病菌具有良好的抑制作用[23],SH-27对辣椒疫霉病菌有较强的抑制作用。但其在重金属污染修复中的研究报道较少,庞亚琴等[25]利用解淀粉芽孢杆菌发酵液处理受镉胁迫的小麦幼苗5 d后,其发酵液对小麦幼苗遭受的镉胁迫具有缓解作用。目前用于重金属污染修复的芽孢杆菌主要有枯草芽孢杆菌、巨大芽孢杆菌、蜡状芽孢杆菌、胶质芽孢杆菌等[26]。本课题组在前期研究中分离到一株对Cu2+具有良好富集作用的细菌菌株HNU1,通过形态观察、生理生化试验以及16S rDNA同源性分析,确定该菌株为解淀粉芽孢杆菌。为了提高HNU1菌株的生物量及找出其最适培养条件,采用单因素试验和正交试验对HUN1菌株的培养条件和培养基组分进行优化,为该菌在土壤修复中的进一步研究奠定基础。
大多数研究认为芽孢杆菌属的最佳发酵pH在6.0~7.0左右,解淀粉芽孢杆菌15-1-1的最适初始pH为7.0[27],短小芽孢杆菌的最佳初始pH为7.2[28],枯草芽孢杆菌NJ-18的最适初始pH为6.8[29],解淀粉芽孢杆菌FS6最适培养pH为6.0[30],解淀粉芽孢杆菌HF-01的最佳初始pH为6.0~6.5[31]。与前人研究结果不同,本研究中HNU1菌株的最适初始pH为8.0,且菌株在pH 5~8的范围内生长良好,其OD值均在2.30以上,说明该菌在偏酸以及偏碱的环境中均可良好生长,适应范围广。HNU1菌株的最适pH偏碱性,在大规模发酵时可添加适量的碱液,既能满足菌株生长的pH条件,也能在发酵过程中抑制其他杂菌生长,保证发酵菌液的纯度。
多数研究结果表明,芽孢杆菌的最适培养温度在30~37 ℃左右,如解淀粉芽孢杆菌HF-01的最佳培养温度为28 ℃[31],BAB-1为30 ℃[32],TB2菌株为35 ℃[33]。HNU1菌株在30~40 ℃均可良好生长,在37 ℃时菌株的生物量最高,与前人研究报道一致。但HNU1菌株在40~50 ℃下的生物量显著高于20~30 ℃下的生物量,说明该菌可耐高温环境,在土壤中具有更强的存活能力。在大规模发酵时可高温发酵,既能达到菌量的要求,也能降低发酵过程中用于冷却降温的成本。在大多数的菌种优化培养研究中,菌种的最佳接种量均在1%以上。如郭龙涛等[33]以3%接种量为解淀粉芽孢杆菌TB2的最佳接种量。魏立娟等[34]以14%接种量为解淀粉芽孢杆菌262AG6菌株的最佳接种量。与前人研究结果不同,HNU1菌株的最佳接种量为0.1%,说明HNU1菌株对培养条件的要求较低,在大规模发酵过程中可降低成本。HNU1菌株的生长量随着转速的升高而成先上升后下降的趋势,与魏娇洋等[35]研究结果一致。
在碳源优化结果中,HNU1菌株以麦芽糖为碳源时生物量最高,蔗糖次之。两者的生物量差异不显著,麦芽糖的市场价较高,选取蔗糖为HUN1菌株的最适碳源。与赵晓燕等[36]研究解淀粉芽孢杆菌XLA03的最佳碳源为玉米淀粉不同,HNU1菌株以玉米淀粉为碳源时的生物量最低,可能是由菌株间的生物学特性差异所致。在氮源优化结果中,HNU1菌株以(NH4)2SO4、KNO3等无机氮源为培养基氮源时菌株基本不生长,与刘文波等[37]研究结果一致。在单一有机氮源中,HNU1菌株以酵母粉为氮源时生物量最高,牛肉膏次之,最后是胰蛋白胨。在复合氮源中,以酵母粉+胰蛋白胨组合为氮源时菌株的生物量最高,其次是牛肉膏+胰蛋白胨组合,最后是酵母粉+胰蛋白胨组合。因此推测胰蛋白胨在HNU1菌株的发酵过程中的主要作用是提供生长因子,其具体作用需进一步研究。
本研究鉴定的解淀粉芽孢杆菌HNU1菌株对Cu2+具有良好的富集作用,可开发为铜污染土壤的修复菌种。为了使HNU1菌株土壤环境中可以稳定生存及繁殖,可根据本研究结果将HNU1菌株发酵制成微生物肥料,并在肥料中添加菌株的最适营养物质,为菌株在土壤环境中的生存和定殖提供营养。本研究鉴定的解淀粉芽孢杆菌HNU1菌株可为开发重金属污染修复菌种提供参考,对重金属污染土壤修复和改良具有重大意义。
