田菁种子内生菌的分离及其对萌发的影响
2020-03-15张凯晔刘晓琳董小燕刘润进贺立恒解志红
张凯晔, 刘晓琳, 董小燕,3, 刘润进, 贺立恒, 解志红,3*
(1.山西农业大学农学院, 山西 太谷 030801;2.中国科学院烟台海岸带研究所, 山东 烟台 264003;3.中科院海洋大科学研究中心, 山东 青岛 266071; 4.青岛农业大学植物医学学院, 山东 青岛 266000)
内生菌是与植物共生的微生物,通常指的是至少某一个生活史阶段与植物共生的微生物,内生菌主要包括真菌、细菌和放线菌[1]。内生菌在植物生长发育、抗逆境胁迫以及生态适应中具有重要的功能[2]。例如,用具有ACC酶活性的内生菌Pseudomonasmigulae8R6和PseudomonasfluorescensYsS6接种番茄种子,在正常及盐胁迫下均可以促进番茄生长,提高生物量[3]。内生菌EnterobacterradicincitansDSM 16656具有固氮以及溶磷两种促生特性,该内生菌不仅可以提高农作物的产量,而且该内生菌还可以通过刺激拟南芥水杨酸/乙烯信号途径来提高植物抗病性[4]。由以上研究结果可见,内生菌是巨大的植物促生菌资源库,分离培养内生菌可以应用于农业生产,具有广阔的前景。田菁(S.cannabina)为豆科田菁属一年生草本植物,其鲜草养分十分丰富,作为改善土壤肥力的绿肥作物被广泛种植。田菁根系发达,抗旱、抗病虫害能力较强,且具有较强的耐盐碱、耐洪涝能力[5]。田菁的根际微生物和内生菌对于其抗逆性具有重要作用。田菁根瘤菌主要分布于Ensifer、Neorhizobium和Rhizobium三个属[6]。普通田菁大约苗龄10 d主根开始结瘤,在长达120 d固氮周期中[7],其主根侧根均有根瘤形成,所以其固氮能力较高,现已被广泛应用到盐碱地改良中。
种子表面与内部携带有丰富的微生物种群,可作为多种有益细菌和病原菌的载体,且内生菌的数量对种子的发育具有重要作用。马同锁等[8]研究发现,油菜种子内生菌数量与萌发率相关,内生菌数量下降萌发率降低。内生菌不仅可以影响种子的萌发,种子对内生菌的生长也具有调控作用,吴欣等[9]研究发现,添加种子提取物后内生菌的生长态势,菌株发酵产物的抗菌活性也随之提高。IAA能促进植物伸长,是常见的植物激素,同时也是植物生长发育调控的重要信号分子[10];而溶磷菌则可以将土壤中植物难以吸收的不溶性磷元素转化为可吸收型磷元素,促进植物生长[11];铁载体不仅可以帮助植物吸收土壤中铁元素,而且可以通过与病原菌竞争铁离子的吸收来达到拮抗作用[12]。外源接种具有促生特性的种子内生菌可以促进植物的生长,如Verma等[13]研究发现,具有IAA产生能力、溶磷能力和拮抗病原菌Fusariumoxysporu的水稻种子内生菌可以促进根毛的发育和种子的生长以及活性氧的产生。在种子萌发过程中,内生菌移动至种子际开始定殖在种子表面和植物根部[14]。田菁所生存的盐碱地土壤结构差,主要表现为土壤板结,且拥有特殊的微生物群落[15]。在田菁早期成长过程中伴随着种子萌发,内生菌以及周围环境中的微生物逐渐定殖到根部,形成根际微生物。种子内生菌作为在植物早期发育过程中的共生细菌,对于植物生长具有重要意义,然而田菁种子内生菌中是否有促生菌以及其促生机制还不清楚。因此,深入探究田菁种子内生菌的促生特性可以为田菁改良盐碱地的田间应用提供理论依据。
本研究从普通田菁种子中分离筛选到了79株菌株,其中34株具有IAA分泌能力,对其中的6株进行16S rRNA基因序列分析,确认了它们的系统发育地位,并测定了溶磷能力和铁载体合成能力,通过浸种发芽试验进一步检测内生菌的促生作用。本研究主要目的是探究普通田菁种子内生菌的种类及内生菌对种子发育所起的作用,同时挖掘促生菌用于生产实践,旨在为微生物菌肥的研发与应用奠定试验基础。
1 材料和方法
1.1 田菁种子
普通田菁(S.cannabina)品种为鲁菁一号,种子由山东省农业科学院提供。
1.2 培养基
①LB培养基:蛋白胨10 g·L-1、酵母膏5 g·L-1、NaCl 10 g·L-1、琼脂 10~20 g·L-1、pH 7.0~7.5。
②高氏一号培养基[16]:可溶性淀粉20 g·L-1、NaCl 0.5 g·L-1、KNO31 g·L-1、K2HPO4·3H2O 0.5 g·L-1、MgSO4·7H2O 0.5 g·L-1、FeSO4·7H2O 0.01 g·L-1、琼脂10~20 g·L-1、pH 7.2。
③Pikovskava无机解磷培养基:葡萄糖 10.0 g·L-1、(NH4)2SO40.5 g·L-1、MgSO4·7H2O 0.3 g·L-1、FeSO4·7H2O 0.3 g·L-1、MnSO4·7H2O 0.03 g·L-1、Ca3(PO4)25 g·L-1、、pH 7.0~7.5,固体培养基添加琼脂15.0~18.0 g·L-1。
④CAS培养基[17]:铬天青S 0.012 g、FeCl3溶液 10 mmol·L-1、HTDMA 0.015 g·L-1、哌嗪-1,4-二乙磺酸(PIPES)6.04 g·L-1、琼脂3.2 g·L-1、CaCl2溶液0.11 g·L-1、MgSO4·7H2O溶液0.25 g·L-1、20%葡萄糖、10%水解酪素、KH2PO415 g·L-1、NaCl 25 g·L-1、NH4Cl 50 g·L-1。
1.3 菌种分离
挑选田菁种子0.5 g,75%酒精处理30 s,无菌水冲洗3~5次,10%次氯酸钠浸泡处理10 min,无菌水冲洗3~5次。由于田菁种子质地较坚硬,用磷酸缓冲液(NaCl 8 g·L-1、KCl 0.2 g·L-1、Na2HPO41.44 g·L-1、KH2PO40.24 g·L-1、pH 7.4)浸种48 h,然后进行研磨,取匀浆上清液1 mL稀释为10-1~10-7,分别取100 μL涂布LB和高氏一号固体平板,每个稀释梯度重复三次。将固体平板置于恒温培养箱30℃暗培养。待菌株长成菌落后挑取不同菌落形态和大小的菌株利用平板划线法纯化,待所分离菌株菌落形态一致,以30%甘油保藏菌种。
1.4 16S rRNA扩增
采用通用引物27F(5’-AGAGTTTGATC-CTGGCTCAG)和1492R(5’-GGTTACCTTGTT-ACGACTT)扩增16S rRNA序列,引物由睿博兴科生物技术有限公司合成。PCR扩增体系:模版1 μL,引物各1 μL,2×EasyTaqPCRSuperMix 8 μL,加水补足20 μL。PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,55~65 ℃退火30 s,72 ℃延伸80 s,30次循环;72 ℃延伸5 min,12 ℃保温。获得序列经过琼脂糖凝胶电泳检测后送交睿博兴科进行测序,获得拼接序列后在NCBI数据库进行BLAST比对,选取同源性较高模式菌株序列使用MEGA X 10.0.5进行序列比对构建进化树。
1.5 内生菌株产IAA能力测定
将所分离的菌株接种到LB液体培养基中,30 ℃、180 r·min-1培养24 h。随后将菌液以1%接菌量转接至含色氨酸(200 mg·L-1)LB液体培养基中,30 ℃、180 r·min-1培养48 h[18]。将菌株培养液8 000 r·min-1离心1 min,取上清液与Salkowski比色液(0.5 mol·L-1FeCl3溶液10 mL,35% HClO4500 mL)等量混合,暗处放置30 min后观察显色情况,空白对照为未接菌的培养基与比色剂的混合液。与对照相比培养液变色的为阳性反应结果,即该菌株可分泌IAA。
配置100 mg·L-1IAA储藏液,配置浓度为0、0.5、1.0、5.0、10.0、15.0、20.0、25.0 mg·L-1的系列标准液。取各标准液2 mL,分别加入Salkowski试剂。置于恒温培养箱40 ℃避光保温30 min,酶标仪(TECAN Infinite, M200PRO)测量OD530(optical density, OD),绘制标准曲线。
选取定性实验呈阳性的菌株接种至含L-色氨酸的LB液体培养基中,30 ℃、180 r·min-1培养4 d。取菌液2 mL于离心管,10 000 r·min-1离心10 min,取100 μL上清液加入96孔板,加入等体积Salkowski比色液,避光静置30 min显色,以酶标仪测定其OD530。利用标准曲线可得单位体积发酵液IAA的含量。
1.6 内生菌株解磷能力测定
将分离得到的内生菌接种于LB液体培养基,30 ℃、180 r·min-1培养24 h,用打孔器在Pikovskava无机解磷固体培养基上打直径约为0.5 cm的孔[19],将菌液点入,30 ℃培养7 d,菌落周围出现透明圈即为阳性。
采用钼锑扛显色法[20]定量测定溶解无机磷。①配置5 mg·L-1的磷标准溶液,比色管中加入1 mL钼锑抗显色剂,吸取不同量磷标准液于比色管中,加入1 mL钼锑抗显色剂,蒸馏水定容至10 mL。混匀静置15~20 min,以酶标仪测量各反应液OD700。根据测量结果绘制磷标准曲线。②选取无机磷平板实验的阳性菌株接种于LB液体培养基,30℃、180 r·min-1培养1 d。将菌液接种于无机磷培养基,30℃、180 r·min-1培养7 d。发酵液8 000 r·min-1离心10 min,取上清液20 μL加1 mL钼锑抗显色剂,超纯水定容至10 mL,混匀静置20 min,测量反应液OD700。用标准曲线可得发酵液的溶磷浓度。
1.7 内生菌产铁载体的测定
将六株内生菌菌悬液点接至CAS培养基,每次5 μL,30 ℃培养48 h,设3个重复。观察菌株生长,菌落周围出现橙黄色晕圈即为可合成铁载体。
1.8 内生菌促生效果检测
将所选菌株接种于LB培养基30 ℃、180 r·min-1培养24 h,分别调节菌液OD600为0.25、0.50、1.00作为三种浸种液,以LB培养基(0)为对照。选择饱满形状均一的鲁菁一号田菁种子,表面消毒后,分别用不同菌株不同OD的菌悬液、LB液体培养基浸种1 h,每个处理处理约30粒种子,每个处理处理设置三个重复[21]。将种子放置于垫有滤纸的培养皿中,加入10 mL灭菌水,置于恒温培养箱30℃暗培养。观察每日发芽情况。发芽数连续3 d不变之后停止统计。内生菌对种子萌发和幼苗的影响主要有以下指标需要测量[22]。
发芽势(GE)=种子发芽达到最高峰的发芽粒数/供试种子总数×100%
活力系数(VI)=幼苗生长势(种苗全长)×发芽指数
发芽指数(GI)=∑(Gt/Dt)
式中,Gt为第t天发芽数,Dt为相应发芽天数。
1.9 内生菌对种子胚根发育的影响
从每个处理组及对照组随机选取10株测量其幼苗全长和胚根长度,计算胚根占全长的百分比,作为种子胚根的发育指标。
1.10 数据处理
所获得的数据结果使用Excel 2017记录及绘制图表,并使用SPSS Statistic 20统计分析。采用ANOVA进行同一内生菌处理内显著性分析,采用Duncan法两两比较。
2 结果与分析
2.1 内生菌的分离鉴定和实验菌株的筛选
经分离筛选,共得到79株内生菌。将内生菌的16S rRNA序列通过BLAST比对发现,分离获得的内生菌主要属于Bacillus、Azorhizobium、Cellulosimicrobium三个属。其中Cellulosimicrobium2株、Bacillus38株、Azorhizobium39株。通过检测发现共有34株具有产IAA活性,IAA产量范围为(1.285±0.1911)~(25.47±1.873)mg·L-1。在具有IAA合成能力的内生菌中,Azorhizobium占比85.3%,Bacillus和Cellulosimicrobium分别占比11.7%、3%。IAA产量最高为菌株SC60,最低为菌株SC37。从这34株IAA合成菌株中选出SC5、SC17、SC24、SC45、SC59、SC60菌作为试验对象。6株内生菌IAA产量如表1所示,产量在(8.922±0.096)~(25.47 0±1.873)mg·L-1内。
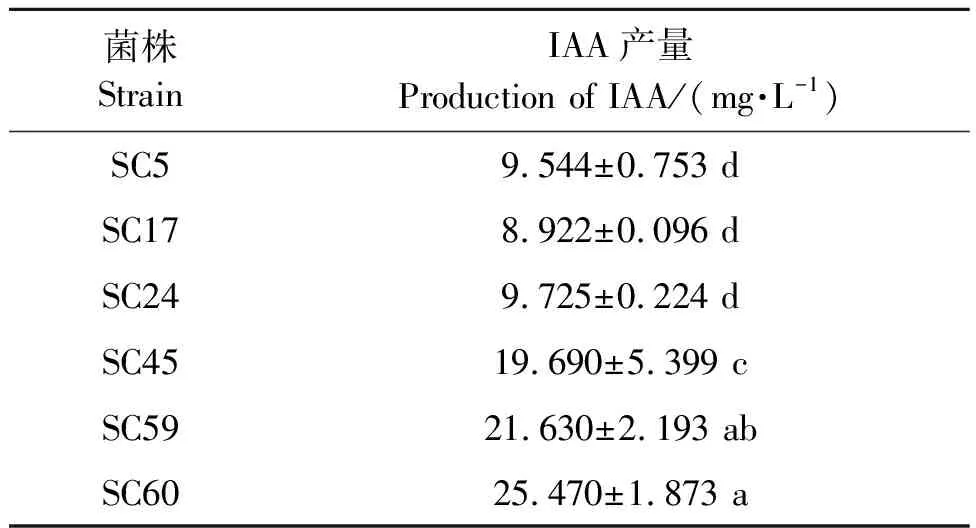
表1 内生菌的IAA产量
2.2 菌株16S rRNA分析
通过16S rRNA序列比对,获取实验菌株及与实验菌株相似性高的代表菌株16S rRNA序列,构建发育系统树,如图1所示。从图1可得知,SC5、SC17以及SC24与AzorhizobiumcaulinodansORS571的16S rRNA序列相似度最高,聚类于一支,序列相似性均高于99%。SC45、SC59、SC60与BacillusvelezensisCR-502聚类于一支,且三株菌与其序列相似性均高于99%。一般设定16S rRNA序列相似性超过97%的原核生物属于一个种[23]。因此,SC5、SC17、SC24属于Azorhizobiumcaulinodans,SC45、SC59、SC60属于Bacillusvelezensis。
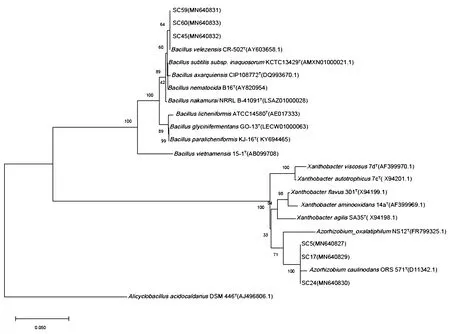
图1 16S rRNA系统发育进化树
2.3 内生菌促生特性
定殖在根际的微生物通常会发挥其促进植物生长的特性,比如调节植物激素水平、溶磷、产氨气以及产铁载体等[24]。为了进一步探究所筛选的菌株的促生特性,本研究检测了所选6株菌的溶磷能力和产铁载体能力。
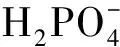
2.3.2内生菌铁载体合成能力 铁载体是微生物在限铁条件下产生的小分子有机物,其结构复杂,可以特异性结合铁离子。经证明铁载体可以增强细菌和植物对铁离子的吸收。6株内生菌只有SC45可产铁载体(表2),SC45经过CAS平板培养后产生了黄色晕圈,而不产铁载体菌株点接后的阴性对照没有变化(图2),由此证明SC45具有分泌铁载体到环境中的能力。
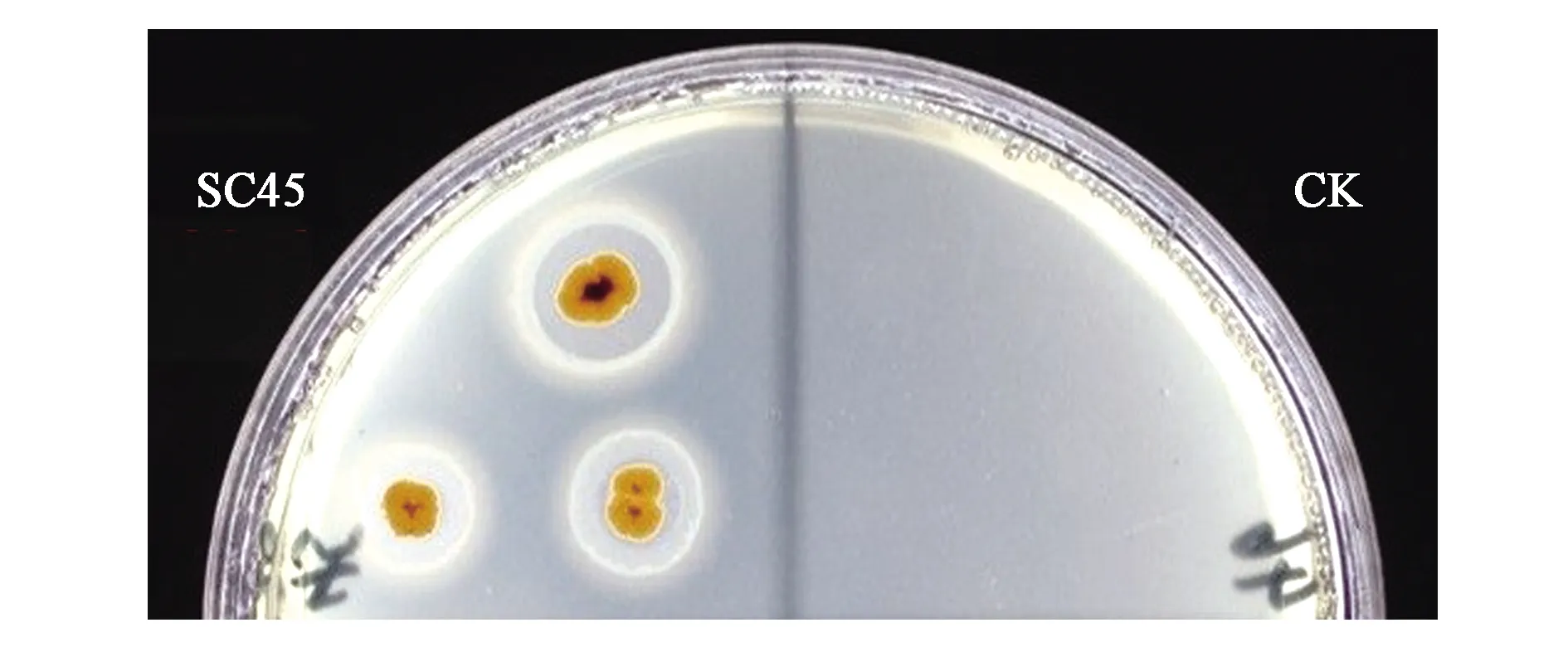
图2 CAS平板检测产铁载体

表2 内生菌的促生功能
2.4 内生菌对田菁种子的促生作用
种子萌发是植物生命周期的开始,种子萌发后环境微生物和内生菌定殖在植物,可用种子萌发试验来判断所接种的菌株是否具有促生效果。本研究主要检测了种子萌发的发芽势、种子活力系数和胚根占比。
2.4.1内生菌浸种对发芽势的影响 发芽势高代表种子萌发的较为快速且集中,有利于作物的生长,尤其在逆境胁迫下统一快速的出苗生长有利于植物适应外界环境,也有利于机械化的农业生产。经过不同浓度菌液浸种处理,内生菌对种子发芽势的影响如图3所示,SC17浸种处理,在浸种菌液OD600为0.50和0.25时,田菁种子的发芽势显著提高,分别比OD600为0.00时提高了38.6%和36.3%(P<0.05)。由此可见,用SC17浸种会显著促进种子萌发,其余菌株浸种对种子的发芽势无显著影响。
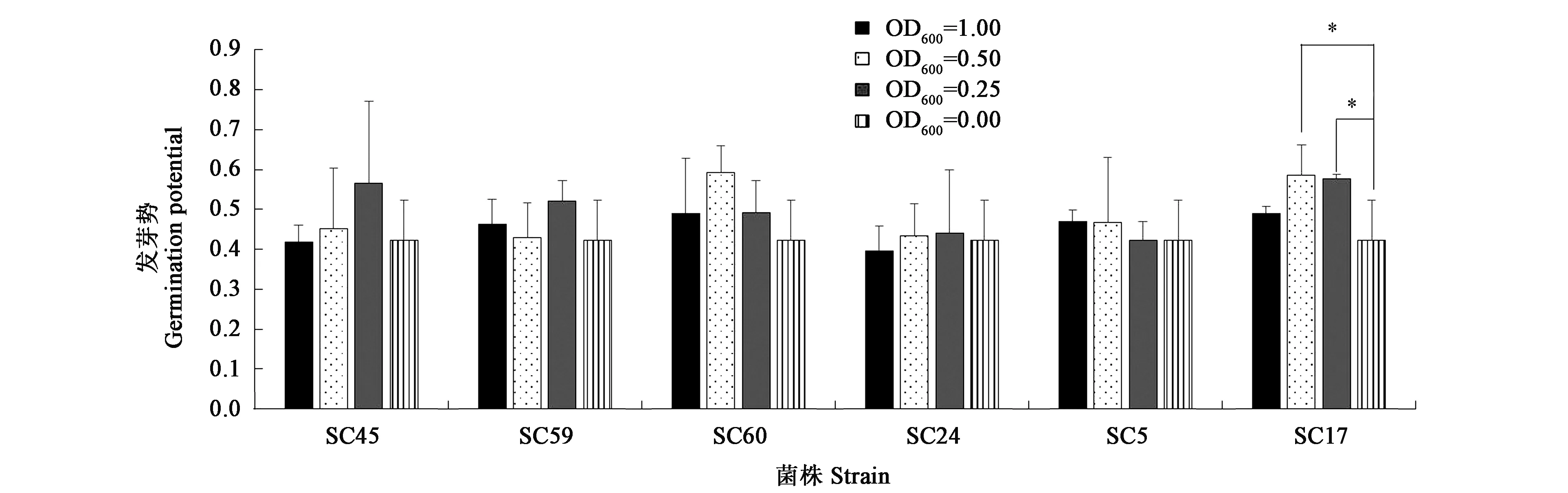
注:*代表与对照相比差异具有统计学意义(P<0.05)。
2.4.2内生菌浸种对种子活力系数的影响 从图4可得知,SC59和SC17浸种处理种子,种子活力在浸种菌液OD600为0.50,比CK(OD600=0.00)显著提高了29.9%和26.7%;SC45和SC60在浸种菌液OD600为0.25时可显著提高田菁种子的活力系数,分别可提高13.3%和14.1%;在较高浓度下,对种子活力系数影响不显著。SC24和SC5浸种对种子活力系数影响不显著。
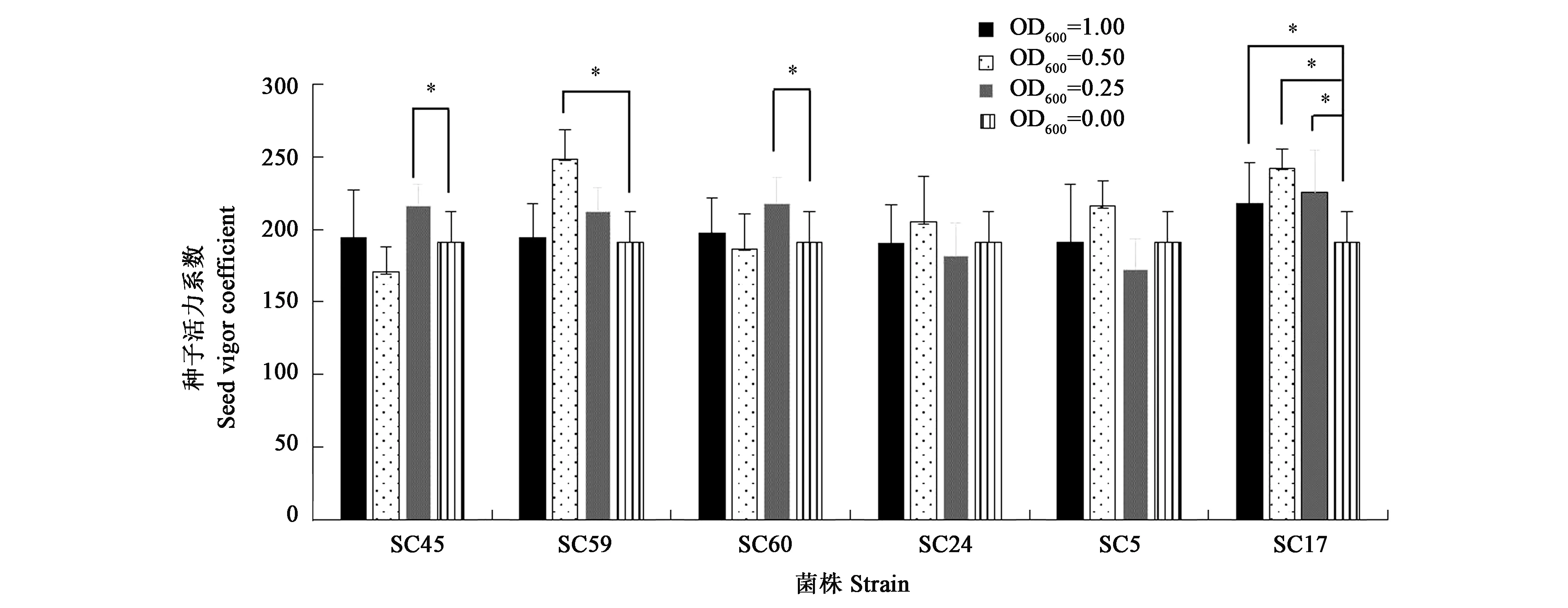
注:*代表与对照相比差异具有统计学意义(P<0.05)。
2.4.3内生菌浸种促进了胚根的发育 胚根的生长情况与植物的萌发和生长相关[25],促进胚根的发育有利于促进植物的早期生长。内生菌浸种对幼苗胚根发育的影响如图5所示。SC60在浸种菌液以OD600为0.50、0.25浸种后促进胚根的发育,胚根占幼苗全长的比例分别比CK(OD600=0.00)提高了29.5%、16.1%。以菌株SC17浸种菌液OD600为0.25浸种亦可促进胚根的发育,与对照相比,胚根占全长比例提高了13%。其余菌种浸种对胚根发育未见显著性影响。
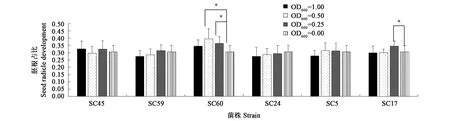
注:*代表与对照相比差异具有统计学意义(P<0.05)。
3 讨论
本研究分离到的菌株分布于三个属:Bacillus、Azorhizobium、Cellulosimicrobium。分离到的菌株相较于根际微生物或者是其余组织的内生菌数量较少,这可能与田菁种子发育后期高渗透压的环境[26]和分离过程中所选用的培养基种类较少相关。所分离到的菌株中Cellulosimicrobium属于放线菌,在以往研究中该属的菌株具有耐盐碱及重金属的特性,其与田菁耐盐碱之间的相关性需要深入研究探索。
在种子萌发过程中,各种激素扮演着重要的作用。其中IAA与小分子物质KARs协同作用,调控着种子的萌发[27],适量的外源IAA可以促进种子的萌发,IAA影响植物的侧根发育、细胞分裂以及细胞延长[28]。分离自龙葵根际微生物的PGPB菌株Bacillussubtilis和Bacilluscereus均具有分泌IAA能力,可促进植物的生长[29]。因此,本文选取了6株可分泌IAA的菌株进行了研究,其中3株具有溶解无机磷能力,1株具有产铁载体能力。植物在自然界中只可以利用矿质肥料中20%~30%的磷肥,这是由于矿物质磷肥在自然界中会和其他元素结合,例如钙元素。使用具有溶磷能力的细菌可以使植物获得更多的有效磷元素[30]。从香蕉根部分离的溶磷细菌溶解Ca3(PO4)2的能力在2~15.12 mg·L-1[31],相较于本研究所选取的菌株溶磷能力较低。溶磷菌Bacillussp.具有产铁载体能力(16.06 mg·L-1)和产IAA能力(30.58 mg·L-1),接种薄荷后可以提高植物的鲜重和干重,提高出油率[32]。本研究所选取的菌株均可产IAA,部分内生菌具有溶磷和合成铁载体特性。
通过种子发芽试验发现,内生菌浸种可以提高种子萌发的发芽势和种子活力系数,促进胚根的发育。该结果与核桃内生菌XHE8对红苋菜种子萌发的影响结果[33]相似,内生菌虽然对种子萌发的影响不显著,但促进了种子幼芽和根的发育。种子活力是一个重要的种子生理指标,对于快速统一的种子发育以及延长种子的储存寿命有重要意义,最关键的是种子活力高可以帮助种子抵御萌发中的胁迫以及可以提高种子的耐储存性[34]。本研究计算种子活力选用的是幼苗全长,种子活力高代表在一定时间内,幼苗生长受到了促进。干旱[35]、盐、重金属会抑制植物胚根的生长进而抑制植物生长,反之促进胚根发育可以促进植物的生长。
本研究分离的菌株中,SC60和SC17显著促进了胚根发育和提高了种子活力,有利于种子统一快速出苗和幼苗的生长。SC60解磷能力较高,在后续植物的生长过程中有利于与植物吸收环境中的磷元素。因此,SC60可作为潜在的促生菌,用于提高种子活力促进幼苗发育和植物生长,具有一定的应用价值,可作为潜在绿色肥料。
