陆地棉Ghuhrf1基因及其启动子的克隆与功能分析
2020-03-15杨江涛王旭静哈斯阿古拉王志兴
杨江涛, 王旭静, 哈斯阿古拉, 王志兴
(1.中国农业科学院生物技术研究所,北京 100081;2.内蒙古大学生命科学学院,呼和浩特 010021)
棉花是重要的经济作物,不仅是重要的油料和纤维作物,也是纺织制造业的优选原料,并且还是重要的战略储备物资。由于其具有较强的抗旱耐盐能力,也是缺水地区和盐碱地区的优选种植作物之一[1]。随着物质生活和消费水平的日益提高,人们对棉纺织品的质量要求和需求也越来越高[2],高新纺纱制造业对原棉的品质也提出了更高的要求。因此,培育高品质棉花纤维新品种已经成为目前棉花育种工作的首要目标之一。
由于棉花生长周期长、种质间相互利用困难、纤维产量与品质呈负相关关系等因素的制约,采用常规杂交育种方法很难在短期内培育出纤维品质优良的棉花新品种。转基因技术的发展和应用为棉花纤维品质的改良提供了一条新的途径[3]。它能够克服物种间远缘杂交不亲和的障碍,将其他物种中具有优良性状的基因克隆到棉花基因组中,从而提高棉花各方面的抗性和纤维的品质。研究人员经过20多年的努力,克隆出了许多直接参与棉纤维合成和调控纤维伸长发育相关的基因及其启动子,例如,海岛棉纤维优势表达FbL2A基因及其启动子[4]、陆地棉编码β-微管蛋白纤维优势表达GhTUB1基因及其启动子[5]、在棉纤维发育全过程中特异表达的FSltp4基因启动子[6]、纤维伸长期优势表达GhCPK1基因及其启动子[7]、调控纤维发育的纤维特异表达GhPRP5基因及其启动子[8]、棉纤维特异表达的CFSP基因启动子[9]、陆地棉纤维优势表达基因GhRACK1的启动子[3]、海岛棉纤维特异表达GbEXPA2基因及其启动子[10]以及棉绒纤维发育相关的调控基因MIXTA[11]等。上述基因为培育优良纤维品质的棉花新种质提供了扎实的理论基础。
Uhrf1编码具有RING结构域的E3泛素蛋白连接酶,其参与调节植物分生组织中细胞的分裂分化和增殖过程。例如,拟南芥PUB4可以调节根部分生组织中细胞的不对称分裂和细胞增殖,进而促进根的生长发育[12];水稻TUD1与异三聚体Ga亚基相互作用共同调节水稻中的油菜素类固醇(BR)信号传导途径,从而介导水稻的生长发育[13];烟草PUB4是与CHRK1受体类激酶相互作用的配偶体,并且可能参与调节由CHRK1介导的植物绒毯层细胞分化生长和降解途径[14]。棉纤维是单个胚珠外珠被表皮细胞经过特殊化的起始分化、伸长、增厚和脱水,最终形成成熟表皮纤维[15]。棉花纤维原始细胞的分化起始是一个极其复杂的代谢过程,依赖多种物质信号进行多层次多途径的精确网络调控,并且棉花胚珠外珠被表皮细胞突起的多少决定最终成熟纤维的数量,而分化起始的早晚决定纤维长短绒的类型[16]。因此,推测Uhrf1在棉纤维原始细胞分化起始过程中发挥着重要作用。
开发纤维特异启动子或种皮发育特异启动子是我国棉花优质纤维新品种研究的主要目标之一。本研究通过对棉花根叶混合和纤维两个转录组测序数据进行差异基因表达谱分析,发现Ghuhrf1基因属于纤维细胞分化起始期优势表达基因。基于陆地棉TM-1基因组数据库信息,克隆了Ghuhrf1基因的5’上游启动子Ghuhrf1-Pro序列,构建不同长度缺失体分析了启动子序列中的重要顺式作用元件,以期为Ghuhrf1基因的功能研究奠定基础,并为棉花纤维品质改良基因工程提供新的基因资源和调控元件。
1 材料与方法
1.1 试验材料
1.1.1供试材料 陆地棉(Gossypiumhirsutum)苏棉12、本氏烟草(Nicotianabenthamiana)和野生型拟南芥(Col0)种子由本实验室保存,大肠杆菌E.coliDH5α感受态购自北京康为世纪生物科技有限公司;pMD18-T载体购自宝日医生物技术(北京)有限公司,农杆菌LBA4404、植物表达载体pCambia 1305.1由本实验室保存。
1.1.2主要试剂 常规质粒提取和琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司;限制性内切酶和T4 DNA连接酶购于NEB公司;高保真DNA聚合酶购于南京诺唯赞生物科技有限公司;RACE试剂盒(The GeneRacerTMRNA Oligo)购自Thermo Fisher Scientific公司;其他生化试剂均为分析纯,购自北京拜尔迪生物技术有限公司。基因测序和引物合成均由生工生物工程(上海)股份有限公司完成。
1.2 试验方法
1.2.1Ghuhrf1基因全长cDNA的克隆 参考The GeneRacerTMRNA Oligo试剂盒说明书,首先对纤维mRNA进行脱磷、脱帽处理,然后再以Oligo dT为引物进行反转录,最后以GeneRacer 5’Primer/Ghuhrf1-5’GSP1和GeneRacer 5’Nested Primer/Ghuhrf1-5’GSP2为引物(表1),通过两次PCR从棉纤维cDNA中扩增得到Ghuhrf1的5’末端产物。PCR反应条件:94 ℃ 5 min;94 ℃ 45 s,56 ℃ 45 s,72 ℃ 1 min,30 个循环;72 ℃ 10 min。同理,以GeneRacer 3’Primer/Ghuhrf1-3’GSP1和GeneRacer 3’Nested Primer/Ghuhrf1-3’GSP2为引物(表1),进行两轮PCR得到3’末端产物,PCR反应条件:94 ℃ 5 min;94 ℃ 45 s,58 ℃ 1 min,72 ℃ 1 min,30 个循环;72 ℃ 8 min。将得到的产物连接到pMD18-T载体上,送至生工生物工程(上海)股份有限公司进行测序,组装后获得Ghuhrf1的全长cDNA。
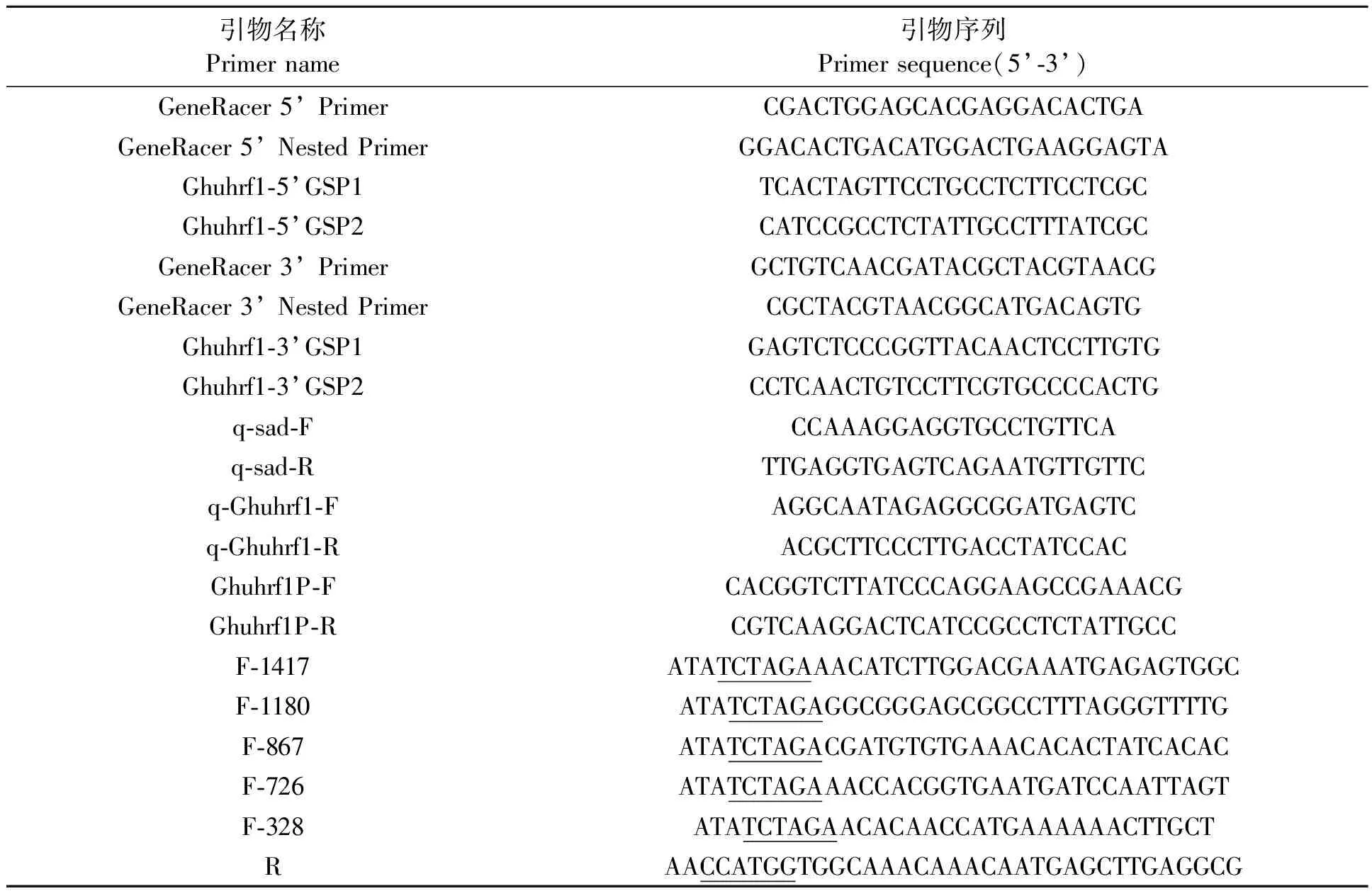
表1 本研究所用的引物
1.2.2Ghuhrf1基因荧光定量PCR 提取苏棉12的根、叶片、花药、柱头和0、5、7、14、21、26 和28 DPA(days post anthesis)纤维的总RNA,并反转录成cDNA。以q-sad-F/q-sad-R为内参基因引物,以q-Ghuhrf1-F/q-Ghuhrf1-R为目标基因引物,进行荧光定量PCR分析,具体操作步骤参照ABI7500荧光定量PCR操作手册。
1.2.3Ghuhrf1基因启动子的克隆 将Ghuhrf1基因序列与中国农业科学院棉花研究所CGP(cotton genome project)数据库中陆地棉TM-1基因组进行同源比对。参照其基因组信息,设计引物(Ghuhrf1P-F和Ghuhrf1P-R)(表1),以14 DPA纤维的基因组DNA为模板,通过PCR技术扩增Ghuhrf1基因5’上游序列。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。将扩增的目的条带与pMD18-T载体连接后转化大肠杆菌,挑选阳性克隆进行测序。
1.2.4Ghuhrf1-Pro缺失体的克隆与植物表达载体构建 根据Ghuhrf1-Pro序列设计引物(表1),在下游和上游引物的5’端分别添加了NcoⅠ和XbaⅠ酶切位点。以Ghuhrf1-Pro质粒为模板,分别以R/F-1417、R/F-1180、R/F-867、R/F-726和R/F-328为引物进行PCR扩增。PCR反应体系(30 μL):2×Phanata Max Buffer 15 μL,dNTP Mix 1 μL,上、下游引物各0.8 μL,Phanata Max Super-Fidelity DNA Polymerase 1 μL,模板 1 μL,ddH2O 10.4 μL。反应条件:95 ℃ 5 min;95 ℃ 30 s,56 ℃或52 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 10 min。获得的PCR产物与pMD18-T载体连接后转化大肠杆菌,挑选阳性克隆并测序鉴定。选择pCamBIA1305.1质粒作为植物表达载体骨架,双酶切构建植物表达载体,并分别命名为pGhuhrf1-Pro、pGhuhrf1-Pro1、pGhuhrf1-Pro2、pGhuhrf1-Pro3和pGhuhrf1-Pro4。
1.2.5农杆菌介导法转化本式烟和拟南芥 利用热击法[17]将植物表达载体转入农杆菌LBA4404,培养在YEB液体培养基(250 mg·L-1链霉素、250 mg·L-1利福平和50 mg·L-1卡那霉素)中。收集菌体并用液体MS基本培养基重悬稀释至OD600为0.4左右。首先,侵染本氏烟草叶片进行瞬时表达实验[18]:在本氏烟植株6~8片真叶期,选取距离顶部最近的嫩叶,用1 mL的微量针管进行叶下表皮注射,最少注射整个叶片的2/3,高湿度黑暗条件下培养16 h,然后正常培养(16 h光照/8 h黑暗)2 d,将叶片取下进行GUS组织化学染色。其次,利用花絮浸染法将植物表达载体转化拟南芥进行稳定表达实验[19]:挑选花期正旺的拟南芥植株,剪掉授完粉和长出角果的部分,将花序浸没在含有0.03% silwet L-77的重悬菌液中,静置5 min后置于23 ℃培养箱中黑暗培养24 h后正常培养(16 h光照/8 h黑暗)。将获得的T0代种子在含有 50 mg·L-1潮霉素的MS固体培养基上筛选阳性转化体。
1.2.6转基因拟南芥PCR检测 提取转基因拟南芥基因组DNA,利用对应的引物进行PCR扩增,反应条件为95 ℃ 5 min;95 ℃ 1 min,56 ℃ 30 s,72 ℃ 90 s,30个循环,72 ℃ 10 min。将PCR产物进行琼脂糖凝胶电泳分析。
1.2.7GUS组织化学染色 参考Jefferson等[20]的方法,将待染色叶片浸入X-gluc溶液中,用parafilm封口膜封口,37 ℃避光放置12 h,镜检前,用FAA固定液浸泡15 min,之后依次用75%乙醇溶液、85%乙醇溶液、95%乙醇溶液和100%乙醇脱色,去除色素,然后进行显微镜观察,白色背景下的蓝色即为GUS表达位点。
2 结果与分析
2.1 Ghuhrf1基因全长cDNA的分析
通过分析棉花根叶混合和纤维两个转录组测序数据,获得开花当天差异表达的EST序列并设计引物,通过5’RACE和3’RACE方法分别扩增出503 bp和586 bp的条带。与EST序列进行拼接后,获得基因全长cDNA为2 278 bp,其中5’UTR长226 bp,3’UTR为201 bp,CDS长度为 1 851 bp,编码616个氨基酸,分子量为68.3kD,等电点为6.60。Blastn比对结果表明,获得的Ghuhrf1基因与已知的uhrf1基因同源性较高,与亚洲棉和可可中的uhrf1基因的核苷酸序列相似性分别为99%和88%。通过NCBI在线网站中的CDD对推测蛋白进行保守结构域预测,发现位于16~61、133~171和461~523 aa之间存在RING结构域,编码产物为E3 泛素连接酶,其主要是充当“桥接因子”,将复合体蛋白-E2与泛素底物连接来促进泛素转移,从而影响植物体中蛋白质的丰度和蛋白质的活性。
蛋白同源性分析结果表明,推导的蛋白与E3泛素蛋白连接酶蛋白家族中的UHRF1蛋白具有很高的相似性,与亚洲棉中的UHRF1蛋白同源性最高,亲缘关系最近,相似性可达98%;其次为可可和榴莲,相似性为87%;与其他已知的UHRF1蛋白的相似性也都在70%以上,如与黄麻、柚子、木薯和蓖麻(图1)。由此推测克隆到的基因为E3泛素蛋白连接酶UHRF1家族,将其命名为Ghuhrf1.

图1 GhUHRF1蛋白的同源进化树
2.2 Ghuhrf1的组织表达特异性分析
从图2可以看出,Ghuhrf1基因在开花当天的胚珠中表达量最高,是根、叶和柱头表达量的4倍左右,而在纤维其他发育时期中只有微量的表达。因此,推测Ghuhrf1基因直接参与棉纤维的合成或间接的调控棉纤维原始细胞的分化起始。

注:*和**分别表示差异与根中相比在P<0.05和P<0.01水平具有统计学意义。
2.3 Ghuhrf1启动子的克隆及序列分析
将Ghuhrf1基因序列与CGP数据库中的陆地棉TM-1基因组进行比对,发现Ghuhrf1基因序列位于D基因组的第6染色体上。基于陆地棉基因组信息,从苏棉12基因组DNA中扩增得到Ghuhrf1基因5’上游序列。经过测序,去除与基因重叠和5’UTR的序列,共获得1 417 bp的5’上游序列。
利用PlantCARE和PLACE软件在线分析Ghuhrf1启动子序列中的顺式作用元件。发现该序列中除了含有GC-box、CAAT-box、Inr等启动子基本核心元件外,还含有与分生组织表达相关的CAT-box元件和CCGTCC-box元件、与种子特异表达有关的ACGT-motif元件和AACA-motif元件、与花器官特异表达的Skn-1 motif元件、与胚乳特异基因的表达有关AACACOREOSGLUB1元件、与叶特异表达相关的INRNTPSADB元件和AT-1 box元件等(表2)。

表2 Ghuhrf1启动子序列中顺式元件分析
2.4 Ghuhrf1启动子缺失体分析
根据Ghuhrf1启动子序列上顺式作用元件的位置分布情况,对Ghuhrf1启动子进行了不同长度的缺失,利用PCR方法克隆得到了Pro1(-1 180~+226 bp)、Pro2(-867~+226 bp)、Pro3(-726~+226 bp)和Pro4(-328~+226 bp)四个缺失体。相对于Ghuhrf1全长启动子Pro(-1 417~+226 bp)来说,Pro1缺失了与种子特异表达有关的ACGT-motif元件;Pro2缺失了与种子特异表达有关的AACA-motif元件和与叶的特定表达相关的AT-1 box元件;Pro3缺失了与分生组织表达相关的CAT-box和CCGTCC-box元件;Pro4缺失了所有的与分生组织表达和器官组织特异表达相关的调控元件,只含有GC-box、CAAT-box和Inr等启动子核心调控元件(图3)。

图3 Ghuhrf1-Pro缺失体结构
以pCAMBIA1305.1为载体骨架,以Gus基因为报告基因,分别构建了全长启动子Ghuhrf1-Pro和4个启动子缺失体的植物表达载体用于驱动活性分析。
2.5 烟草瞬时结果表达分析
将构建好的植物表达载体转化本氏烟草,3 d后进行组织化学染色(图4)。转经过组织化学染色和脱色后,空载体农杆菌的叶片呈现无色,说明没有背景污染;注射含有35S启动子的pCamBIA1305.1农杆菌的叶片呈现蓝色,说明Gus基因可以进行正确表达;转Ghuhrf1-Pro和4个缺失体的叶片经过组织化学染色和脱色后,呈现蓝色,说明Ghuhrf1-Pro和4个缺失序列都能够启动Gus基因的表达。因此,可以进一步用于分析该启动子中顺式作用元件的主要功能。

图4 不同Ghuhrf1缺失体驱动Gus基因在烟草叶片中的瞬时表达
2.6 不同缺失体驱动活性分析
分别取不同缺失体转基因拟南芥进行GUS组织化学分析(图5)。染色结果表明,含有全长启动子Pro的转基因拟南芥只能在生长分化比较旺盛的部位检测到GUS蛋白活性,例如叶边缘尖部、莲座叶基部和未成熟角果顶端。缺失体Pro1的转基因拟南芥,Gus基因在叶边缘尖部和莲座叶基部中的表达模式与全长启动子基本一致,但是在未成熟角果顶端部位表达量有所降低,说明ACGT-motif元件能增强启动子在种子器官中的活性。缺失体Pro2的转基因拟南芥叶边缘尖部和莲座叶基部中,Gus基因的表达水平与全长启动子相比有所降低,而在未成熟角果顶端部位没有检测到Gus基因的表达,说明ACGT-motif和AACA-motif元件的缺失导致Gus基因不能在种子中表达,因此,充分证明了这两个元件为种子特异表达相关元件。缺失体Pro3的转基因拟南芥叶边缘尖部和莲座叶基部中,Gus基因的表达水平与全长启动子相比明显降低,并且在未成熟角果顶端部位也没有检测到GUS蛋白活性,说明CCGTCC-box元件能增强启动子在分裂分化旺盛部位中的活性。然而,在只含有启动子基本作用元件的缺失体Pro4转基因拟南芥中,Gus基因的表达呈现组成型表达,在整株植物体各个组织中都有表达,但是GUS蛋白的表达量均没有CaMV 35S启动子的高,表明CAT-box元件和CCGTCC-box元件为分生组织特异表达元件。上述分析进一步证明ACGT-motif和AACA-motif元件为种子特异表达相关元件,CAT-box元件和CCGTCC-box元件为分生组织表达相关元件。由于棉花纤维是由单个胚珠外珠被表皮细胞经过特殊化的分化起始、伸长、增厚和脱水成熟过程而最终形成种子表皮纤维,因此,推测全长启动子上的这些元件与种子发育和细胞生长分化时期密切相关,可能是其在棉花纤维细胞原始细胞分化起始过程中所必需的。

图5 不同Ghuhrf1缺失体驱动Gus基因在拟南芥中的稳定表达
3 讨论
棉花纤维是由单个胚珠表皮细胞经过多次分化和发育等一系列复杂的过程而形成的种子纤维,根据棉纤维发育过程中表现的各种不同特征,研究人员将其划分为4个发育阶段:原始纤维细胞的分化起始阶段、纤维细胞伸长阶段、次生壁加厚阶段和脱水成熟阶段。在棉纤维原始细胞分化起始期,胚珠表皮上接近30%的纤维原始细胞进行分化形成纤维细胞,最终形成成熟的纤维[21]。因此,该时期直接决定了棉花成熟纤维的数量。本研究利用差异基因表达谱分析技术筛选到一条纤维原始细胞分化起始期优势表达基因Ghuhrf1,该基因在开花当天(0 DPA)的胚珠中表达量最高,在纤维其他时期中只有微量的表达,然而开花当天正是棉纤维原始细胞分化开始阶段,复杂的调控途径调控着纤维原始细胞分化的起始。许多研究报道具有E3泛素蛋白连接酶基因uhrf1参与调节分生组织中细胞的分裂分化和细胞增殖过程[22-23]。因此,推测Ghuhrf1基因主要参与棉纤维的合成或者参与对棉纤维原始细胞分化起始的调控。
纤维特异启动子能够驱动外源优良基因只在纤维中进行表达,相比于组成型启动子,它能够实现外源基因的定时定点表达,同时还能够避免棉花体内代谢产物的浪费。组织特异性启动子除了具有核心启动子所必需的顺式作用元件(CAAT-box,TATA-box等)外,还存在一些调控基因在组织中特异表达的作用元件,如CAT-box元件和CCGTCC-box元件为分生组织特异表达的调控元件[24],RHEs为根毛特异表达的调控元件[25-26],AACA-motif、AT-1 box、ACGT和GATA等顺式作用元件为决定组织特异表达相关转录因子的结合位点[27]等。根据重要调控元件在启动子序列上的位置分布情况,有目的性的从启动子5’端上游序列对启动子进行不同程度的缺失,通过转基因植物中报告基因的表达情况可推断调控元件的主要功能[28-29]。本研究参考陆地棉TM-1基因组信息,克隆了Ghuhrf1基因5’上游序列,该启动子除了含有GC-box、CAAT-box和Inr等核心启动子所必需的顺式作用元件外,还含有一些与器官组织特异表达相关的调控元件,例如,CAT-box元件、CCGTCC-box元件、AT-1 box元件、AACA-motif元件、ACGT-motif元件等。通过比较不同缺失体中Gus基因的表达情况,证明CAT-box元件和CCGTCC-box元件是分生组织表达所必需的调控元件,并且这些调控元件的数量决定着启动子活性的强弱。研究表明,棉纤维的生长发育机制与烟草和拟南芥的根毛及表皮毛的生长发育机制具有相似性[30-33]。然而,在全长启动子Ghuhrf1-Pro和4个缺失体Pro1、Pro2、Pro3的转基因拟南芥的根毛及表皮毛中都没有检测到Gus基因的表达。因此,推测Ghuhrf1基因可能不直接参与棉纤维的合成,而是间接的参与棉纤维原始细胞分化起始的调控。但是,Ghuhrf1基因参与哪些代谢调控和调控哪些基因等一系列重要问题,这些问题的解决方案仍有待进一步证实。
