食品中驴源性成分环介导等温扩增检测方法的建立
2020-03-13柳毅尹斯雅
柳毅,尹斯雅
保定市产品质量监督检验所(保定 071051)
中国的养驴历史有4 000余年[1]。驴肉具有细嫩、美味、营养价值高的特点,并具有很高的保健功能[2],素有“天上龙肉,地下驴肉”之说[3]。2018年,被冠以“中国驴肉火烧之乡”的河北河间,一些家庭作坊和正规企业使用价格便宜的马肉、骡子肉及猪肉冒充价格昂贵的驴肉[4-5]。这些“假驴肉”被批量发往北京、山东等地的驴肉火烧店[4],给驴肉的消费市场带来负面影响。
检测动物源性成分的方法包括传统方法、免疫学方法、分子生物学方法。分子生物学方法是最为成熟的检测方法,如环介导等温扩增(LAMP)技术,它是2000年由日本Notomi等[6]研发出来的一种新的核酸扩增方法。LAMP反应结果可以直接通过肉眼进行观察,所用设备简单、花费少,又能满足快速检测的需要,在肉类掺假成分检测中已广泛应用[7-11]。
线粒体DNA(mtDNA)属于高等动物中唯一的核外遗传物质,通常利用线粒体的基因来鉴定肉类成分[12]。检测驴源性成分的特异性靶基因主要包括:线粒体ATPase 6基因[13]、细胞色素b(Cyt b)基因[14]等。其中,针对线粒体ATPase 6基因的检测比较广泛。
试验旨在开发一项新的检测食品中驴源性成分的环介导等温扩增技术。试验结果可为提高驴肉制品的安全性提供一定技术支持。
1 材料与方法
1.1 材料
1.1.1 试验材料
18种肉制品,包括驴肉、驴骡肉、马肉、猪肉、牛肉、山羊肉、绵羊肉、狗肉、鸭肉、鹅肉、狐狸肉、兔肉、鸽子肉、鸡肉、鱼肉、鼠肉、野兔肉、骆驼肉(购自保定出入境检验检疫局、保定各大超市及农贸市场,所有样品保证质量,防止不同肉制品交叉污染)。
1.1.2 仪器与设备
PCR扩增仪(德国Biometra公司);Nanodrop 2000分光光度计(美国Thermo scientific公司);BINDA 2020D凝胶成像仪(北京宾达英创有限公司);CFX96 Touch实时荧光PCR仪(美国Bio-Rad公司)。
1.1.3 主要试剂
脱氧核糖核苷酸(dNTPs);10×Buffer、MgSO4、100 bp DNA Ladder Marker、Bst DNA聚合酶(Large fragment)、Alu I限制性内切酶(宝生物工程(大连)有限公司);SYBR Green I荧光染料(Invitrogen,USA);LAMP引物、实时荧光定量PCR引物、探针(上海生工生物工程有限公司);组织基因组DNA提取试剂盒(天根生化科技(北京)有限公司)。
1.2 试验方法
1.2.1 动物基因组DNA的制备
按照离心柱型基因组DNA提取试剂盒提取动物基因组DNA。
1.2.2 LAMP的引物设计
选用驴的线粒体ATPase 6基因作为特异性基因。依照Genebank中驴的线粒体ATPase 6基因(GenBank No.X97337.1),使用blast对此序列进行同源性分析,确定其保守序列。通过使用Primer premier 5.0和DNAMAN软件设计LAMP的特异性引物,最终在序列10 940至11 137区域处设计一套LAMP反应的引物(外引物F3和B3,内引物FIP和BIP),具体的引物信息见表1。

表1 驴肉的线粒体ATPase 6基因
1.2.3 LAMP反应特异性检测方法建立
按试剂盒提取法提取供试动物基因组DNA作为模板,初步确定25 μL LAMP预反应体系,其成分包括:内引物FIP和BIP各0.64 μmol/L,外引物F3和B3各0.16 μmol/L,dNTPs混合液1.0 mmol/L,1×Thermopol缓冲液,MgSO416 mmol/L,Bst DNA聚合酶大片段320 U/mL,模板DNA 50 ng/μL。
LAMP反应程序为:将所需试剂依次添加到小离心管中,放入水浴锅中,设置反应温度62 ℃,时间60 min;80 ℃,反应5 min,终止反应。产物进行2.0%琼脂糖凝胶电泳分析。根据是否产生梯度条带判断LAMP扩增反应的发生情况。
1.2.4 LAMP反应条件的优化
在引物特异性强的基础上,优化反应体系及反应条件。分别对Mg2+添加量、dNTPs添加量、内外引物浓度比、Bst DNA聚合酶进行体系优化,对反应温度进行反应条件的优化。进行3次平行优化试验,保证试验条件的稳定性。
1.2.5 模拟混合样品中驴源性成分的检测限
以纯羊肉为原料,按比例掺加驴肉,其中添加的驴肉含量分别为2%,1%,0.5%,0.1%,0.01%和0.001%,对其进行LAMP的检测分析,验证引物体系用于模拟混合样品检测限。通过产物琼脂糖凝胶电泳法、荧光可视法和沉淀可视法比较3种产物检测方法的优越性。
1.2.6 实际样品的检测
利用试验建立的LAMP方法对市售的85份熟驴肉制品进行实际样品的检测,并与行业标准SN/T 3730.4—2013实时荧光PCR法检测所得数据进行对比。
2 结果与分析
2.1 特异性检测结果
将18种动物样品按照试剂盒方法提取DNA后,按照1.2.3体系进行LAMP扩增,进行琼脂糖凝胶电泳,以是否产生梯度条带判断引物特异性。结果如图1所示,试验设计的驴源性引物只对驴肉和驴骡肉进行扩增,且对上述其他16个肉类样品均无扩增。证明试验设计的驴源性引物具有良好特异性。

图1 凝胶电泳特异性分析
2.2 LAMP反应条件的优化结果
2.2.1 Mg2+添加量优化结果
如图2所示,试验选择最适宜的Mg2+添加量4.0 μ L。
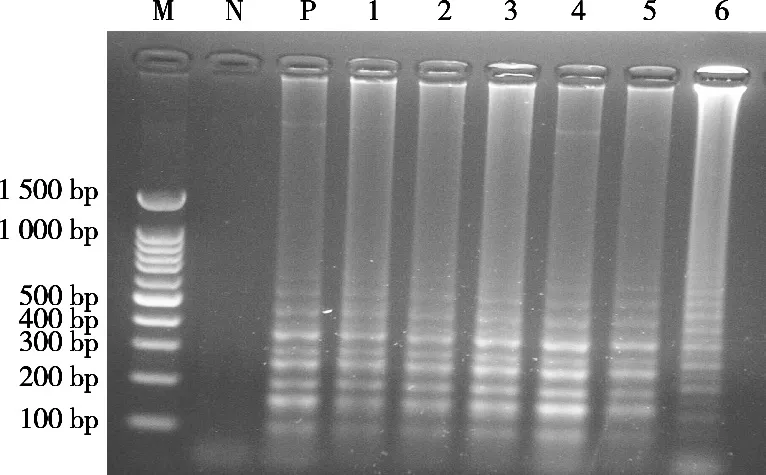
图2 Mg2+添加量的优化
2.2.2 dNTPs添加量的优化
如图3所示,试验选用2.5 μL的dNTPs添加量。

图3 dNTPs添加量的优化
2.2.3 内外引物浓度比的优化
如图4所示,试验选用1∶8引物浓度比。
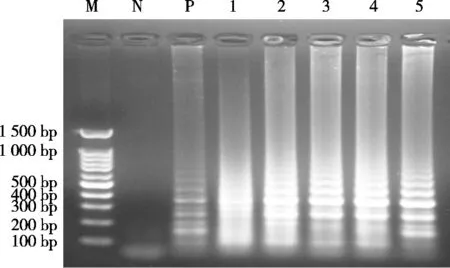
图4 内外引物浓度比的优化
2.2.4 Bst DNA聚合酶缓冲液添加量的优化
由图5可知,当缓冲液添加量为0.5 μL时,扩增条带不清晰;随着添加量增加,特异性扩增条带在2.0 μL时最亮且清晰;继续增加,条带的清晰度变暗。综合考虑,试验采用2.0 μL的缓冲液添加量。
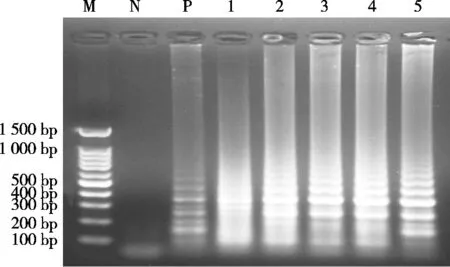
图5 缓冲液浓度的优化
2.2.5 反应温度对LAMP反应扩增效率的影响
如图6所示,试验采用更为稳定的62 ℃作为反应温度。

图6 反应温度的优化
2.2.6 优化后的LAMP反应体系
经过对各条件的优化试验,试验最终确定LAMP检测食品中驴源性成分的反应温度为62 ℃,反应时间60 min,最终25 μL LAMP反应体系包括:内引物FIP和BIP各0.64 μmol/L,外引物F3和B3各0.08 μmol/L,dNTPs混合液0.125 mmol/L,1×Thermopol缓冲液,MgSO416 mmol/L,Bst DNA聚合酶大片段640 U/mL,模板DNA 2 ng/μL。
2.3 模拟混合样品中驴源性成分的检测限
2.3.1 LAMP凝胶电泳法的检测限
将模拟的混合样品提取模板后进行LAMP反应,结果如图7所示。当驴肉含量为2%~0.1%时,均出现阳性扩增;但当驴肉含量为0.01%和0.001%时,没有出现扩增条带。因此,LAMP检测模拟混合样品中驴源性成分的凝胶电泳检测限为0.1%。

图7 凝胶电泳法的检测限
2.3.2 LAMP荧光可视法检测限
将模拟的混合样品提取模板后进行LAMP反应,结果如图8所示。当驴肉含量为2%~0.01%时,显示绿色荧光(图示为无色);但当驴肉含量为0.001%时,荧光显示染料原本的橙色(图示为黑色)不变。因此,LAMP检测模拟混合样品中驴源性成分的荧光可视法检测限为0.01%。
2.3.3 LAMP沉淀可视法检测限
将模拟的混合样品提取模板后进行LAMP反应,结果如图9所示。当驴肉含量为2%~0.1%时,可出现白色沉淀;当驴肉含量为0.01%和0.001%时,产生的微量沉淀不易被肉眼观察到。因此,LAMP检测模拟混合样品中驴源性成分的沉淀可视法检测限为0.1%。

图8 荧光可视法检测限

图9 沉淀可视法检测限
2.4 SN/T 3730.4—2013实时荧光PCR和LAMP方法对实际样品中驴源性成分检测结果的比较
利用已建立的LAMP方法和SN/T 3730.4—2013实时荧光PCR的2种方法对实际购买的85份样品进行检测。经检测,SN/T 3730.4—2013实时荧光PCR法检出的驴肉掺假数为4个,分别来自各小摊贩的驴肉火烧和驴肉焖子。LAMP方法检出的驴肉掺假数为5个,分别来自各小摊贩的驴肉火烧和驴肉焖子。
试验根据敏感性(Sensitivity)、特异性(Specificity)及符合率(Coincidence rate)3个指标对LAMP方法进行方法学评价。这3个指标计算公式如式(1)~(3)所示。

根据检测结果,以SN/T 3730.4—2013检测为标准,则85份样品中以检出的驴肉掺假数表示为真阳性数,即为4;相反没有掺假的样品数表示为真阴性数,即为81。LAMP方法检出的驴肉掺假真阳性数为4,没有掺假的真阴性数为80,假阳性数为1,假阴性数为0。
LAMP方法的敏感性=3/(3+0)=100%;LAMP方法的特异性=80/(80+1)=98.77%;LAMP方法的符合率=(4+80)/85=98.82%。
由此可获得LAMP方法在试验中的敏感性、特异性和符合率,结果汇总见表2。

表2 LAMP方法评价
3 结论
特异性引物设计是LAMP检测方法建立的关键。比较筛选出检测驴的线粒体的特异性基因,即ATPase 6基因,并针对此基因设计特异性引物。结果显示,只有含驴源性成分的肉样呈阳性,其他不含驴源性成分的样品呈阴性,表明试验所使用的引物特异性良好。
通过LAMP方法和SN/T 3730.4—2013实时荧光PCR方法对模拟混合样品中的驴源性成分进行检测,LAMP凝胶电泳法的检测限为0.1%,沉淀可视法检测限为0.1%,荧光可视法检测限为0.01%。对85份实际样品进行检测,以SN/T 3730.4—2013实时荧光PCR方法为标准对LAMP方法进行评价。最终确定LAMP方法的敏感性为100%,特异性为98.77%,符合率为98.82%。
试验建立利用LAMP检测食品中驴源性成分的方法。方法可以准确、快速、灵敏地检测出食品中驴源DNA,对驴制品掺伪检测提供技术支撑和依据,并可作为市售食品中驴源性成分检测的有效手段。
