酵母双杂交筛选与胞内劳森菌LI0902互作宿主蛋白
2020-03-13张兰桥赖崇德戴益民张庆华钟其旺赖芬菊江西农业大学生物科学与工程学院江西南昌330045江西农业大学动物科学技术学院江西南昌330045
张兰桥,赖崇德,戴益民,张庆华,钟其旺,赖芬菊∗ (.江西农业大学 生物科学与工程学院,江西 南昌330045;.江西农业大学 动物科学技术学院,江西 南昌330045)
猪增生性肠炎(procine proliferative enteropathy,PPE),又名猪回肠炎,是由胞内劳森菌(Lawsonia intracellularis,LI)引起的,以回肠、盲肠、结肠黏膜呈腺瘤样增生为主要特征的一种常见接触性肠道传染病[1]。PPE 引起的发病猪死亡率较低,但可以导致猪群生长缓慢、出栏时间延长、饲料回报率严重下降,出栏时胴体均匀度差;再加之生长猪的感染率高、隐性感染病例的比例高,易被忽视,给养猪业造成巨大的经济损失[1-2]。
胞内劳森菌由1993年劳森等[3]应用肠源细胞分离得到而命名。该菌是一种专性胞内寄生、微量厌氧、具3层外膜的革兰阴性弯曲杆菌。该菌大量定植在未成熟的肠上皮细胞上,引起肠上皮细胞的不断增生和炎症的发生,导致肠道对饲料的消化和营养物质的吸收能力下降,造成饲料利用率降低和感染动物体质量下降[1]。
目前,世界上成功分离得到17株胞内劳森菌,NCBI上传有PHE/MN1-00、N343、E40504 3 株菌株序列,全序列包括1个单基因组及3个质粒,总长约1.72×106bp,预计编码1 340个蛋白[1,4]。胞内劳森菌在细胞传代过程中毒性减弱,在细胞中低代数(4~20代)的胞内劳森菌纯培养物感染试验动物,可以复制出临床或亚临床症状,但胞内劳森菌在细胞中培养超过40代后,接种动物将不再致病[1,5]。据此,德国勃林格殷格翰动物保健有限公司研究开发了目前全球唯一的恩格瑞®猪回肠炎活疫苗(Enterisol®I letieis)。口服该疫苗可以减轻猪的临床症状和增加体质量,但不能对重复感染提供保护[6]。传代减毒的胞内劳森菌在DNA 水平上与最初分离出的细菌无差异,在RNA 水平上差异较大[5]。
WATSON 课题组[7]用液相色谱-电喷雾质谱/质谱分析发现,用胞内劳森菌重度感染上皮细胞,其培养物中鉴定出含有LI0902 在内的19 个蛋白。VANNUCCI课题组[8]用激光显微切割结合RNA测序方法,也发现LI0902在胞内劳森菌感染的上皮细胞细胞质中高表达。Interproscan 显示,LI0902基因N 端含有1个血管性血友病因子(v Wf)A 型结构域,该结构域多涉及蛋白与蛋白相互作用;LI0902基因C端含有与大肠杆菌同源的Omp A 结构域和许多革兰阴性菌含有的鞭毛马达蛋白Mot B 结构域[7]。这些结构域含有保守的配体结合位点,可调节葡聚糖识别,预示LI0902可能在胞内劳森菌黏附和侵袭过程中起重要作要。重组表达的LI0902可被感染PPE 的猪血清识别,而不被未感染PPE 的猪血清识别,也证明了这一点[7]。刘磊[9]用生物学软件分析LI0902具有抗原性,并成功在大肠杆菌中表达出LI0902。
本研究利用恩格瑞®猪回肠炎活疫苗冻干粉提取DNA 作为模板,构建了胞内劳森菌LI0902基因的诱饵表达载体p GBKT7-LI0902,并在本实验室已构好的猪肠上皮细胞IPEC-1 cDNA 文库中筛选到3个与LI0902互作的蛋白[10]。本试验不仅有助于研究外膜蛋白LI0902与猪肠上皮细胞相互作用的功能、还可为增生性肠炎致病机理提供线索,最终为疾病的进一步诊断、预后和治疗提供重要的理论依据。
1 材料与方法
1.1 材料猪回肠炎疫苗购自勃林格殷格翰动物保健(美国)有限公司,IPEC-1酵母双杂交文库由本实验室构建,质粒p GADT7、p GADT7-T、p GBKT7、pGBKT7-Lam、p GBKT7-53、酵 母 菌 株Y187、Y2H Gold均购自Clontech 公司。DH5α感受态细胞购自北京全式金生物有限公司。
1.2 试剂常规DNA 提取试剂购自上海鼎国生物技术有限公司,PrimeSTAR®HS DNA 聚合酶、d NTP、TaqTM酶、限制性内切酶NdeⅠ、Bam HⅠ、T4DNA 连接酶、DL5000、DL10000 DNA Marker、2×蛋白上样缓冲液均购自TaKaRa公司;蛋白分子量标准购自Genview 公司;质粒DNA 小提试剂盒、胶回收试剂盒均购自北京全式金生物技术有限公司;MatchmakerTMGold 酵母双杂交系统购自Clontech公司。c-Myc标签小鼠单克隆抗体、山羊抗小鼠IgG HRP 均购自Sigma 公司;化学发光(ECL)试剂盒购自美国Amersham 公司。
1.3 猪回肠炎疫苗DNA 提取称取0.5 g猪回肠炎疫苗干粉,重悬于700μL组织裂解液(0.05 mol/L Tris-HCl,0.1 mol/L EDTA,1% SDS,0.1 mol/L NaCl)中混匀。加入25μL蛋白酶K 使终质量浓度达到100 mg/L混匀,56℃水浴2~4 h;分别用等体积的苯酚∶氯仿∶异戊醇(25∶24∶1)、氯仿∶异戊醇(24∶1)各抽提1 次(缓慢反复颠倒10 min),12 000 r/min 离心收集水相,加入1/10 倍体积3 mol/L 乙酸钠(p H 5.2)与2倍体积-20℃预冷无水乙醇,-20℃放置20 min。12 000 r/min室温离心5 min,弃上清,70% 乙醇(现配)洗涤后溶于适量dd H2O 中,-20℃保存。
1.4 构建pGBKT7-LI0902诱饵表达载体以猪回肠炎疫苗DNA 作为PCR 模板,设计胞内劳森菌LI0902基因的PCR 扩增引物(表1),用Prime-Star®HS DNA 聚合酶进行PCR 扩增,经1%琼脂糖凝胶检测、回收,用NdeⅠ和Bam HⅠ对LI0902扩增产物和p GBKT7质粒分别进行双酶切并回收,用T4连接酶连接并转化DH5α感受态细胞。用扩增引物对所得到的转化子进行菌落PCR,1%琼脂糖凝胶检测,并将阳性转化子送上海生工进行测序。

表1 构建胞内劳森菌LI0902诱饵载体的引物序列
1.5 酵母细胞的转化接种新鲜Y2H Gold酵母单菌落到3 mL YPD培养基中,30℃过夜培养。用新鲜培养基将培养液稀释至5×106细胞/m L(D600≈0.5),摇床培养3~4 h;当D600≈2.0时,5 000 r/min离心2 min 收集细胞,无菌dd H2O 重悬,离心同上;然后分装到1.5 m L EP 管中,取108个细胞进行1个转化,离心弃上清后加入200μL 0.1 mol/L 的醋酸锂重悬细胞,30℃水浴15 min;5 000 r/min 离心2 min,弃上清,加入110μL 转化混合物(36μL 1.0 mol/L LiAc;24μL 10×TE,p H 7.5;5μL 10 g/L ssDNA;适量的质粒DNA)重悬细胞沉淀;加入240μL 50% PEG3350 涡 旋 混 匀 后,30℃温 浴30 min;加入40μL DMSO,简单混匀后42℃热激20 min。12 000 r/min 离心30 s,移去上清,加入100~200μL无菌dd H2O 重悬细胞,涂布SD/-Trp固体平板培养基,放至30℃培养箱培养3~5 d,挑取转化子。
1.6 p GBKT7-LI0902诱饵载体的表达鉴定接种含有pGBKT7-LI0902的酵母转化子至3 m L SD/-Trp液体培养基中,30℃过夜培养,收集细胞,扩培至10 m L 液体培养基,收菌;用0.2 mol/L NaOH进行酵母细胞的总蛋白抽提,加入等体积的2×上样缓冲液,充分混合,沸水浴10 min,经10%SDSPAGE电泳并湿式转印,用5%脱脂奶粉室温封闭1 h,c-Myc 标签小鼠单克隆抗体(1∶5 000稀释)4℃过夜孵育,羊抗鼠二抗IgG-HRP(1∶5 000稀释)室温孵育1 h,加ECL发光液进行曝光,保存结果。
1.7 诱饵蛋白自激活及毒性检测将p GBKT7-LI0902和p GADT7、p GADT7-T 和p GBKT7-P53,p GADT7-T 和p GBKT7-Lam 分别共转化至Y2H Gold中,分别涂布在SD/-Leu/-Trp固体平板培养基上,30℃倒置培养3~4 d。随机挑取转化子,在SD/-leu/-Trp 和SD/-Leu/-Trp/-His 固 体 培 养 基上进行划线培养。
将诱饵质粒p GBKT7-LI0902和p GBKT7分别转化至酵母菌株Y2 H Gold中,在SD/-Trp固体培养基上观察生长情况及数量;再分别接种于SD/-Trp液体培养基中,于30℃230 r/min条件下培养24 h,测定菌液的D600吸光值。
1.8 酵母双杂交的筛选与鉴定酵母双杂交筛选工作根据MatchmakerTMGold 酵母双杂交系统要求和文献进行[10]。将含有p GBKT7-LI0902 的Y2H Gold酵母单菌落接种至3 m L SD/-Trp液体培养基,30℃230 r/min摇床培养24 h后,扩培至50 m L,继续培养至D600=0.8时,离心收集细胞,用5 m L SD/-Trp 液体培养基进行重悬,再分别与1 m L 文库混合,同时加入45 m L 2×YPDA 液体培养基(含有卡那霉素)到2 L 的锥形瓶内,于30℃摇床低速培养20 h以上,在显微镜下观察细胞形态。当大部分细胞呈现三叶草型或米老鼠头像时,离心弃上清,用YPDA 液体培养基重悬菌体,离心弃上清,用10 m L 0.5×YPDA 液体培养基重悬并涂布于SD/-Leu/-Trp/-His固体培养基上,于30℃培养箱倒置培养3~8 d进行初筛。将初筛获得的阳性菌落重新涂布至SD/-Ade/-Leu/-Trp/-His进行复验,并对后续通过重复验证的阳性菌落进行菌落PCR,将PCR 产物送上海生物工程有限公司进行测序,对测序结果进行数据库比对分析。
2 结果
2.1 胞内劳森菌疫苗DNA 提取取1μL 提好的胞内劳森菌疫苗DNA,用0.8%琼脂糖凝胶电泳40 min,置凝胶成像系统中观察。从图1可以看出,提取的DNA 为超过10 000 bp 的均一条带,无降解,质量较好。
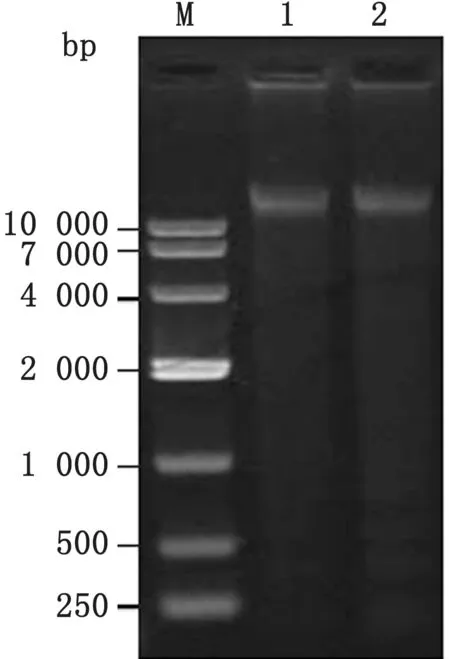
图1 胞内劳森菌疫苗冻干粉DNA 琼脂糖凝胶电泳 M.DL10000 DNA Marker;1~2.胞内劳森菌疫苗冻干粉DNA
2.2 诱饵载体pGBKT7-LI0902的鉴定用扩增引物对已构建好的重组质粒pGBKT7-LI0902进行菌落PCR 检测,可扩增出1 203 bp的片段(图2),经测序,序列与上传至NCBI中的胞内劳森菌菌株PHE/MN1-00的LI0902序列一致,说明成功构建出p GBKT7-LI0902诱饵载体。
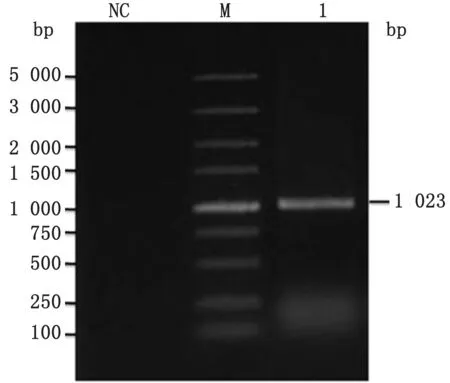
图2 p GBKT7-LI0902表达载体的PCR 鉴定 M.DL5000 DNA Marker;NC.阴性对照;1.pGBKT7-LI0902
2.3 诱饵载体pGBKT7-LI0902 的表达鉴定将p GBKT7-LI0902转化至Y2H Gold中,挑取转化子进行培养、总蛋白提取,并用c-Myc标签小鼠单克隆抗体作为一抗、山羊抗小鼠IgG HRP 作为二抗,进行蛋白的Western blot分析。结果在约37 000处有1条特异性条带,表明LI0902能正确表达,可满足后续试验的需要(图3)。
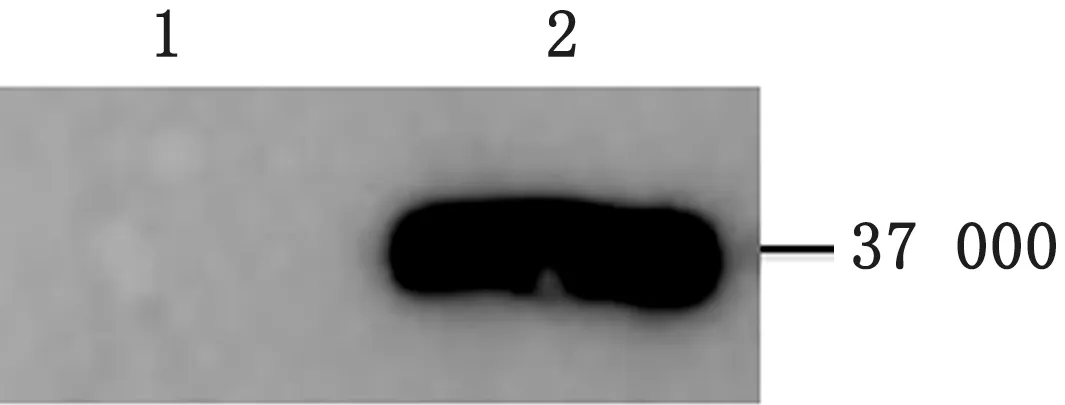
图3 Western blot鉴定LI0902在酵母细胞中的表达 1.空质粒;2.pGBKT7-LI0902
2.4 诱饵载体pGBKT7-LI0902的自激活及毒性分析p GBKT7-LI0902 和pGADT7、p GADT7-T 和p GBKT7-53,p GBKT7-Lam 和p GADT7-T 菌 落 均能在SD/-Leu/-Trp固体培养基上生长,而在SD/-Leu/-Trp/-His 固体培养基上只有阳性对照pGADT7-T 和pGBKT7-53 能生长,说明诱饵质粒无自激活(图4)。将酵母菌液培养24 h,检测其D600,结果表明D600值均大于2.0(结果未显示),表明p GBKT7-LI0902诱饵蛋白的表达对酵母细胞无毒性,满足后续试验要求。
2.5 LI0902互作蛋白的筛选及序列分析将初筛得到的阳性菌落涂布至SD/-Ade/-Leu/-Trp/-His进行验证,经30℃倒置培养后,共获得3个阳性克隆。将得到的3个阳性克隆分别提取质粒,再与分别对应的质粒进行转化,菌液涂布于SD/-Leu/-Trp/-His固体平板培养基,进行重复验证,将重复验证成功的克隆子送去测序,测序结果经比对,得到3个与LI0902互作的蛋白质(表2)。
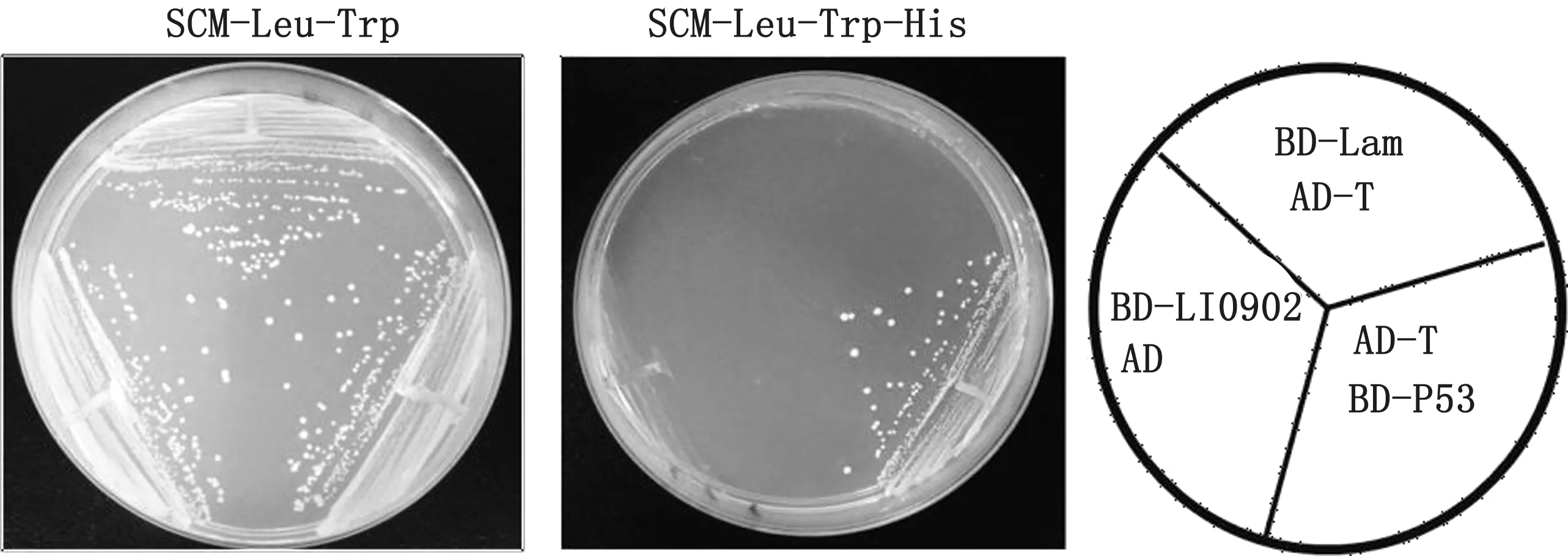
图4 诱饵质粒p GBKT7-LI0902的自激活检测

表2 酵母双杂交系统筛选与胞内劳森菌蛋白LI0902互作的蛋白质
3 讨论
本研究以胞内劳森菌疫苗株DNA 作为模板,成功构建了p GBKT7-LI0902 诱饵表达载体,并以LI0902蛋白为诱饵,在本试验构建的猪肠上皮细胞IPEC-1酵母双杂交文库中,筛选到3 个与LI0902互作的重要蛋白FTL、RPS5和RPS18。
铁蛋白是参与和维持铁代谢平衡的重要蛋白,其多肽链有轻、重链之分。铁蛋白轻链与严格胞内寄生的埃立克体Ⅰ型分泌系统底物TRP32存在相互作用,在细胞中定位一致,干扰铁蛋白轻链降低埃立克体感染细胞效率[11]。胞内劳森菌同为严格胞内寄生,VANNUCCI课题组[8]用激光显微切割结合RNA 测序发现,胞内劳森菌感染猪肠上皮细胞后,宿主铁蛋白轻链基因表达上调。我们的试验结果表明,外膜蛋白LI0902与铁蛋白轻链存在相互作用,这种相互作用是否会影响铁蛋白轻链基因的表达,是否也会促进胞内劳森菌的感染,仍然有待于进一步去研究和验证。
胞内劳森菌感染上皮细胞后,位于感染细胞细胞质顶膜,并与游离核糖体和分散的线粒体相连[1]。RPS5和RPS18均为真核生物核糖体40S小亚基的亚单位,在物种间高度保守,在维持翻译准确性上发挥重要作用。VANNUCCI课题组[8]的试验结果发现,蛋白生物合成网络与胞内劳森菌感染相关程度最高。在胞内劳森菌感染后,核糖体大小亚基及延伸因子中的多个蛋白表达上调。本试验用酵母双杂交方法发现胞内劳森菌外膜蛋白LI0902与RPS5、RPS18具有相互作用,提示我们有必要进一步进行研究该菌与核糖体、蛋白翻译之间的联系,以及这种联系在该菌增殖中的作用。
胞内劳森菌感染后,宿主细胞抗凋亡相关基因大量表达,宿主细胞凋亡进程产生变化[1,8]。RPS5除作为延伸因子外,还有调节细胞分化、DNA 连接蛋白、细胞识别和促进细胞凋亡等多种生物学功能[12]。LI0902也有可能通过与RPS5的相互作用影响宿主的细胞凋亡进程。
