猪呼吸和繁殖障碍类病毒性疫病多重PCR检测方法的建立及应用
2020-03-13石远菊汤德元郭倩妤廖少山杨志刚贵州大学动物科学学院贵州贵阳550025
张 森,石远菊,汤德元,王 彬,郭倩妤,廖少山,杨志刚 (贵州大学 动物科学学院,贵州 贵阳550025)
由于现代养猪业规模化和集约化程度不断提高,猪群发生多种病原混合感染和继发感染的情况也越来越多[1],猪呼吸与繁殖障碍类病毒性疫病混合感染是影响养猪生产实际中较为普遍的问题。常见的猪呼吸与繁殖障碍类病毒性疫病主要有:猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome disease,PRRS),猪圆环病毒病(porcine circovirus disease,PCVD),猪细小病毒病(porcine parvovirus disease,PPVD),猪伪狂犬病(pseudorabies virus disease,PR),猪流感(swine influenza,SI),猪日本乙型脑炎(Japanese encephalitis,JE)和猪瘟(classical swine fever,CSF)[2-6]。其中CSFV、PPV、PRV 和JEV 可导致猪繁殖障碍类疾病,SIV 主要导致呼吸道系统疾病,怀孕的母猪在感染SIV 时可引起繁殖障碍[7-8],而PRRSV 和PCV2不仅可以引起呼吸道疾病,而且还可引起繁殖障碍类疾病。除此之外,这7个病毒均可以不同程度地损害机体的免疫系统,降低机体对外界的抵抗能力,引起继发性混合感染,导致疫病复杂化,病症更加严重[9]。因为这些疾病的临床表现是相似的,常规诊断方法,如病毒分离和血清学诊断方法具有时间长和低灵敏度等缺陷,这不能满足现实的临床诊断需求。自1983年MULLIS等[10]首次建立PCR 技术以来,这种方法发展迅速,目前已成为动物疾病的诊断最有价值的方法,现被广泛应用于分子生物学及其相关的领域,大大提高了疾病的检测水平。多重PCR 检测技术是在普通PCR 技术的基础上发展起来的,多重PCR 可以同时添加多对引物和模板,在1个PCR 反应管中同时扩增出多个目的片段,具有节省时间、人力和物力的优点,可以快速准确地诊断疾病,适用于大量临床样本(特别是混合感染样品)中病原体的快速诊断。针对不同动物病原体所建立的多重PCR 方法正在不断增加,本研究拟建立一种能够同时并同步检测PRRSV、PCV2、PPV、PRV、SIV、JEV 和CSFV 这7种病原体单一和混合感染的多重PCR 检测方法,以期对临床病料进行早期、快速、准确的诊断,为猪病的预防和控制提供科学依据。
1 材料与方法
1.1 病毒、菌株、细胞及病料来源PRV、PCV2、PRRSV、CSFV、PPV、JEV、PEDV、E.coli、APP 系贵州省动物疫病研究室分离鉴定并保存,SIV 由曾智勇教授惠赠;150份病料来源于2017 至2019 年贵州省9个不同地区(安顺、赫章、福泉、长顺、遵义、榕江、凯里、毕节、清镇)疑似呼吸和繁殖障碍症状的发病猪组织病料(肺脏、心脏、肝脏、脾脏、肾脏、淋巴结)及血样。
1.2 主要试剂及仪器相对分子质量标准物DL2000 DNA Marker,Mini BEST Universal Genomic DNA &RNA Extraction Kit Ver.4.0,M-MLV 酶、dNTP、Oligo Primer、RNA酶抑制剂、p MD19-T Vector、大肠杆菌感受态细胞DH5α,均购自大连宝生物工程有限公司;1×T3 Super PCR Mix、金牌Mix(green)购自武汉擎科创新生物科技有限公司;E.Z.N.A.TM Gel Extraction Kit(50)胶回收试剂盒、普通质粒小提试剂盒为OMEGA 公司产品;Icycler Thermal cycle型PCR 仪为BIO-RAD 公司产品。
1.3 引物设计参照NCBI中PRRSV ORF6、SIV M、JEV NS1、CSFV E2、PRV gB、PCV2 ORF2、PPV NS1等基因的基因序列,运用多重PCR 引物设计系统MPprimer和多因素引物特异性评估系统MFEprimer设计多重PCR 引物,用于扩增目的基因片段,引物序列详见表1。

表1 扩增目的片段的引物
1.4 病毒核酸的提取及cDNA 模板的制备分别将接毒后的细胞悬液及相关病毒的阳性病料反复冻融3次后,各取200μL,参照RNA&DNA 提取试剂盒说明书,按步骤提取病毒的核酸(RNA 和DNA),利用NanoDrop 2000 超微量紫外可见分光光度计测定其浓度,制备CSFV、JEV、PRRSV、SIV 的cDNA 模板,RT 反应体系20.0μL:RNA 10.0μL,5×RT M-MLV Buffer 4.0 μL,10.0 μmol/L Oligo primer 2.5μL,10.0 mmol/L d NTP 2.0μL,RNase Inhibitor 0.5μL,M-MLV 1 μL。RT 反 应 条 件:42℃1 h;72℃5 min。细菌DNA 的提取用热煮沸法进行,提取的DNA 及合成的c DNA 模板置于-20℃冰箱保存备用。
1.5 单一PCR扩增体系的优化及鉴定单一病毒的PCR 反 应 体 系 为25.0 μL,金 牌Mix(green)21.0μL,上、下游引物各1.0μL,DNA 或c DNA 模板各2.0μL,PCR 反应条件为95℃5 min;95℃45 s;退火温度(50~60℃)45 s;72℃45 s,共进行35个循环;72℃10 min。选择最佳的退火温度,分别对7个病毒的核酸进行10倍系列稀释,以各个稀释度的核酸为模板进行单重PCR 敏感性试验,取5.0μL PCR 产物于1.5%琼脂糖凝胶上进行电泳测定。将上述7种病毒的PCR 扩增片段胶回收后与p MD19-T 载体于16℃中连接12 h,将连接产物转化至DH5α感受态细胞后均匀涂布于含有Amp抗性的LB培养基中,于37℃培养箱培养约12 h,挑取单个菌落扩大培养,提取质粒进行PCR鉴定,送阳性质粒的菌液至昆泰锐(武汉)生物技术有限公司测序。
1.6 七重PCR 反应条件的优化对七重PCR 反应条件,包括七重PCR 缓冲液及酶的选择:1×T3 Super PCR Mix、金牌Mix(green)、10×LA PCR Buffer、2×GC Buffer、2×1 step Buffer、LA 酶、r Taq酶;对七重PCR 反应体系、退火温度、模板及引物浓度进行优化,确定最佳反应条件。
1.7 七重PCR 特异性、敏感性及重复性试验通过建立的七重PCR 方法分别以PRV、PCV2、PRRSV、CSFV、PPV、SIV、JEV、PEDV、APP、
E.coli及正常组织的DNA/c DNA 模板进行PCR扩增,检测该方法是否具有特异性;用灭菌三蒸水对7个病毒的核酸进行10倍系列稀释,然后取每个稀释度的核酸为模板分别运用七重PCR 方法检测其敏感性;选取7种病毒最佳浓度的DNA/cDNA 混合核酸作为模板以及最佳的反应体系及条件,进行七重PCR 重复性试验。
1.8 七重PCR对临床病料的检测利用已建立的七重PCR 方法对2017-2018年收集于贵州省内的共150份临床病料进行检测,病死猪组织和血液的混合疾病材料重复冷冻和解冻3次,充分研磨,取匀浆液于离心机中12 000 r/min 离心5 min,各取200μL上清,参照DNA&RNA 提取试剂盒说明书上的步骤提取病毒核酸(DNA 和RNA),再反转录成c DNA,用建立的七重PCR 方法进行检测。
2 结果
2.1 单一PCR扩增体系的优化及鉴定对7个病毒的单一PCR 反应条件中的退火温度进行优化,结果显示:退火温度在50~60℃间均可扩增出目的条带(图1),将PRRSV、PCV2、PPV、PRV、SIV、JEV和CSFV 的单一PCR 产物胶回收后连接p MD19-T载体后,转化DH5α细胞,送昆泰锐(武汉)生物技术有限公司测序,测序结果分析表明,扩增片段分别为各自病毒的特异性基因片段。对7 个病毒的单重PCR 体系进行敏感性试验,单重PCR 中各病毒的最佳检测量分别为PRRSV 94 pg、PCV2 66 pg、PPV 68 pg、PRV 24 pg、SIV 35 pg、JEV 17 pg、CSFV 14 pg(图2)。
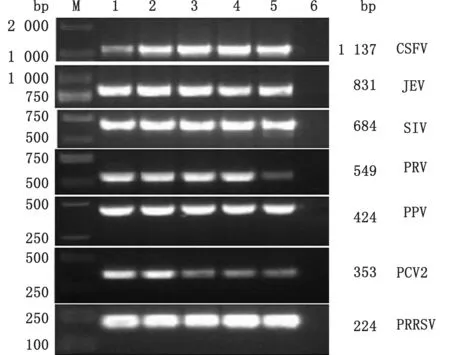
图1 PRRSV、PCV2、PPV、PRV、SIV、JEV 和CSFV 单 一PCR 退火温度的优化 M.DL2000 DNA Marker;1.60℃;2.58℃;3.56℃;4.54℃;5.52℃;6.阴性对照
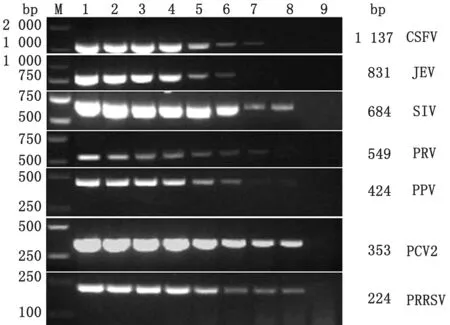
图2 PRRSV、PCV2、PPV、PRV、SIV、JEV 和CSFV 单 一PCR 敏感性试验 M.DL2000 DNA Marker;1.10-1;2.10-2;3.10-3;4.10-4;5.10-5;6.10-6;7.10-7;8.10-8;9.阴性对照
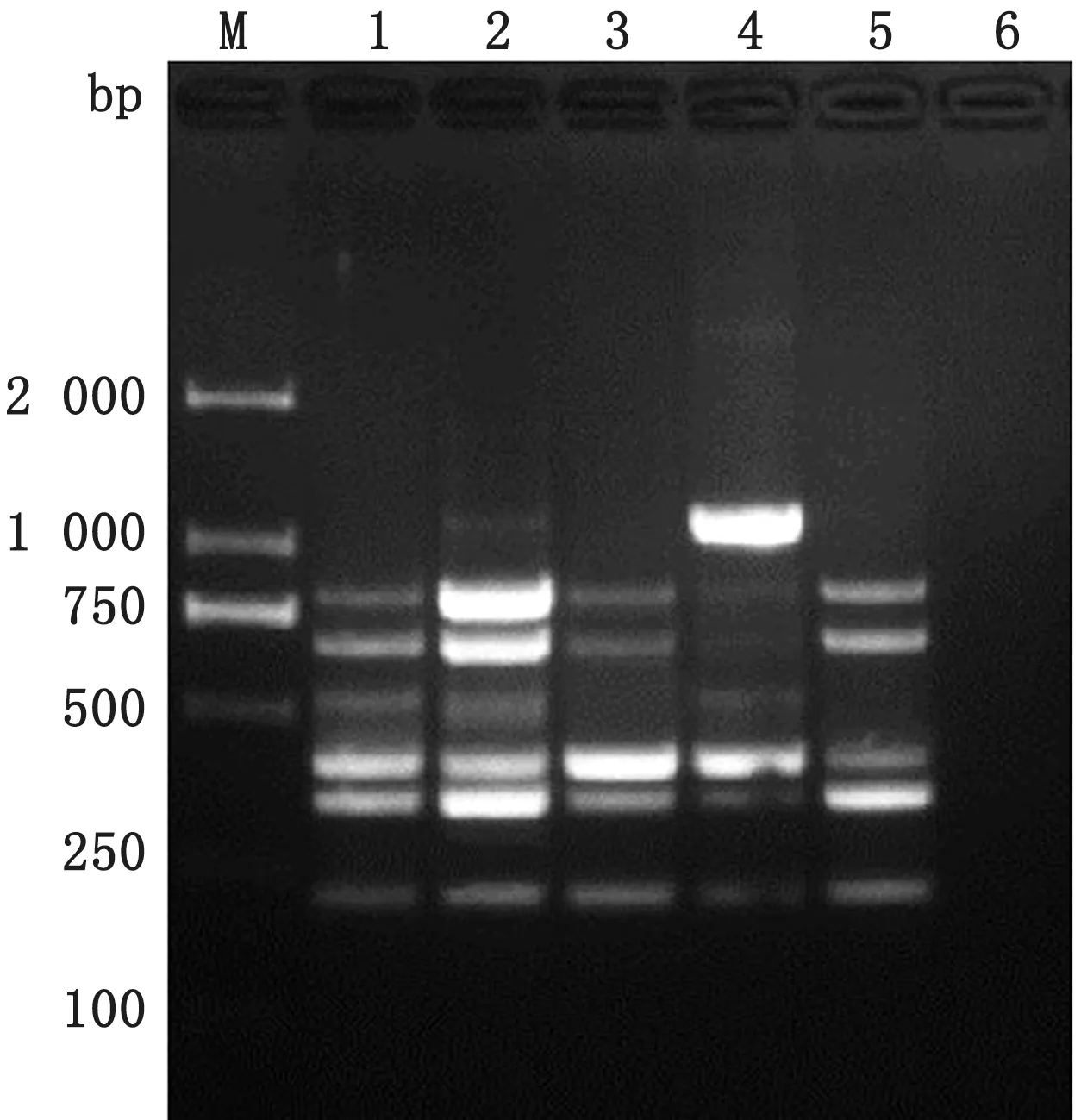
图3 多重PCR 缓冲液(Buffer)及酶的选择 M.DL2000 DNA Marker;1.1×T3 Super PCR Mix;2.金牌Mix(green);3.10×LA PCR Buffer;4.2×GC Buffer;5.2×1 step Buffer;6.阴性对照
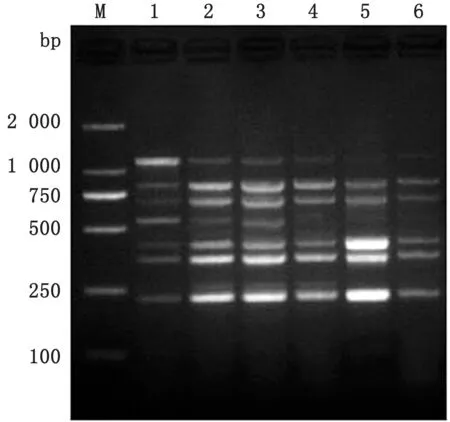
图4 PRRSV、PCV2、PPV、PRV、SIV、JEV 和CSFV 七 重PCR 退火温度的优化 M.DL2000 DNA Marker;1.50℃;2.52℃;3.54℃;4.56℃;5.58℃;6.60℃
2.2 七重PCR反应条件的优化金牌Mix(green)和2×GC Buffer及r Taq酶均可同时扩增出7种病毒的特异性条带(图3);选取金牌Mix(green)进行多重PCR 体系及条件的优化,七重PCR 最佳反应体系为50μL:金牌Mix(green)30μL,上、下游引物浓度 均 为10 μmo L/L,引 物 量PRRSV、PCV2、PPV、SIV 各0.5μL,PRV、JEV、CSFV 各1.0μL,DNA/cDNA 模 板PRRSV、PCV2、PPV、SIV、JEV各1.0μL,PRV、CSFV 各1.5μL,退火温度为54℃时,七重PCR 电泳效果最好(图4),最佳反应条件为:95℃5 min;94℃45 s;54℃45 s;72℃45 s,共进行35个循环;72℃延伸10 min。2.3 七重PCR 特异性、敏感性及重复性试验用已确定的七重PCR 反应条件及体系进行特异性试验,结果表明:PEDV、APP、E.coli、正常组织模板均未扩增出条带,而PRRSV、PCV2、PPV、PRV、SIV、JEV 和CSFV 模板均扩增出与目的片段大小相符的特异性条带(图5);对PRRSV、PCV2、PPV、PRV、SIV、JEV 和CSFV 这7个病毒的核酸进行10倍梯度稀释,在建立的七重PCR 检测方法反应条件下进行扩增,敏感性结果显示:各种病毒的最低检测量分别为PRRSV 94 pg、PCV2 66 pg、PPV 68 pg、PRV 20 pg、SIV 35 pg、JEV17 pg、CSFV 14 pg(图6);重复性试验结果表明:6 次重复试验均能扩增出均匀一致的目的条带,具有良好的重复性(图7)。
2.4 七重PCR 对临床病料的检测150份病料检测结果显示(表2):PCV2与其他猪呼吸和繁殖障碍类病毒混合感染的情况较为严重,尤其与PRRSV混合感染的阳性率较高,150份临床病料中二重混合感染阳性率高达66.00%(99/150);三重混合感染阳性率达11.33%(17/150);四重混合感染阳性率达2.00%(3/150);五重感染阳性率达0.67%(1/150);六重感染阳性率为0,七重感染阳性率为0,部分临床病料检测结果见图8。
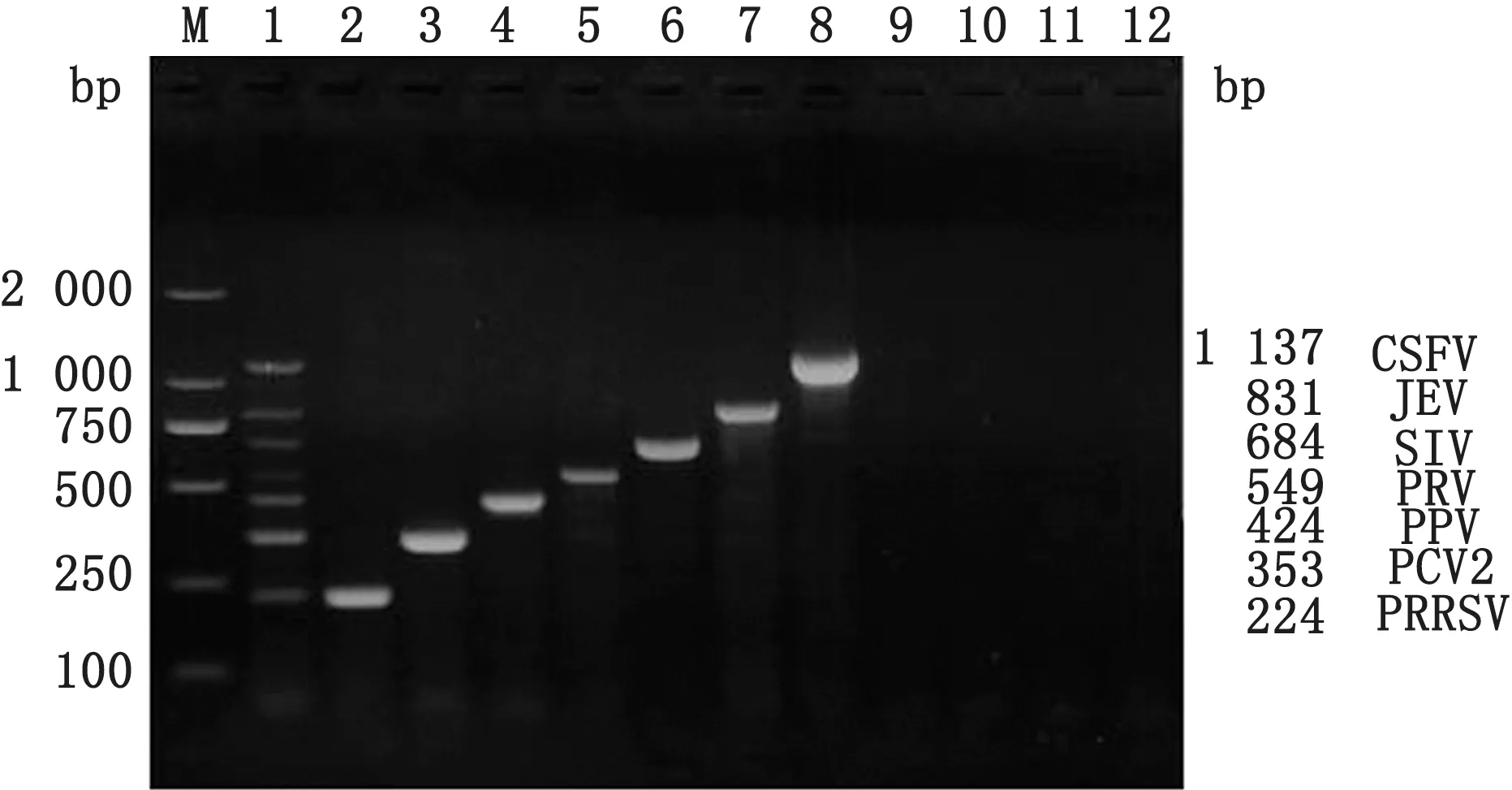
图5 RRSV、PCV2、PPV、PRV、SIV、JEV 和CSFV 七重PCR 的 特 异 性 试 验 M.DL2000 DNA Marker;1.PRRSV、PCV2、PPV、PRV、SIV、JEV 和CSFV PCR产物;2~12.PRRSV、PCV2、PPV、PRV、SIV、JEV、CSFV、PEDV、APP、正常组织、E.coli PCR 产物
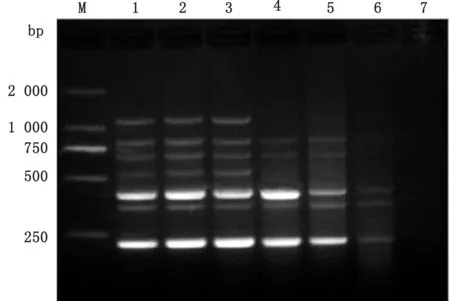
图6 PRRSV、PCV2、PPV、PRV、SIV、JEV 和CSFV 七 重PCR 的 敏 感 性 试 验 M.DL2000 DNA Marker;1.10-1;2.10-2;3.10-3;4.10-4;5.10-5;6.10-6;7.阴 性对照
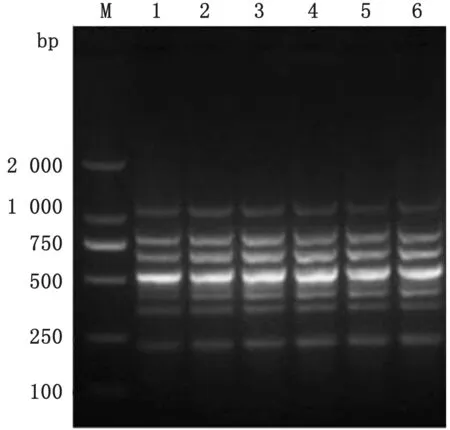
图7 七重PCR 重复性试验 M.DL2000 DNA Marker;1~6.相同条件下的6次重复试验
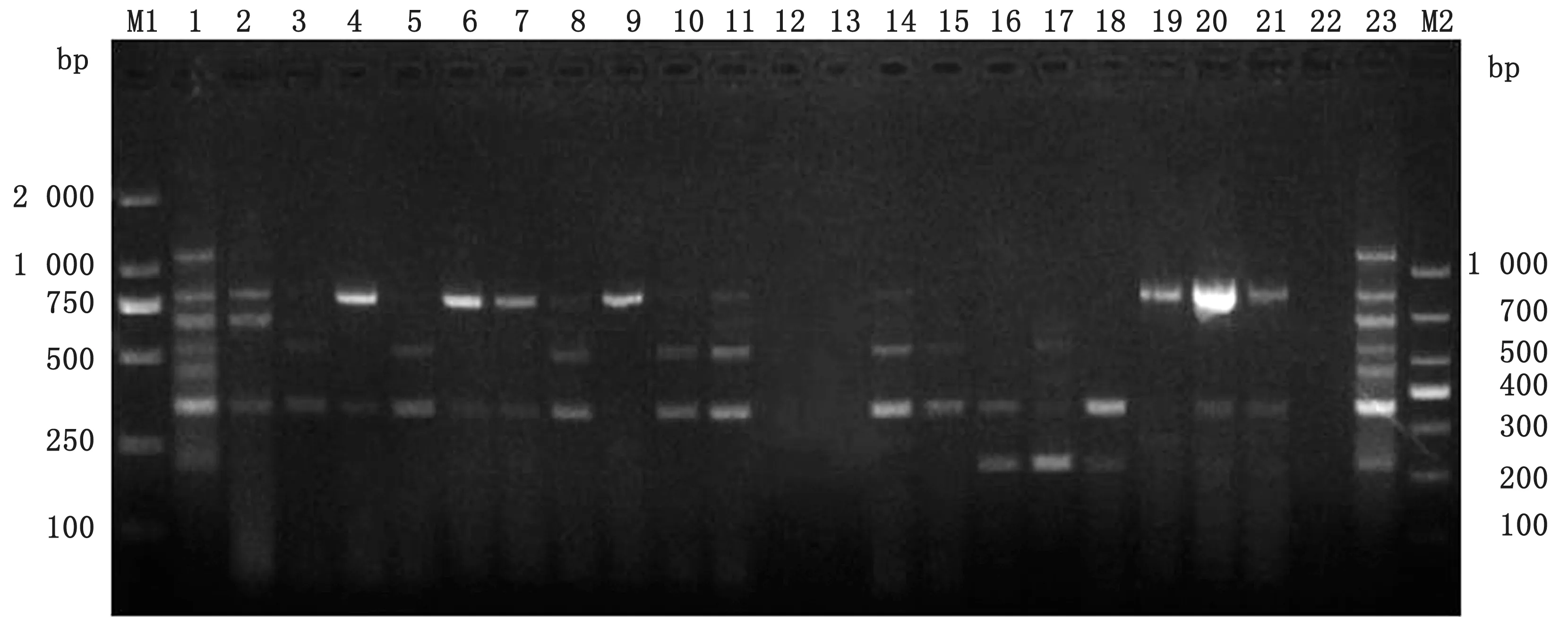
图8 多重PCR 对贵州9个不同地区的部分临床病料的检测 M1.DL2000 DNA Marker;M2.DL1000 DNA Marker;2~21.部分临床病料;22.阴性对照;1,23.阳性对照
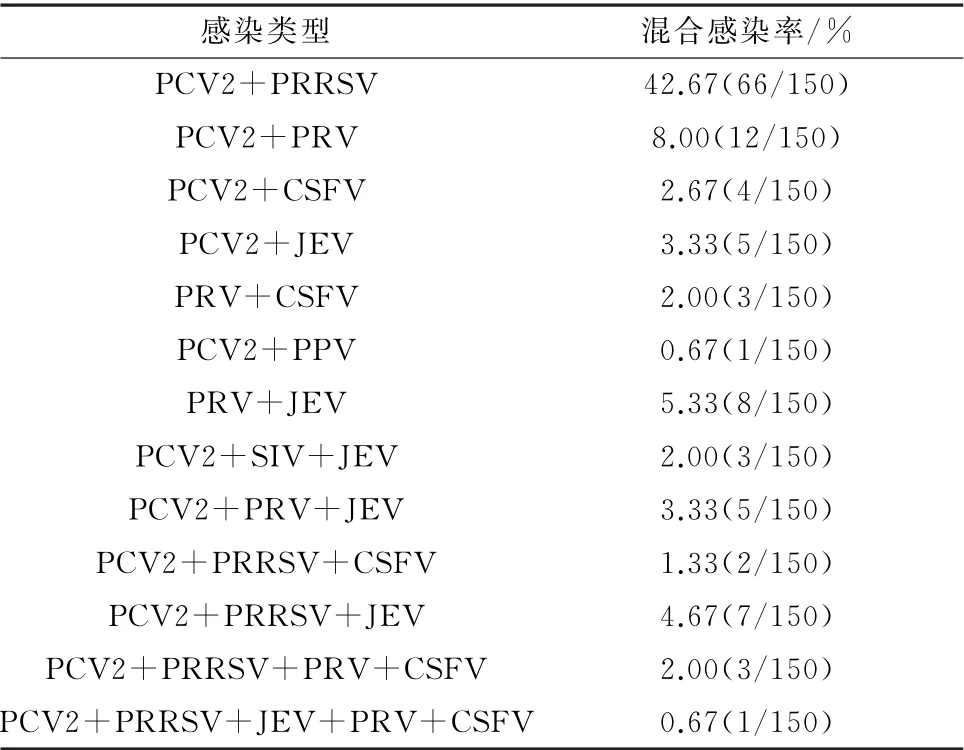
表2 贵州省部分地区2017-2019年150份临床病料混合感染情况
3 讨论
猪伪狂犬病毒(PRV),猪圆环病毒(PCV2),猪繁殖与呼吸综合征病毒(PRRSV),猪瘟病毒(CSFV),猪细小病毒(PPV),猪流感病毒(SIV),猪日本乙型脑炎病毒(JEV)是猪病毒性呼吸道疾病和生殖障碍的常见病原体,这些猪呼吸道和生殖障碍类疫病广泛存在于猪群中,给养猪业造成显著的经济损失。近年来,猪传染性疾病多以病原的多重感染或混合感染为主要流行形式,夏道伦[11]发现70.00%以上的病猪以病毒病为主并且80.00%以上的病猪均是由2种或2种以上的病原体混合感染,导致病猪临床症状表现复杂化。这些病毒在感染后通常具有相似的临床症状和病理变化,这很难直观地诊断。多重PCR 方法可以在同一反应系统中同时检测多种病毒,并可以快速准确地进行临床疾病诊断,具有很大的应用前景。相对于常规PCR,多重PCR 方法的建立是复杂和困难的,引物设计和条件优化是建立多重PCR 方法的重要关键步骤,多重PCR 包含多对引物,本研究中PRRSV、PCV2、PPV、PRV、SIV、JEV、CSFV 各引物扩增目的片段大小分别为:224,353,474,549,684,831,1 137 bp,本研究中各扩增片段长度都相差在70 bp以上,靶片段具有足够的大小差异可以提高琼脂糖凝胶电泳上的分辨率。在该研究中,每个引物对的GC 含量和退火温度Tm 值是相似的,这确保了靶片段可以在相同的退火温度下有效地扩增;通过增加扩增效率低的基因引物量和减少扩增效率高的基因引物量的方法来优化引物的量;再通过增加大片段的模板,减少小片段的模板量来优化模板浓度;用随机引物扩增RNA病毒,使其逆转录成cDNA,PCR 反应溶液使用金牌Mix(green)混合液,减少了繁琐的加样步骤和污染的可能性,进一步确保了多重PCR 的及时性和准确性;同时,通过6 次重复试验验证了建立的多重PCR 方法,结果一致。本研究在优化和建立单一病毒PCR 检测方法的基础上,优化了酶的反应条件,退火温度,引物和模板浓度,确定了最佳的多重PCR 反应条件,通过特异性、敏感性、重复性的测定,建立了能同时检测DNA 和RNA 病毒的七重PCR 方法,该方法具有特异性强、敏感性高,容易操作等特点,完全可以满足临床检测的要求,适用于猪群疫病流行病学调查和多种病原混合感染的快速诊断。
通过对2017-2019年采集的150份临床病料进行检测,比较多重PCR 与单一PCR 的检测情况,结果表明,阳性PRRSV、PCV2、PPV、JEV、SIV 的符合率均为100.00%,阳性CSFV 和PRV 的多重PCR 和单一PCR 检测结果符合率为90.00%以上,多重PCR 未检测出CSFV 或PRV 的部分病料,再通过单一PCR 复检可以检测出来,这可能与多重PCR 敏感度有一定的关系,单一PCR 技术比多重PCR技术敏感,与王隆柏等[12]报道的基本一致。顾文源等[13]研究结果表明,在河北省表现繁殖障碍疫病的猪群中,PRRSV 和CSFV 的感染较为普遍。
而在本研究中:PCV2与其他猪呼吸和繁殖障碍类病毒混合感染的情况较为严重,尤其与PRRSV混合感染的阳性率较高,研究结果表明PCV2 和PRRSV 将是贵州省未来猪病监测及防治的重点。
