3种猪冠状病毒抗体可视化检测芯片的研制与初步应用
2020-03-13武鑫宇石俊超胡诗雨刘晓东贺文琦吉林大学动物医学学院吉林长春3006青岛易邦生物工程有限公司动物基因工程疫苗国家重点实验室山东青岛6644
武鑫宇,李 姿,石俊超,胡诗雨,刘 蕾,刘晓东,赵 魁,高 丰,贺文琦∗ (.吉林大学 动物医学学院,吉林 长春3006;.青岛易邦生物工程有限公司 动物基因工程疫苗国家重点实验室,山东 青岛6644)
在养猪业,冠状病毒感染对其发展构成严重威胁,其中猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)、猪传染性胃肠炎病毒(porcine transmissible gastroenteritis virus,TGEV)、猪血凝性脑脊髓炎病毒(porcine hemagglutinating encephalomyelitis virus,PHEV)均能感染仔猪,引起呕吐、腹泻、脱水等症状,且死亡率较高[1-3]。因此在传统类症鉴别诊断中,人们常常将上述3种疫病混淆、误诊。为满足基层临床对疾病快速鉴别诊断的需求,方便、快捷、直观的可视化芯片技术则优势凸显,为猪冠状病毒病检测方法革新带来了新的契机。
可视化芯片技术是在传统生物芯片基础上,结合可视化显色技术而发展的一种技术类型,分为可视化蛋白芯片和基因芯片,兼具快速、可视、操作简易、设备要求低、成本低等优点,近些年被广泛应用于动植物病原、基因突变或分型检测等[4-6]。本研究拟将蛋白芯片技术与DAB显色方法相结合,制备3种猪冠状病毒(PEDV、TGEV、PHEV)抗体可视化检测芯片,以满足基层临床对冠状病毒类疾病快速鉴别诊断的需求。该方法具有更加方便、快捷、直观等优势,可在临床、养殖场等设备条件不足的情况下,对PEDV、TGEV、PHEV 3 种猪冠状病毒的免疫效果评价、鉴别诊断等起到积极的推动作用。
1 材料与方法
1.1 血清阳性、阴性血清,均来自于吉林大学动物医学学院分子病理实验室。
1.2 主要材料与仪器镍离子亲和层析柱购自碧云天生物技术有限公司,PVDF 膜购自于Merck Millipore,NC膜购自于北京索莱宝科技有限公司,醛基基片购自于上海领成生物科技有限公司,DAB显色试剂盒购自于福州迈新生物技术开发有限公司,山羊抗猪IgG H&L(HRP)购自于Abcam。
1.3 重组蛋白的诱导表达、纯化与浓缩设计合成引物PHEV-N、TGEV-N、PEDV-N(表1)。提取动物组织总RNA,反转录为c DNA,PCR 扩增。将目的基因克隆至p ET-32a 载体,构建p ET-32a-PHEV-N、p ET-32a-TGEV-N、p ET-32a-PEDV-N原核表达质粒。将上述质粒转化至BL21大肠杆菌进行原核表达,当菌液D600 为0.8 时,加入1×10-4mol/L IPTG,37℃诱导8 h。收集菌体,溶解于 含0.01 mol/L 咪唑的8.00 mol/L 尿素之中,超声破碎,收集上清。镍柱法进行蛋白纯化,利用含0.20 mol/L 咪唑的8.00 mol/L尿素洗脱,经超滤管离心,得到2 000 mg/L的蛋白浓缩液。

表1 重组N 蛋白扩增引物信息
1.4 蛋白芯片制备与反应条件优化分别用水、磷酸盐缓冲液(PBS 0.01 mol/L,p H7.2)、含1%BSA的PBS、8 mol/L 尿素将重组蛋白稀释至30~2 000 mg/L。将特定稀释度样品分别点样至PVDF膜、NC膜、醛基基片上,于37℃温箱固定60 min。随后,以5%脱脂乳作为封闭液,37℃封闭60 min后,PBST 缓冲液洗涤5 min。将待检血清样品进行200~12 800倍稀释,滴加至封闭样孔,分别于37℃孵育30 min、37℃孵育60 min、25℃孵育2 h、4℃孵育8 h,PBST 洗涤3次。选择山羊抗猪IgG H&L(HRP)二抗于37℃孵育1 h,PBST 洗涤3次。最后,选用DAB 显色液进行1~10 min显色,滴加二蒸水终止反应,风干,肉眼观察检测结果。同时,白光拍照并进一步通过ImageJ、SPSS软件数据进行分析与处理。
1.5 蛋白芯片的敏感性与特异性检测基于上述优化体系,以不同浓度重组蛋白稀释液进行点样,每组3个重复,SPF猪血清IgG 为阳性质量控制,点样缓冲液为空白对照,制备3×5 蛋白芯片矩阵(图1)。利用该芯片分别检测PHEV、TGEV、PEDV、CSFV、PRRSV、PRV、PCV2等阳性血清,将检测结果与ELISA 检测结果对比分析,初步明确该蛋白芯片的敏感性与特异性。

图1 蛋白芯片矩阵
1.6 蛋白芯片重复性检测于不同时间制备3组蛋白芯片,检测已知血清,每组重复3次,分析组内、组间变异系数,确定本研究制备的蛋白芯片的重复性。
1.7 蛋白芯片稳定性检测将同一批次制备的蛋白芯片分别置于4℃保存4周、-20℃保存8周,根据显色效果确定本研究制备的蛋白芯片的稳定性。
1.8 临床血清样品的检测使用制备的蛋白芯片对来自吉林省松原市、白城市、梅河口市的100份临床血清样品进行检测,确定PHEV、TGEV、PEDV 3种病毒抗体的阳性率。
2 结果
2.1 蛋白固定载体的选择分别选用NC 膜、PVDF膜、醛基基片3种载体进行蛋白固定,结果如图2所示,3种重组蛋白均能够固定于上述3种载体上,且均可与血清抗体进行良好反应。但考虑到点样效果、显色效果、肉眼观察效果、设备下观察效果差异,最终确定NC膜为最适蛋白固定载体。
2.2 抗原点样缓冲液的选择分别选取无菌水、0.01 mol/L PBS、含1% BSA PBS 作 为 点 样 缓 冲液,以8 mol/L尿素作为阴性对照进行试验。结果如图3所示,各组重组蛋白在3种点样缓冲液中均可有明显显色反应,其中以0.01 mol/L PBS组效果最好。因此,本研究选择0.01 mol/L PBS作为抗原点样缓冲液。
2.3 抗原点样浓度的选择利用0.01 mol/L PBS作为抗原稀释液,对浓缩纯化的重组蛋白溶液进行梯度稀释,选取各浓度稀释液进行试验。如图4所示,3种蛋白分别在62.5,125.0,250.0 mg/L条件下有明显显色反应。排除假阳性的干扰,250.0 mg/L为PHEV-N 和PEDV-N 最适抗原点样质量浓度,125.0 mg/L为TGEV-N 最适抗原点样质量浓度。
2.4 待检血清样本孵育条件的选择分别将标准阳性血清滴加至标准化蛋白质芯片,分别于37℃孵育30 min、37℃孵育60 min、25℃孵育2 h、4℃孵育8 h。如图5所示,在4个孵育条件下显色效果均明显,综合考虑实际情况,37℃孵育60 min、25℃孵育2 h、4℃孵育8 h均可。

图3 抗原点样缓冲液的选择 A.孵育PHEV 阳性血清;B.孵育TGEV 阳性血清;C.孵育PEDV 阳性血清;D.孵育SPF猪血清;a.无菌水;b.0.01 mol/L PBS;c.含1%BSA PBS;d.8 mol/L尿素
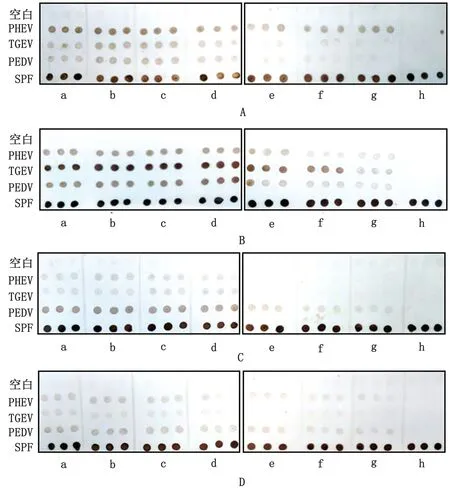
图4 抗原点样浓度的选择 A.孵育PHEV 阳性血清;B.孵育TGEV 阳性血清;C.孵育PEDV 阳性血清;D.孵育SPF猪血清;a.2 000.0 mg/L;b.1 000.0 mg/L;c.500.0 mg/L;d.250.0 mg/L;e.125.0 mg/L;f.62.5 mg/L;g.31.3 mg/L;h.空 白
2.5 显色时间的选择在上述研究的基础上,利用DAB显色液标记待检血清样本,分别选择1,3,5,10 min 作为显色时间点进行优化。结果如图6所示,3种重组蛋白在3~10 min显色条件下效果均明显。因此,确定3 min为DAB显色液的最佳显色时间。

图5 待检血清样本孵育条件的选择 A.孵育PHEV 阳性血清;B.孵育TGEV 阳性血清;C.孵育PEDV 阳性血清;D.孵育SPF猪血清;a.37℃孵育30 min;b.37℃孵育60 min;c.25℃孵育2 h;d.4℃孵育8 h
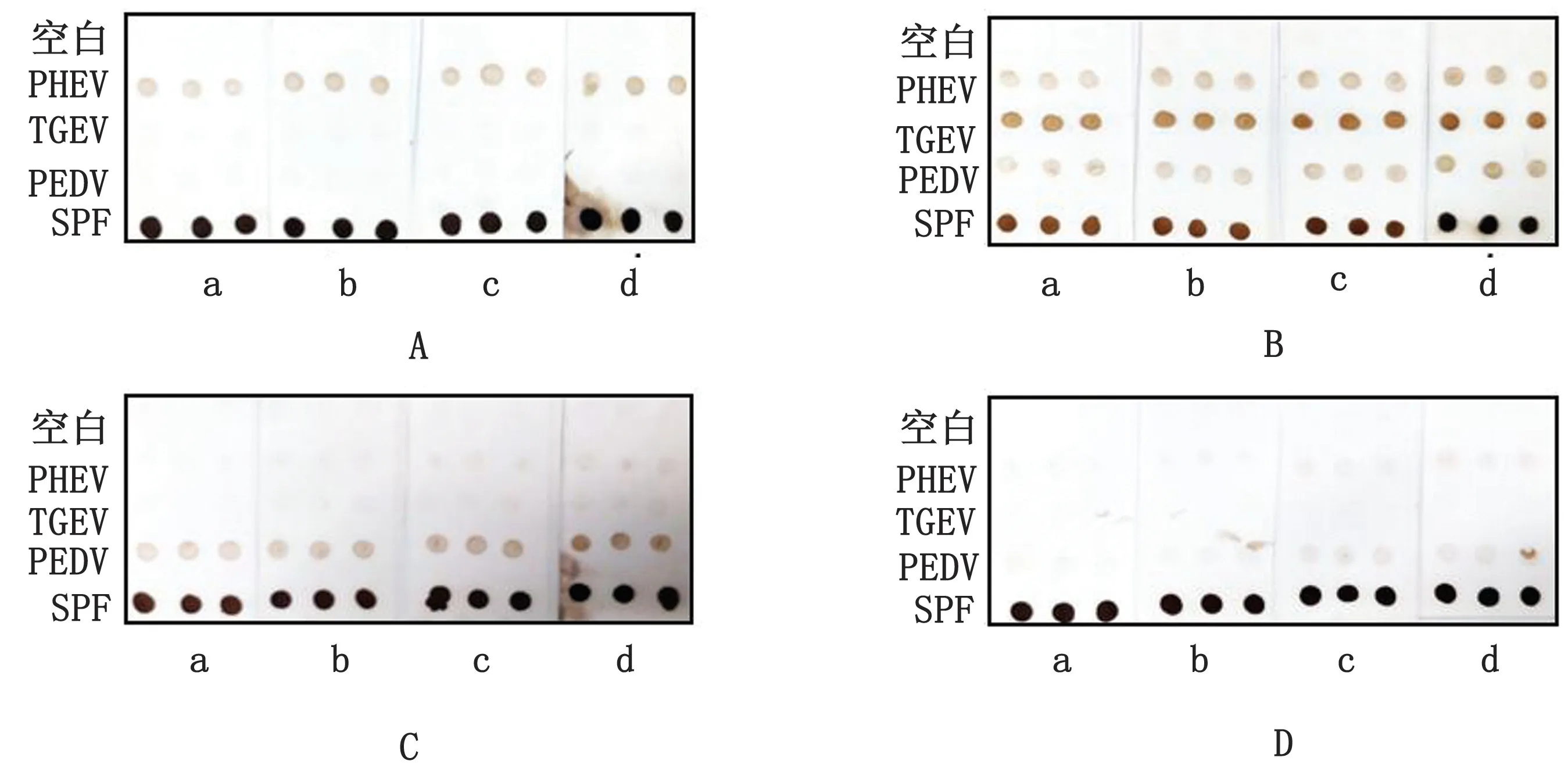
图6 显色时间的选择 A.孵育PHEV 阳性血清;B.孵育TGEV 阳性血清;C.孵育PEDV 阳性血清;D.孵育SPF 猪血清;a.1 min;b.3 min;c.5 min;d.10 min
2.6 判定标准的确定肉眼下,检测组圆点显色较深且质地凝实即可视为阳性;拍照保存并进行灰度值分析,参考石霖等[7]建立的方法,检测组圆点灰度值减去SPF猪血清孵育对照组圆点灰度值,大于等于SPF猪血清孵育对照组圆点灰度值3倍标准差即可视为阳性。
2.7 蛋白质芯片最低检测限的确定将效价均为27的3种病毒阳性血清梯度稀释,利用上述标准化可视化蛋白质芯片进行检测,以明确其最低检测限。如图7所示,3种蛋白分别于200~12 800倍稀释的血清中与抗体孵育结合,其中PHEV-N 蛋白、TGEV-N 蛋 白、PEDV-N 蛋 白 在3 200至12 800倍稀释下显色效果均较好,所以12 800倍稀释可分别作为最低检测限,用于判别诊断。
2.8 蛋白芯片敏感性与特异性分析取93例来自吉林省四平市、通化市的临床腹泻病待检血清进行检测,并与ELISA 检测结果相比较。如图8所示,两者符合率为91%,证明芯片敏感性好。如图9所示,PHEV、TGEV、PEDV 阳性血清检测结果均呈阳性,SPF猪阴性血清、CSFV、PRRSV、PRV、PCV2等阳性血清检测结果均呈阴性,PHEV、TGEV、PEDV阳性混合血清检测结果清晰,无交叉反应,证明芯片特异性较好。
2.9 蛋白芯片重复性检测本研究于不同时间制备3组芯片,设为组1~3,分别对上述93份血清进行重复性检测,每份血清重复3次。结果表明3组组内变异系数分别为0.68%,0.68%,0,组间变异系数为0.39%,均小于5.00%,证明重复性好。
2.10 蛋白芯片稳定性检测本研究将于同一批次制备的蛋白芯片分别于4℃保存4周、-20℃保存8周。结果显色效果均明显,证明本研究制备的蛋白质芯片在-20℃条件下,8周内稳定性良好。

图7 标准阳性血清最低检测限的确定 A.孵育PHEV 阳性血清;B.孵育TGEV 阳性血清;C.孵育PEDV 阳性血清;D.孵育SPF猪血清;a.200倍稀释;b.400倍稀释;c.800倍稀释;d.1 600倍稀释;e.3 200倍稀释;f.6 400倍稀释;g.12 800倍稀释;h.空白

图8 蛋白质芯片与ELISA 符合率比较图
2.11 临床血清样品的检测取100例来自吉林省松原市、白城市、梅河口市的临床患病待检血清进行检测,效果良好,PHEV、TGEV、PEDV 阳性率分别为32%,14%,81%。
3 讨论
目前,国内外针对PEDV、TGEV、PHEV 等病原已建立多种诊断方法,其中PCR、ELISA、免疫荧光等方法都需要专业设备,成本高昂,且仅限于实验室使用,而胶体金检测技术则通常只能识别1种抗体,在临床疾病鉴别诊断的复杂环境中同样不便。本研究建立了一种同时检测PEDV、TGEV、PHEV血清抗体的可视化蛋白芯片检测方法,能够快速、准确、直观的对3种病毒抗体进行初步监测。该检测方法的建立,在基层临床、养殖场等设备条件不足的情况下,对于该类疫病的及早诊断、防治能起到积极促进作用。目前,可视化芯片技术已广泛应用到动植物病毒检测、食品中抗生素残留检测、基因分型、酶功能鉴定等方面[8-11]。随着分子生物学技术的不断推广和充分应用,可视化芯片检测技术必将在现代化生猪养殖业发展过程中逐步发挥重要作用。
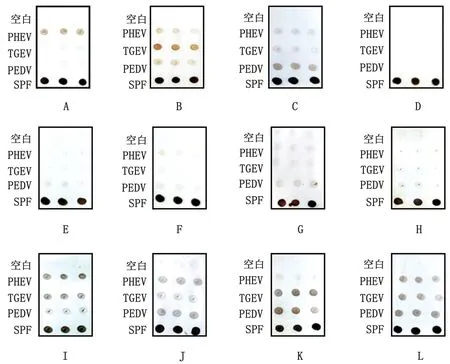
图9 蛋白质芯片特异性检测 A.孵育PHEV 阳性血清;B.孵育TGEV 阳性血清;C.孵育PEDV 阳性血清;D.孵育SPF猪血清;E.孵育CSFV 阳性血清;F.孵育PRRSV 阳性血清;G.孵育PRV 阳性血清;H.孵育PCV2阳性血清;I.孵育PHEV 和TGEV 阳性血清;J.孵育PHEV 和PEDV 阳性血清;K.孵育TGEV 和PEDV 阳性血清;L.孵育PHEV、TEGV 和PEDV阳性血清
蛋白质芯片技术在兽医诊断学上的应用在近些年来已取得了巨大进步[12-14]。本研究选取3种病毒的N 蛋白进行表达纯化,优化点样浓度、作用载体、显色方法等关键反应环境条件,最终实现对猪冠状病毒感染血清中病毒抗体进行检测。本研究建立的可视化蛋白质芯片的敏感性、特异性、重复性、稳定性良好,虽然与ELISA 的符合率并不能达到100%,但作为临床初步诊断的一种快速检测方法,是具有重要潜在应用价值。此外,作为传统实验室分子检测技术的替代方法,可视化蛋白质芯片兼具平价、易操作、高通量、易推广、易保存等优点,能够深入基层临床,为其他动物病毒性疾病检测方法的革新提供重要参考,有利于适应当今动物疫病检测的市场需求。
在未来研究工作中,可以针对更多的猪常见病毒病进行综合鉴别诊断,甚至于对更多新老再发疫病进行整体监控。上述基础研究工作的顺利开展,将对生猪养殖业规范化、规模化、自动化起到积极推动作用,有望为人类的食品安全环境带来重要提升。
