2017年河南省猪流行性腹泻病毒检测及基于S 1基因片段的遗传变异分析
2020-03-13郭振华阮海宇张改平河南省农业科学院动物免疫学重点实验室河南郑州45000河南农业大学牧医工程学院河南郑州45000云南农业大学动物医学院云南昆明65000
郭振华,阮海宇,李 翔,张改平,∗ (.河南省农业科学院 动物免疫学重点实验室,河南 郑州45000;.河南农业大学 牧医工程学院,河南 郑州45000;.云南农业大学 动物医学院,云南 昆明65000)
猪流行性腹泻病毒(porcine epidemic diarrhoea virus,PEDV)是引起猪病毒性腹泻的重要病原之一,特别是2010 以来,随着PEDV 变异株的出现,导致了猪流行性腹泻(porcine epidemic diarrhoea,PED)在我国的再度大范围流行[1-2]。2013年,PED在美国的暴发,标志着PEDV 在世界范围内的再度流行[3-4]。粪口途径是PEDV 传播的主要途径,虽然各个日龄的猪均可感染,但以新生仔猪的高发病率和高死亡率为主要特点,临床表现为呕吐、水样腹泻和严重的脱水;中大猪通常表现为一过性的水样腹泻[5]。
PEDV属于尼多病毒目(Nidovirales),冠状病毒科(Coronaviridae),甲型冠状病毒属(Alphacoronavirus)[6],同属于该科的还有猪传染性胃肠炎病毒(porcine transmissible gastroenteritis virus,TGEV)以及2014年报道的猪德尔塔冠状病毒(porcine deltacoronavirus,PDcoV)和2017-2018年报道的猪急性腹泻综合征冠状病毒(swine acute diarrhoea syndrome coronavirus,SADS-CoV)[3,7-10]。PEDV 为带囊膜的单股正链RNA 病毒,基因组大小约28 000 bp,包含7个开发阅读框(open reading frames,ORFs),分别编码
ORF1a、ORF1b、spike(S)、ORF3、envelope(E)、membrane(M)、nucleoprotein(N)[11]。其中S蛋白是1个相对分子质量约为200 000的糖蛋白,与病毒入侵宿主细胞紧密相关,也是产生中和抗体的主要靶标蛋白。S蛋白又可以被剪切为S1(1~730 aa)和S2(731~1 383 aa)2个亚基,S1亚基与受体的结合有关,也是诱导产生中和性抗体的主要区域;而S2亚基则与膜融合有关。S1亚基含有4个重要的结构域,分别为S10(19~211 aa)、S1A(212~511 aa)、S1B(512~641 aa)和S1CD(642~730 aa)。其中S10区是1个高度变异的区域,氨基酸的插入和缺失也主要发生在这一区域[12]。
监测引起猪病毒性腹泻的主要病原的流行情况和遗传变异情况,有助于制定针对性的预防控制方案。本研究检测了河南省94份临床仔猪腹泻的肠道或粪便样品,开展了针对4种猪肠道冠状病毒的分子检测工作。同时我们针对成功获得的8 株PEDV 的S1基因片段序列,通过遗传进化树的构建和氨基酸序列的比对,分析了当前流行毒株的主要分子遗传和变异特点。
1 材料与方法
1.1 病料采集及预处理腹泻病料主要来自2017年度河南省内发生仔猪腹泻的养殖场,共收集了来自25个养猪场的94份病料样品。肠道或粪便样品加入适量的PBS 缓冲液,匀浆后反复冻融3 次,12 000 r/min 离心2 min,将上清转入新的1.5 m L离心管中,-80℃保存备用。
1.2 引物合成本研究所用的引物序列信息参见表1。其中PEDV、TGEV、PDco V 和SeCo V 的检测引物参考已发表的文献[3,8,13],扩增PEDVS1基因片段的引物是根据NCBI GenBank数据库中已发表的序列,利用Primer Premier5.0软件进行设计。所有的引物由生工生物(上海)股份有限公司合成。
1.3 核酸提取与RT-PCR病毒核酸提取试剂(Ta KaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0)、反转录试剂(PrimeScript RT Master Mix)、DNA 聚 合 酶(TaqPlus Master Mix,Prime-STAR Max DNA Polymerase)均购自宝生物工程(大连)有限公司。具体的操作参照产品使用说明书进行,反转录后获得的cDNA 保存于-20℃。PCR扩增反应体系(25μL)如下:2×TaqPlus Master-Mix 或 者 PrimeSTAR Max DNA Polymerase 12.5μL,cDNA 模 板2.0 μL,上、下 游 引 物 各0.5μL,dd H2O 9.5μL。反应参数如下:98℃预变性2 min;98℃变性10 s,55℃退火15 s或者30 s,72℃延伸时间根据扩增片段大小进行设定;共30 个循环;最后延伸72℃5 min。PCR 产物采用1.5%琼脂糖凝胶进行电泳分析。
1.4 基因克隆与测序基因的克隆使用高保真DNA 聚合酶(PrimeSTAR Max DNA Polymerase)进行基因片段的扩增。扩增产物利用胶回收试剂盒(E.Z.N.A.® Gel Extraction Kit,Omega Bio-tek,Inc.)进行切胶回收纯化,获得的基因片段直接连接到p EASY-blunt载体上(北京全式金生物技术有限公司),转化Trans5α化学感受态细胞(北京全式金生物技术有限公司),利用菌落PCR 鉴定阳性克隆,分别挑取3个阳性克隆送生工生物(上海)股份有限公司进行序列测定。
1.5 遗传变异分析及进化树构建序列的同源性分析主要使用 DNAStar Meg Align(Clustal W method)软件进行。序列的比对分析主要通过MEGA6.0(Clustal W method)来进行;进化树的构建主要基于MEGA6.0(Neighbor-joining method)来进行。参考毒株序列信息主要从NCBI的Gen-Bank数据库中获得,具体的序列信息见表2。

表1 引物序列信息
2 结果
2.1 临床检测结果发生仔猪腹泻的25家养猪场分别位于河南省的12 个地市(表3),检测结果显示,19家养猪场PEDV 检测为阳性,占发生腹泻猪场 的76.0%;94 份 腹 泻 病 料 中,64 份 为PEDV 阳性,约占检测病料的68.1%。同时,我们也检测了其他3 种引起仔猪腹泻的猪肠道冠状病毒TGEV、PDco V 和SeCo V,结果均为阴性。说明当前河南省内引起仔猪病毒性腹泻的病原主要是PEDV。
2.2 基于S 1基因的遗传进化树分析本研究共获得了8株流行性腹泻病毒的S1基因片段序列,根据其养殖场所在的地市分别命名为HeNJZ/2017(焦 作)、HeNLY/2017(洛 阳)、HeNLH/2017(漯河)、HeNPDS/2017(平 顶 山)、HeNZK/2017(周口)、HeNZM/2017(中牟)、HeNWX/2017(温县)和HeNYZ/2017(禹州)。结合从NCBI GenBank数据中选取的36株参考序列,利用MEGA6.0软件绘制了河南省流行毒株的遗传进化树(图1)。结果显示,我国的PEDV 可以分为2个大的进化分支:G1经典毒株(G1 classical strains)和G2变异毒株(G2 variants);G1经典毒株又分为2个进化亚支,分别是G1a和G1b,G1a主要是弱毒疫苗株及其衍生毒株,G1b主要是传统意义上认为的田间流行经典野毒株。G2变异毒株根据其遗传进化特点也可以分为3个进化亚支,G2a、G2b 和G2c,其中G2a主要是2011-2013年分离的流行毒株,G2b主要是2016-2017年分离的流行毒株,G2c是2个已报道的重组毒株。本研究所获得的8株序列均属于G2b进化分支,与2016-2017年分离的流行毒株进化关系更近。
2.3 S 1 基因片段的同源性分析利用DNAStar Meg Align(ClustalW method)对分离序列和参考序列进行基因同源性分析显示(图2),分离的8株序列彼此核苷酸同源性为97.3%~99.5%,与我国变异毒株代表毒株AJ1102的同源性最高,为97.2%~98.0%。而与疫苗毒株CV777/CV777 和我国经典毒株CH/S的同源性较低,分别为91.3%~92.3%和91.0%~91.6%。此外,我们发现2个参考毒株JS2008和JSLS-1/2015与疫苗毒株CV777呈现出了很高的核酸序列同源性,分别为99.7%和99.6%。
2.4 S 1基因片段氨基酸变异分析S1基因片段的氨基酸序列分析显示(图3),与疫苗毒株CV777/CV777和经典毒株CH/S相比,当前流行的变异毒株在多个氨基酸位点发生了变异,同时伴随着氨基酸的插入和缺失。S10(19~211 aa)区域是氨基酸发生变异、插入和缺失的主要区域,共有32个氨基酸位点发生变异,同时在58NQGV61、140N、157H 这3个位置有氨基酸的插入,在163NI164有2个氨基酸的缺失;而S1A(212~511 aa)区域有9个氨基酸位点变异、S1B(512~641 aa)有3个氨基酸位点发生变异、S1CD(642~730 aa)区域有2个氨基酸位点发生变异,这3个区域相对保守。除此之外,与其他变异株相比,我们发现1个分离株HeNPDS2017在491位新缺失了1个丝氨酸(Ser)。
表2 参考毒株序列信息

表3 样品信息及PEDV 检测结果
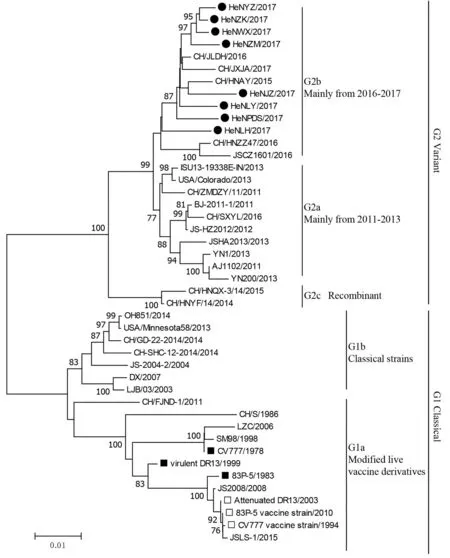
图1 基于S 1基因片段的分子进化树分析 ●.表示本研究所获得的流行毒株序列;■.表示用于制备弱毒疫苗的父母代毒株;□.表示弱毒疫苗毒株;分子进化树是利用MEGA6.0软件的邻位法(neighbor-joining method)构建

图2 基于S 1基因片段的核苷酸同源性分析

图3 基于S1基因片段的氨基酸序列比对分析 利用MEGA6.0软件的Clustal W 法进行序列比对分析,黑色方框表示氨基酸插入或者缺失的位置;红色方框表示弱毒疫苗毒株特有的氨基酸位点;星号表示与广谱性中和抗体相关的氨基酸位点;黑色箭头是S10(19~211 aa)、S1 A(212~511 aa)、S1B(512~641 aa)和S1CD(642~730 aa)4个区域的位置区分
3 讨论
英国在1971年首次报道了PED 的发生,但直到1978年,才由比利时科学家分离到了引起PED的病原-PEDV,并将其中1 个分离株命名为CV777,这也成为以后开发灭活疫苗和弱毒疫苗的主要制苗毒株[6]。我国关于PED 的描述最早见于1973年,但直到1984 年才分离到该病的病原[14]。2010年以前,PEDV 在我国主要呈散发和局部流行,2010年10月份以来,随着变异株的出现,PEDV迅速在我国猪群中传播扩散,临床主要表现为新生仔猪的水样腹泻,具有很高的发病率和致死率[1-2,15-16]。2013年,PED 在美国暴发,随后的1年时间,导致了约700 万头仔猪的损失[4,17]。目前,PEDV 在世界范围内呈流行态势,给养猪产业造成了巨大的经济损失。
除了PEDV 可以引起新生仔猪水样腹泻外,同属于冠状病毒科的TGEV 以及2014年美国报道的PDco V 和2017-2018 年我国报道的SADS-Co V,也可以引起相似的临床症状[3,7-10]。因此,做好猪肠道冠状病毒的临床监测工作,对于把握猪病毒性腹泻主要致病病原的流行情况非常重要,也有助于制定针对性的临床防控方案。本研究针对河南省25家养殖场送检的94份临床仔猪腹泻肠道样品,开展了仔猪病毒性腹泻相关病原的检测工作,结果显示19家养殖场的腹泻疫情是由PEDV 的感染导致的,占发生腹泻疫情猪场的76.0%;94份临床样品中,PEDV 的阳性率为68.1%,但并未检测到TGEV、PDco V 和SADS-Co V。提示当前河南省引起仔猪病毒性腹泻的主要病原为PEDV。需要说明的是,针对94份临床样品,我们并未开展引起仔猪腹泻的细菌性病原的相关检测工作,因此细菌性病原的感染情况或者细菌性病原与病毒的混合感染情况有待于进一步的研究。
为进一步分析当前PEDV 流行毒株的遗传变异特征,我们从8家养殖场成功获得了8株PEDV的S1基因片段,同时从GenBank数据库选择了36个参考毒株,进行生物信息学的相关分析。分子进化树分析显示,河南省当前流行毒株均属于G2变异株,且处于G2b进化分支,主要与2016-2017年的流行株遗传距离较近,而与2011-2013年的流行株遗传距离相对较远,提示PEDV 变异株在田间流行的过程中,发生着持续的变异进化。核酸序列同源性分析显示,分离株与与我国变异毒株AJ1102的同源性最高,为97.2%~98.0%。而与疫苗毒株CV777和我国经典毒株CH/S的同源性较低,分别为91.3%~92.3% 和91.0%~91.6%。
氨基酸序列比对分析显示,与经典毒株相比,我国流行的变异毒株S1基因片段在多个位点发生了氨基酸变异,其中S10(19~211 aa)区是氨基酸发生变异、插入和缺失的主要区域,在58NQGV61、140N、157H 这3个位置有氨基酸的插入,在163NI164位有2个氨基酸的缺失,S10区主要与唾液酸的结合活性和血凝活性相关;而S1A(212~511 aa)、S1B(512~641 aa)和S1CD(642~730 aa)区则相对保守,仅有个别的氨酸酸发生了变异。此外,与其他变异毒株相比,我们发现分离株HeNPDS/2017 在491 位有1个新的丝氨酸(Ser)缺失位点,其生物学意义有待进一步的研究。最近的研究显示,中和性抗原表位存在于S10和S1B区,且第100 位的苯丙氨酸(Phe)、129位的脯氨酸(Pro)和640位的缬氨酸(Val)对于抗体的中和活性至关重要[12]。需要注意的是这3个氨基酸位点在我国的经典毒株和变异毒株中具有高度的保守性,但现有的商品化疫苗株(CV777、ZJ08和AJ1102)对PED 的疫情防控效果却并不理想,提示应该有新的中和性抗原表位的存在,并且这一表位与PEDV 的免疫逃逸具有很好的相关性。因此,关于PEDV 的中和性抗原表位的鉴定和发现有待进一步的深入研究。
另一个需要关注的问题是弱毒疫苗的大量使用导致的疫苗株及其衍生毒株在田间的流行。我们在做S1基因片段的核苷酸同源性分析时,发现2个参考毒株JS2008 和JSLS-1/2015 与疫苗毒株CV777具有高度的核苷酸同源性,分别为99.7%和99.6%。进一步的氨基酸序列比对分析显示,三者具有高度一致的氨基酸序列,并且有多个氨基酸位点(图3红色方框内)是疫苗毒株CV777所特有的,提示JS2008和JSLS-1/2015这2个参考毒株极有可能是疫苗衍生毒株。
总之,本研究分析了2017年河南省引起仔猪腹泻的主要病毒性病原的流行情况,确定了当前引起仔猪病毒性腹泻的主要病原依然是PEDV。同时基于分离株的S1 基因片段的遗传进化和同源性分析,确定了当前河南省PEDV 流行株均属于变异毒株,且处于G2b进化分支。氨基酸序列分析显示,与经典毒株相比,变异毒株具有特征性的氨基酸插入和缺失等遗传标记;此外,我们发现分离株HeNPDS/2017在491位有1个新的丝氨酸(Ser)缺失位点,提示随着时间的推移,变异毒株依然在发生着快速的遗传演变。这对PEDV 的临床防控构成了巨大的挑战,也需要进一步加大PEDV 的基础研究工作,从而为PEDV 的成功防控提供理论支撑。
