河北省猪圆环病毒3型流行病学调查及遗传变异分析
2020-03-13师乾凯张增贤贾敬亮侯林杉范京惠左玉柱河北农业大学动物医学院
师乾凯,张增贤,贾敬亮,张 迪,管 朔,侯林杉,范京惠∗,左玉柱∗ (.河北农业大学 动物医学院,
河北 保定071001;2.河北省宁晋县畜牧兽医管理办公室,河北 宁晋055550;3.河北省衡水市畜牧技术推广站,河北衡水053000)
猪圆环病毒3型(porcine circovirus3,PCV3)是近年来新发现的一种能够引起仔猪消瘦、腹泻、关节肿胀、呼吸系统疾病及母猪繁殖障碍疾病的病毒[1-2]。该病毒于2016 年由PALINSKI等[2]在患猪皮炎肾病综合征(PDNS)及繁殖障碍的猪中首次检出,随后在包括欧洲、亚洲、北美洲及南美洲等国家均有关于该病的报道[2-5]。我国于2016年由KU等[6]首次检测到并报道了PCV3 的存在。然而,SUN 等[7]在对PCV3的回顾性研究中发现,在中国PCV3的首次出现可追溯到1996年,表明多年来该病毒在国内猪群中的长期存在。自PCV3被发现以来,该病毒在发病猪群中一直有较高的阳性率,并且,最近有研究调查指出PCV3在无临床症状的猪群中同样有较高的阳性率,潜在危害猪群健康[8]。因此,进一步了解PCV3在猪群中的发病情况、流行特点对该病的有效防控及降低养猪业的经济损失具有重要意义。
PCV3属于圆环病毒科,圆环病毒属,是继猪圆环病毒1型(PCV1)和猪圆环病毒2型(PCV2)之后新出现的病原体。该病毒无囊膜,为单股环状DNA病毒,其基因组大小为2 000 bp,由2个主要的开放性阅读框(ORF1和ORF2)组成[2]。其中ORF1主要编码一种参与病毒复制的相关蛋白(replicationassociated protein,Rep),该蛋白相对保守;ORF2主要编码该病毒唯一的结构蛋白(capsid protein,Cap),被认为与病毒的感染及免疫相关。作为除PCV2又新出现的1种圆环病毒科,PCV3的研究尚未深入。同PCV2类似,目前,关于PCV3的研究主要集中在该病毒的ORF2区域,一些诊断方法的建立及病毒的功能性研究也主要依赖于Cap蛋白进行展开[9],同样,国内外学者主要依据PCV3的Cap蛋白对病毒进行进化树的构建及遗传变异分析,为病毒的遗传演化及生物特性研究提供理论基础[10]。
本研究中,为了解河北省PCV3的流行情况及遗传变异特征,对2017年2月至2018年7月间采集自本省的310份病料进行PCV3的检测,同时对该病毒的cap基因序列进行扩增并构建进化树,为PCV3的综合防控及进一步研究提供科学的理论依据。
1 材料与方法
1.1 病料采集2017年2月至2018年7月间,从河北省不同地区规模化猪场采集310份临床表现为腹泻、呼吸系统疾病、皮炎、繁殖障碍等症状的不同年龄段发病猪的组织脏器,于-80℃保存备用。
1.2 主要试剂DNA/RNA 提取试剂盒购自北京全式金生物科技有限公司;琼脂糖凝胶DNA 纯化回收试剂盒、普通质粒小量提取试剂盒和TaqPlus Master Mix 购自北京康为世纪生物科技有限公司;反转录试剂盒、p MD19-T 载体购自宝生物工程(大连)有限公司;猪繁殖与呼吸综合征病毒(PRRSV)、猪伪狂犬病毒(PRV)、猪细小病毒(PPV)、PCV2、猪流行性腹泻病毒(PEDV)诊断试剂盒购自北京世纪元亨动物防疫技术有限公司。
1.3 引物的设计与合成根据GenBank已登录的PCV3的基因序列,利用生物学软件Primer Premier 5在PCV3的基因和cap基因分别设计1对检测引物和1对用于扩增cap基因全长的引物(表1)。引物由生工生物工程(上海)股份有限公司合成。
1.4 组织样品处理及病毒核酸提取取组织病料及无菌PBS水,按照1∶5比例混合、研磨成组织匀浆,经反复冻融3次;7 000 r/min离心10 min,取其上清进行核酸提取。按照DNA/RNA 提取试剂盒说明书进行病毒核酸的提取,同时取部分核酸样品按照反转录试剂盒说明书进行反转录制备c DNA,置于-80℃保存备用。

表1 引物序列
1.5 组织样品的PCR 检测以提取的样品核酸DNA 作为模板,使用引物PCV3-F/PCV3-R 进行检测,PCR 反应体系20μL:2×TaqPlus Master Mix 10μL,DNA 模 板2 μL,上、下 游 引 物 各1 μL(20μmo L/L),dd H2O 6μL。PCR 反应条件:94℃5 min;94℃30 s,54℃30 s,共35 个循环;72℃7 min。PCR 反应产物用1.5%琼脂糖凝胶电泳鉴定,纯化后分别克隆至p MD19-T 载体,阳性克隆测序鉴定。测序鉴定为阳性的组织样品,以其核酸DNA/RNA 作为模板,分别使用PRRSV、PRV、PPV、PCV2、PEDV 诊断试剂盒进行检测,调查PCV3与其他病毒的共感染情况。
1.6 PCV3 cap 基因组扩增及序列比对分析从鉴定为PCV3阳性的组织病料中随机挑选不同地区的样品DNA 作为模板,使用引物PCV3-capF/PCV3-capR 进行cap基因序列扩增、克隆、测序。利用DNA Star软件中的Meg Align软件对测序成功的cap基因与GenBank中已发表的参考基因所推导的氨基酸序列进行比对,分析河北省不同地区毒株之间的变异情况;同时,使用MEGA 7软件对获得的cap基因序列与参考序列进行进化树的构建,了解毒株的遗传进化情况。
2 结果
2.1 PCV3 的 流 行 病 学 调 查对2017 年2 月 至2018年7月间,从河北省不同地区60个规模化猪场采集的310份病料进行检测,结果显示PCV3的样品阳性率为16.5%(51/310),猪场阳性率为45.0%(27/60)。对不同市的检测结果分析显示沧州地区的检出率明显高于其他地市,可达29.1%(图1);对患有不同临床症状的发病猪进行检测,结果表明在患有腹泻及繁殖障碍的猪中具有高的阳性率,分别可达23.6%(13/55)和23.5%(8/34)(表2)。同时,在本研究中对PCV3与其他病毒的共感染情况进行了调查分析,结果显示以PCV3 与PCV2共感染情况最为多见为33.3%(17/51),其次为PRRSV(15.7%),PEDV(13.7%),PRV(11.8%)和PPV(3.9%)。
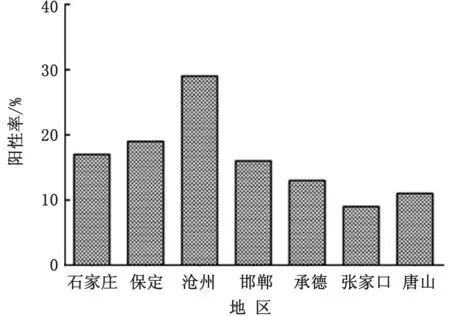
图1 河北省不同地区PCV3病原调查结果

表2 不同临床症状PCV3感染结果
2.2 PCV3 cap 基因序列扩增结果本研究选取了河北省部分地区的8份PCV3阳性病料,并对cap基因进行扩增测序,测序结果显示所得cap基因序列大小为645 bp,并上传至GenBank(表3)。
2.3 PCV3 cap 基因序列分析Cap蛋白被认为与圆环病毒的毒力有关,并且被广泛用于该病毒的分型及活性研究[11-12]。本研究用DNAStar软件对8株PCV3病毒的cap基因进行序列比对显示,所得序列之间的核苷酸相似性为98.0%~99.7%,所推导的氨基酸相似性为97.7%~99.5%。其中,PCV3/CH/HB-ZJK/2018 株 与PCV3/CH/HB-TS/2018 株,PCV3/CH/HB/BD/2017 株 与 PCV3/CH/HB/CZ-1/2017株核苷酸差异性最小为99.7%;PCV3/CH/HB/CZ-2/2017株与PCV3/CH/HB/SJZ/2017 株之间核苷酸差异性最大为98.0%。8株PCV3病毒的cap基因与GenBank所登录的24条国内外参考株之间序列比对,结果显示基因序列间的核苷酸相似性为98.0%~100.0%,所推导的氨基酸相似性为97.2%~99.5%。其中,PCV3/CH/HB-ZJK/2018株与中国株PCV3/CN/Fujian-HWK2/2016株之间的核苷酸差异性最小为100.0%;PCV3/CH/HB/HD/2017株与美国株PCV3/2164/USA 株之间的核苷酸差异性最大为98.0%(图2)。

表3 PCV3分离株登录号及来源

图2 PCV3 cap 基因核苷酸序列比较
对cap基因所推导的氨基酸序列进行分析,结果显示所推导的Cap蛋白氨基酸共215个,无氨基酸插入或缺失等现象发生。与24条国内外参考株进行比对结果显示,Cap蛋白上的氨基酸突变主要发生在24,27,77及150处氨基酸位点(图3)。其中,在24~27处氨基酸位点有4种突变,显示分别为24VRRR27、24ARRR27、24ARRK27和24VRRK27,本研究所获得的8条Cap氨基酸序列中,有5条(PCV3/CH/HB/BD/2017 株、PCV3/CH/HB/CZ-1/2017 株、PCV3/CH/HB-ZJK/2018株、PCV3/CH/HB/HD/2017株和PCV3/CH/HB/SJZ/2017 株)为24ARRK27突变,有2 条(PCV3/CH/HB/CZ-2/2017 株 和PCV3/CH/HB-CD/2018株)为24ARRR27突变,有1条(PCV3/CH/HB-TS/2018株)为24VRRR27突变。在77和150处氨基酸位点变异主要为77 S→T,150 I→L,这2处突变主要发生在24ARRR27变异组中,参考序列中77和150位氨基酸突变都是同时发生,但在本研究中分离的PCV3/CH/HB/CZ-2/2017株只在150处氨基酸位点发生了突变。另外,PCV3/CH/HB/CZ-1/2017株在156氨基酸位点发生了156 S→R突变,PCV3/CH/HB/SJZ/2017株在180氨基酸位点发生了180V→A突变。这些位点的突变可能会改变病毒的致病性及毒力。

图3 PCV3 ORF2氨基酸序列比较
应用生物学软件MEGA7.0对研究所获得的8条cap基因序列及24条参考序列进行进化树的构建,遗传变异情况分析显示所分析的31条分离株可分为3个基因群3a,3b和3c(图4)。与图3结果对比分析显示,基因群3a主要包括24ARRR27突变株及1条24VRRR27突变株(PCV/KU-1601 株),基因群3b主要包括24ARRK27突变株,基因群3c主要包括24VRRK27突 变 株 及1 条24VRRR27突 变 株(PCV3/CH/HB-TS/2018株),本研究中所分离的8条分离株均在基因群3a和3c中,说明了河北省PCV3病毒序列相对稳定。

图4 PCV3 cap 基因系统进化树
3 讨论
PCV3自2016年被报道以来,已经引起国内外学者的广泛关注。作为一种新发现的病毒,PCV3致病性及许多生物学特性方面的研究尚处于探索阶段,迄今为止尚未有关于成功分离PCV3的报道,且无有效疫苗用于该病的防控,因而,现阶段对该病毒的研究热点主要集中在流行病学调查及毒株的遗传进化分析方面[10]。目前,已有许多国家报道了该病的流行情况,发现其在发病猪群及健康猪群中均具有较高的阳性率,为该病的流行情况及发病特点提供了理论参考。因此,进一步了解PCV3在河北省的流行情况及毒株特点有助于为PCV3的综合防控提供科学的指导。
本研究对2017年2月至2018年7月间,从河北省不同地区猪场采集的310份临床样本检测显示其阳性率可达16.5%,该结果略高于WANG 等[13]2017年所报道的阳性率,进一步证实了该病毒在河北省的存在及流行。与临近的省市相比,本研究的检出率低于河南、北京及山东地区的阳性率[8,14-15],说明较周边地区相比,河北省PCV3的感染情况相对稳定。PCV3感染猪后可引起呼吸系统疾病,关节肿胀、多系统综合征及母猪繁殖障碍等临床症状,在危害猪群健康的同时也给养猪业带来了严重的经济损失,在我们的研究中,对表现为不同临床症状的PCV3发病猪群进行统计,发现在临床表现为腹泻及繁殖障碍的发病猪中阳性率较高,这一结果与ZHAI等[16]和FU 等[17]调查结果相似,表明了PCV3可作为1个病原在肠道感染及生殖系统感染中发挥重要作用,但其对机体中的致病机理还需进一步研究。作为继PCV2之后的又一新出现的圆环病毒科病毒,PCV3与其他病毒共同感染研究已被广泛报道,其中最为常见的是可以与PCV2,PRRSV 和PRV 等病原体的共感染,在本研究中,我们对PCV3阳性病料中临床常见的几种病毒进行检测,发现PCV2与PCV3的共感染率可达33.3%,显著高于与其他病毒的共感染情况,此结果与XU等[14]和FU 等[17]研究结果相似,表明PCV3 与PCV2在猪圆环病毒相关疾病(PCVAD)中有重要的致病作用,并推测在感染过程中病原间的毒力可能有相互促进作用。
在本研究中,对8 个河北省分离的病毒进行cap基因的扩增、序列分析及进化树构建,结果显示所获得的8个分离株与国内外参考株间的同源性可达98.0%~100.0%,表明同源性较高,国内外PCV3流行株相对稳定。对其进化树的构建及氨基酸序列分析发现,所分析的32条cap基因序列可分为3a、3b和3c共3 个基因群,其中基因群3a主要包括24ARRR27突变株,基因群3b主要包括24ARRK27突变株,基因群3c主要包括24VRRK27突变株,进一步证实了FU 等[17]学者的研究结果。SUN 等[7]在一次回顾性研究1993-2017年所分离的PCV3毒株的Cap氨基酸序列分析得到,PCV3在Cap位点上突变顺序由24ARRR27至24ARRK27而后突变为24VRRK27。然而,在我们的分析中,除上述3种突变外,还存在2条分离株序列发生了24VRRR27突变,这2条分离株在进化树上显示分别位于3a和3c基因群中,我们的结果可为PCV3进化动力学的研究提供一个参考,该推测有待进一步研究证实。另外,除24及27位氨基酸位点有主要变异外,其他位置变异的发生及突变后是否对毒株的毒性产生影响还需进一步研究说明。
本研究中对河北省规模化猪场发病猪的检测,证实了PCV3在该地区猪场的广泛存在。在研究中也对该病毒的发病特点及流行情况进行了调查,同时,通过对分离株的遗传变异分析我们得到了不同基因群的PCV3流行株,为该病毒在河北省的流行及进化特点提供了理论参考。这些数据可为该地区PCV3的诊断及综合防控提供科学依据。
