基于AMPK/SIRT1通路探讨消溶稳斑方对不稳定斑块的作用❋
2020-03-13邵静,蒋静
邵 静,蒋 静
(1.河南中医药大学第一附属医院,郑州 450000;2.河南中医药大学,郑州 450000)
动脉粥样硬化是心脑血管疾病的共同病理基础,冠状动脉粥样硬化易损斑块破裂、继发血栓形成是急性冠脉综合征的主要发病机制[1]。因此,维持动脉粥样硬化斑块的稳定性对于心血管疾病的防治有重要意义。动脉粥样硬化斑块的破裂是多因素共同作用的结果,其中炎症反应机制在不稳定斑块的演变中起重要作用[2]。目前,西医根据动脉粥样硬化形成的机制,将治疗动脉粥样硬化的药物分为降脂药、抗氧化药、抗血小板聚集药及新型PCSK9抑制剂[3],并在临床得到广泛应用。虽然对于降脂、稳定斑块有效,但长期应用存在一定副作用,如肝损伤、肌溶解、局部不良反应等[4]。中医药在防治动脉粥样硬化不稳定斑块方面的研究已取得新进展,中医认为动脉粥样硬化的形成与痰浊和瘀血等病理产物密切相关,主张从痰论治、从瘀论治[5]。研究发现,清热解毒类、活血化瘀类中药有一定的降脂、稳定斑块的作用[6-7],越来越多的中药被应用于抗动脉粥样硬化疾病。结合多年临床经验,笔者以“益气活血,化痰通络”为法自拟消溶稳斑方,通过团队的前期研究发现,消溶稳斑方在改善不稳定型心绞痛、增加心肌血供等方面有较好的疗效[8],故本研究拟在前期研究的基础上,通过建立小鼠主动脉弓动脉粥样硬化易损斑块模型,基于腺苷酸活化蛋白激酶(AMPK)与沉默信息调节因子1(SIRT1)信号通路,检测消溶稳斑方对动脉粥样硬化小鼠磷酸化腺苷酸活化蛋白激酶(P-AMPK)、SIRT1蛋白表达及相关炎症因子水平的影响,探讨消溶稳斑方防治不稳定斑块的作用机制。
1 材料与方法
1.1 动物与材料
1.1.1 动物 6周龄雄性ApoE基因敲除小鼠48只与 C57BL/6 J小鼠16只,购自河南省实验动物中心。本实验已通过河南中医药大学实验动物伦理委员会审查。
1.1.2 主要试剂 β-actin单克隆抗体(SANTA,SC-47778)、P-AMPKα(Thr172)抗体(CST,2535T)、AMPKα抗体(CST,5832T)、SIRT1抗体(peprotech,60303-1-Ig)、eECL Western Blot Kit高灵敏度化学发光检测试剂盒均购自北京康为世纪生物科技有限公司,CW0049;HE染色试剂盒购自武汉伊莱瑞特生物科技股份有限公司;PVDF膜购自MILLIPORE公司;脱脂奶粉(OXOID,lp0031)、Tris碱(AMRESCO,0497-500G)、甘氨酸(AMRESCO,M103-1KG)、十二烷基硫酸钠(AMRESCO,M107-250G)、丙烯酰胺(AMRESCO,M104-50G)、N,N’-亚甲叉丙烯酰胺(AMRESCO,M8200 N)、过硫酸铵(AMRESCO,0486-100G)、四甲基乙二胺(Sigma,T9281-25ML)、溴酚蓝(AMRESCO,0449-100G)。
1.1.3 实验仪器 DYY-6C型电泳仪,BIO-RAD Mini-TRANS-BLOT CELL,DYCZ-24DN型迷你双垂直电泳槽,TS-1脱色摇床(太仓市实验设备厂),生物分子成像仪(日本富士LAS-4000 MINI),低温高速离心机(日立,CF16RXⅡ)、全波长扫描式多功能读数仪(Thermo fisher)、倒置相差显微镜(日本 OLYMPUS)、冰箱BCD-233 GB(青岛海尔股份有限公司)、37 ℃恒温培养箱(北京福意电器有限公司)、包埋机(科迪仪器设备有限公司,KD-BM)、切片机(德国Leica公司,RM2126)。
1.2 实验所需药物
瑞舒伐他汀钙片(阿斯利康药业(中国)有限公司,批准文号:国药准字J20170008);消溶稳斑方(黄芪 15 g,葛根 15 g,半夏 10 g,水蛭 10 g,佛手 15 g,郁金 15 g,地龙 15 g,甘松 10 g)浸膏。浸膏的制备:首先将中药郁金、地龙、水蛭饮片研磨成粉,佛手、甘松含挥发油成分,分别采用水蒸气蒸馏法收集挥发油,各自另存备用。将佛手、甘松的药渣与黄芪、葛根、半夏加水煎煮2次,每次用时1 h,将2次煎得的药汁混匀,然后过滤,将滤液减压浓缩至相对密度2.1 g/ml 的稠膏,加入水蛭、郁金、地龙粉末混合均匀即可。
1.3 分组及药物干预
C57BL/6 J小鼠16只和ApoE基因敲除小鼠48只分别给予标准饲料和高脂饲料,持续喂养8周后,进入药物干预期分为8组:C57+标准+水组、C57+高脂+水组、ApoE+标准+水组均给予灌服等量蒸馏水,持续4周;ApoE+高脂+他汀组按2.5 mg/(kg·d)的比例灌服瑞舒伐他汀钙片溶液,持续4周;ApoE+高脂+消溶稳斑方低、中、高剂量组分别按照体质量60 kg成人剂量的5、10、20倍给药浓度,灌服消溶稳斑方溶液(消溶稳斑方浸膏加入蒸馏水溶解),持续4周。
1.4 取材与HE染色
腹腔注射水合氯醛进行麻醉,麻醉成功后剃毛、消毒,切开腹部皮肤及腹肌分离血管外脂肪组织,沿腹主动脉背部正中线剪开,取血5 ml留置2管,分离血清保存在-80 ℃低温冰箱备用。采用ELISA法检测IL-6、CRP、TNF-α的表达;手术剪开胸充分暴露内脏和胸部,止血钳钝性分离找到主动脉弓,取0.5 cm主动脉弓放到消毒皿,磷酸盐缓冲液(PBS)清洗干净,4%多聚甲醛固定2 d后取出主动脉弓组织脱水、透明、浸蜡包埋、石蜡包块切片、脱蜡处理、苏木精染色,透明与固定步骤对主动脉弓组织进行HE染色,光镜下观察主动脉弓形态。
1.5 p-AMPK、SIRT1水平测定
采用Western Blot 法测定小鼠主动脉弓组织蛋白中p-AMPK、Sirt1蛋白表达量。将主动脉弓组织取出,吸除培养基,采用 PBS(4 ℃)洗2遍,加入适量组织蛋白裂解液后提取总蛋白,BCA法检测蛋白浓度,行SDS-PAGE电泳分析,电泳(8 V/cm,进入分离胶后提至15 V/cm)后行蛋白质转膜,待转膜结束后将标记的PVDF 膜室温下放在封闭液中振摇封闭2 h。弃去封闭液,分别采用内参蛋白和目的蛋白一抗进行杂交,于4 ℃中反应过夜。取出PVDF膜TBST 漂洗10 min,重复3次。以1∶1000 稀释的HRP标记的山羊抗兔IgG作为二抗,室温振摇反应1 h。取出PVDF膜TBST漂洗,在滤纸上沥干液体,再将PVDF膜浸入发光液中室温孵育3 min进行曝光照相。
1.6 统计学方法
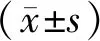
2 结果
2.1 光镜下观察各组小鼠主动脉弓粥样硬化斑块情况
图1示:C57+标准+水组:如箭头所示,主动脉弓三层结构及层次完整清晰,内皮细胞整体结构光滑完整,未见明显增生,中膜可见排列整齐的梭状平滑肌细胞,弹力纤维呈现环状结构,结构完整,由结缔组织构成的外膜结构疏松单薄,可见少量平滑肌细胞,管腔未见明显斑块;C57+高脂+水组:如箭头所示,主动脉弓结构形态紊乱,血管内皮连续性损害,内膜增厚,内膜下可见泡沫细胞及脂质沉积,弹力纤维环出现断裂,管腔内未见明显粥样斑块形成;ApoE+标准+水组:主动脉弓结构形态紊乱,血管内皮出现连续性损害,内膜增厚,内皮细胞损伤,炎性细胞聚集,泡沫细胞及脂质沉积于内膜下,弹力纤维环状结构破环,管腔内可见粥样斑块形成;ApoE+高脂+水组:如箭头所示,主动脉弓病变明显,血管内皮结构形态紊乱并连续性受损害,内膜增厚明显,可见平滑肌细胞增殖和迁移形成纤维帽,多处有粥样斑块形成,大量脂质斑块及泡沫细胞积聚,炎症细胞局部浸润,形成易损斑块,斑块向管腔内突起;ApoE+高脂+他汀组:如箭头所示,主动脉弓病变较ApoE+高脂+水组减轻,血管内膜中膜增厚,可见泡沫细胞以及脂质,动脉粥样斑块较ApoE+高脂+水组明显减小;ApoE+高脂+中药低剂量组:箭头所示,大部分小鼠主动脉弓血管内皮结构紊乱,内膜明显增厚,部分撕裂,血管壁相对完整,多处形成动脉粥样斑块,斑块内可见泡沫细胞、脂质沉积;ApoE+高脂+中药中剂量组:如箭头所示,主动脉弓病变较ApoE+高脂+水组减轻,内膜增厚明显,泡沫细胞及脂质沉积于内膜下;ApoE+高脂+中药高剂量组:如箭头所示,主动脉弓病变较ApoE+高脂+水组减轻,血管内膜增厚,结构紊乱,内膜下可见泡沫细胞、脂质沉积,动脉粥样斑块较ApoE+高脂+水组明显减小。本研究发现,各组主动脉血管壁呈动脉粥样硬化内皮损伤改变,其中经药物干预的消溶稳斑方低、中、高剂量组及他汀组病理改变较ApoE+高脂+水组减轻,而他汀组与消溶稳斑方组病理改变程度相当。
注:1.C57+标准+水组;2.C57+高脂+水组;3.Apoe+标准+水组;4.Apoe+高脂+水组;5.ApoE+高脂+他汀组;6.ApoE+高脂+中药低剂量组;7.ApoE+高脂+中药中剂量组;8.ApoE+高脂+中药高剂量组图1 各组小鼠主动脉弓粥样硬化斑块情况比较(40×)
2.2 各组小鼠主动脉弓p-AMPK、SIRT1蛋白水平
图2示,凝胶电泳后所得各组蛋白条带的灰度值,以灰度值的强弱来表示p- AMPK、SIRT1蛋白表达的相对强度。表1示,不同组别p-AMPK、SIRT1蛋白水平与C57+标准+水组比较,C57+高脂+水组p-AMPK、SIRT1水平均降低,差异有统计学意义(P<0.05)。与ApoE+高脂+水组比较,ApoE+高脂+他汀组、ApoE+高脂+中药低、中、高剂量组p-AMPK、SIRT1水平均升高(P<0.05)。与ApoE+高脂+他汀组比较,ApoE+高脂+中药低、中、高剂量组p-AMPK、SIRT1水平不同程度降低(P<0.05),差异有统计学意义。
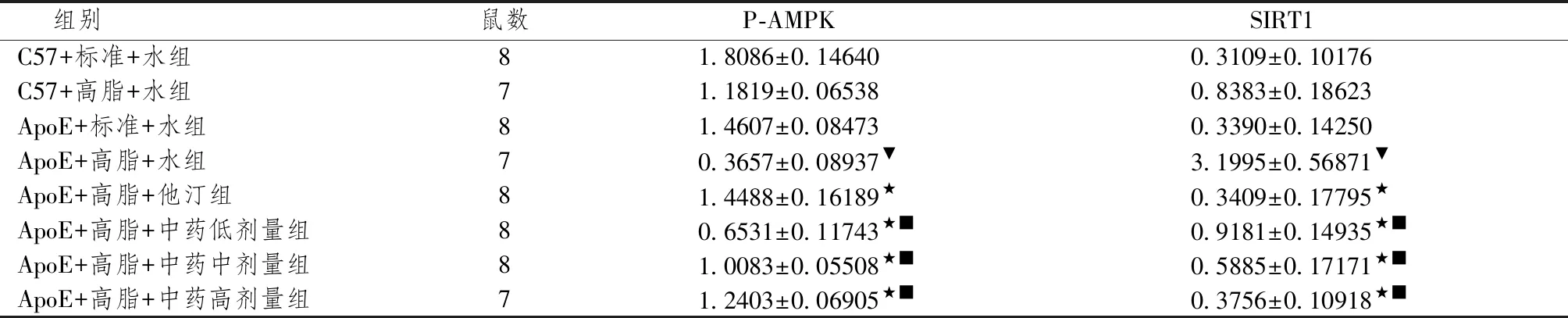
表1 不同组别小鼠主动脉弓p-AMPK、SIRT1水平比较
2.3 各组小鼠血清炎症因子TNF-α、IL-6、CRP水平
表2示,与C57+标准+水组比较,ApoE+高脂+水组TNF-ɑ、IL-6、CRP水平均升高(P<0.05);与ApoE+高脂+水组比较,ApoE+高脂+他汀组、ApoE+高脂+中药低、中、高剂量组TNF-ɑ、IL-6、CRP值均降低(P<0.05)。与ApoE+高脂+他汀组比较,ApoE+高脂+中药低、中剂量组TNF-ɑ、IL-6、CRP值均升高(P<0.05),差异有统计学意义。

注:1.C57+标准+水组;2.C57+高脂+水组;3.Apoe+标准+水组;4.Apoe+高脂+水组;5.ApoE+高脂+他汀组;6.ApoE+高脂+中药低剂量组;7.ApoE+高脂+中药中剂量组;8.ApoE+高脂+中药高剂量组图2 各组小鼠主动脉弓组织AMPK、p-AMPK、SIRT1蛋白条带比较

表2 各组小鼠血清CRP、TNF-ɑ、IL-6浓度值比较
3 讨论
动脉粥样硬化属于中医学“厥证”“中风”“眩晕”“头痛”“痴呆”“中风”“胸痹”等范畴[9]。本病病机总以本虚标实为主,本虚则尤以肝脾肾三脏亏虚为主,标实尤多见痰浊、血瘀、湿热蕴蒸等。中医主张从痰浊、血瘀论治本病。现代医学研究发现,中医痰浊证、血瘀证的证候积分分别与患者的低密度脂蛋白、胆固醇水平、全血黏度存在正相关关系,证实高脂血症与痰浊、血瘀的关系密切。结合多年临床诊疗经验,笔者认为张仲景所提“阳微阴弦”是对本病病机的最好概括。阳微阴弦所指不仅为寸口脉微尺中脉弦,于本病而言更多是指本虚标实、阳微乃本虚也,即脏腑亏虚为发病之本,阴弦为标实,即寒、痰、瘀互结为标。本病病在血脉而根于脏腑,故以“益气活血,化瘀通脉”为法自拟消溶稳斑方。
消溶稳斑方由黄芪、葛根、水蛭、地龙、佛手、郁金、半夏、甘松等药物组成。方中以黄芪、葛根为君药,有补益气血、通调血脉、活血通脉之功。张志鑫等[10]通过实验研究发现,黄芪含有的黄芪甲苷成分,具有调节脂质代谢、抗炎稳斑作用。具体机制与黄芪甲苷成分能够调控组织相关蛋白表达及炎症基因转录有关。呼海涛等[11]研究发现,中药成分葛根素具有抗动脉粥样硬化作用,其作用机制是葛根素调节血管内膜依赖性舒张因子,降低甘油三酯和低密度脂蛋白水平,实现对损伤的血管内皮细胞保护,同时还能抑制机体高脂状态引发的血管平滑肌细胞过度增生。万强等[12]研究证实,中药成分葛根素可通过降低人体内脏脂肪素水平,以实现对血脂水平的调控。此外,葛根素亦可通过上调炎症因子释放阈值,发挥抗炎稳斑作用。总之,中药葛根的化学成分复杂,其抗动脉粥样硬化作用并不单一,常常是通过多细胞、多靶点、多因素的共同作用,体现了中医药治疗本病的优势。方中以水蛭、地龙、郁金为臣,三药合用具有清热凉血散瘀之效,与君药益气活血通脉之功相辅相成。关于水蛭的最新研究发现[13],水蛭素与凝血酶具有极高的亲和性,极低剂量下就能够快速地将凝血酶中和,阻止纤维蛋白原的转换,具有强效抗凝作用。同时,水蛭素还可以抑制高凝态、高脂、长期慢性炎症等引发的血管平滑肌细胞增殖及巨噬细胞趋化,而发挥抗动脉粥样硬化的作用。方中以佛手、甘松为佐助君行气,其中甘松临床常用于胸痹心痛的治疗,具有良好的行气止痛之功。现代药理研究证实[14],甘松提取物中的多糖、总黄酮等成分参与调控机体的氧化酶活性,具有抗脂质过氧化的作用。方中半夏是恐气虚而有痰浊之邪留滞为患,取其祛痰下气之功。全方谨守益气活血、化瘀通脉之法,兼顾祛痰化浊,使阴阳气血平和、气血得补、痰瘀得化、血脉自通。
AMPK/SIRT1是调节机体能量代谢、维持内环境稳定的关键调节蛋白,AMPK是参与协调体内多种代谢过程的一种蛋白激酶,也被称作是细胞能量感受器[15]。AMPK的激活是使其磷酸化,p-AMPK通过促进巨噬细胞脂质外流、增加机体对氧化低密度脂蛋白(OX-LDL)的吸收,减少泡沫细胞形成,保护血管内皮,减少斑块形成,延缓动脉粥样硬化进程[16]。SIRT1通过去乙酰化作用抑制因子的转录,下调脂肪存储基因转录,增加脂肪代谢速度。研究发现,SIRT1可以改善胰岛素抵抗,减少活性氧生成,防御氧化应激和炎症反应。SIRT1通过去乙酰化使核因子(NF-KB)失活,抑制炎症基因转录[17]。另外,活化的AMPK通过激活去乙酰化酶,增加SIRT1表达。SIRT1可使核因子NF-KB去乙酰化而失活,提高机体炎症因子释放阈值,从而抑制炎症反应。
本研究发现,消溶稳斑方可使小鼠主动脉弓不稳定斑块内的AMPK蛋白被更多地激活,转变为磷酸化的AMPK,同时使SIRT1的表达增加,炎症因子TNF-α、CRP、IL-6水平降低。现代医学研究证实,AMPK磷酸化水平升高后会上调位于其下游的调控蛋白SIRT1表达,SIRT1蛋白表达增多可抑制转录因子NF-κB的去乙酰化反应,从而降低其活性,抑制炎症基因的转录,抑制TNF-α、CRP、IL-6等炎性因子的释放。经过本实验可以推断,消溶稳斑方可能是通过上调AMPK/SIRT1通路中AMPK磷酸化水平及SIRT1的表达,发挥其抑制斑块炎症反应,减少泡沫细胞及脂质沉积,保护血管内皮,稳定易损斑块,延缓动脉粥样硬化进展的作用。后续的研究拟在中药多靶点作用的基础上,进一步探讨消溶稳斑方抗动脉粥样硬化的相关通路或起效机制。
