内镜切除肠道息肉抗菌药物预防性应用分析
2020-03-13刘文影首都医科大学附属北京友谊医院药学部北京00050首都医科大学药学院临床药学系北京00069
张 超,刘文影,程 晟,沈 素(.首都医科大学附属北京友谊医院药学部,北京 00050;.首都医科大学药学院临床药学系,北京 00069)
消化内镜操作中因为黏膜或更深处组织的破损可能会使内源性细菌移位导致菌血症,从而造成局部组织或远处组织感染的风险[1]。不同操作方式的感染风险不同,但并不是所有的内镜操作都要预防使用抗菌药物[1-2]。随着内镜技术的发展和普及,《抗菌药物临床应用指导原则(2015年版)》[3]首次对内镜操作预防应用抗菌药物给出建议,提示应加强对消化内镜治疗围术期合理用药的关注。本文回顾性分析了我院消化内科内镜切除肠道息肉的患者预防性使用抗菌药物的情况,根据当前的指南和共识制定评价标准,对预防用药的合理性进行分析,以期为临床合理应用抗菌药物提供参考。
1 资料与方法
1.1 资料来源
利用医院病案阅读系统,检索我院2018年10月1日至12月31日所有因肠道息肉收住入院的患者信息,排除入院后未进行内镜下肠道息肉切除操作、病历资料不全的患者信息,共计纳入338例。
1.2 数据收集方法
设计数据收集的Excel表格,回顾性查阅病历资料,记录内容包括:患者姓名、病历号、性别、年龄、诊断;感染高危因素、内镜手术情况(切除息肉个数、切除息肉大小);抗菌药物过敏史、是否预防用药、给药时机、用药品种、用法用量、疗程;预防用药结果,感染治疗用药与疗程。
1.3 评价内容与指标
评价内容包括:预防用药指征及其分布、预防用药品种、给药剂量及时机、用药疗程与预防效果、预防用药的花费。参照国内外指南及共识[1-7]制定评价指标,针对肠道息肉内镜下切除治疗说明如下:1)预防用药指征:内镜切除肠道息肉,息肉较小者可采用热活检钳或普通活检钳摘除,息肉较大者可采用黏膜切除术(endoscopic mucosal resection,EMR)或黏膜下剥离术(endoscopic submucosal dissection,ESD)。肠道息肉内镜切除的菌血症风险较低,通常不推荐使用抗菌药物。存在以下感染高危因素时,可考虑使用抗菌药物:①切除范围大(大于2 cm);②操作时间长(大于120 min);③消化道穿孔高危者(肠道侧向发育型肿瘤、肿瘤较大、复杂EMR和ESD、使用热活检钳等);④肠道准备差;⑤其他感染高危因素:高龄(>70岁)、伴有糖尿病、免疫功能低下(器官移植、粒细胞缺乏)、肝硬化、营养不良等。有≥1个感染高危因素的患者符合围手术期预防使用抗菌药物的选用条件。无感染高危因素的患者若用药则判定为不合理用药。2)预防用药疗程:肠道内镜下息肉切除术属于清洁-污染手术,预防用药时间为24 h。而《中国早期结直肠癌筛查及内镜诊治指南(2014,北京)》[4]推荐,预防用药时长不应超过72 h,作为本次点评的合理疗程上限。3)预防用药效果:参考病历中临床医师诊断,关注患者在内镜操作术后是否出现肠道感染。实际点评时关注病历记录的患者体温、腹部体征、血象、CRP等指标变化。
1.4 统计学方法
采用SPSS19.0对数据进行统计学分析,计量资料以(均数±标准差)表示,计数资料以率(%)表示,率的比较采用χ2检验,以P< 0.05为差异有统计学意义。
2 结果
2.1 性别与年龄分布
本研究纳入的患者共计338例,其中男性患者218例(65%),女性患者120例(35%)。最小年龄为15岁,最大年龄为88岁。年龄分布以中老年为主,中位数为60岁,患者平均年龄为(60±10.31)岁。其中高龄(年龄≥70周岁)患者共计48例(14.2%)。
2.2 息肉类型分布情况
338例患者的息肉类型分为结肠多发良性肿瘤(159例,47%)、结肠良性肿瘤(99例,29%)、结肠多发息肉(23例,7%)、结肠早癌(21例,6%)、结肠息肉(12例,4%),由于结肠印戒细胞癌、结肠中分化腺癌、结肠侧向发育型肿瘤等疾病例数较少,归为其他项(共计24例,7%)。
2.3 预防用药指征分布与是否用药
本次调查的病例中,预防用药指征即感染高危因素共有6个,分别是高龄(≥70周岁)、糖尿病、肠道息肉大(直径≥2 cm)、肠道准备差、肠道侧向发育型肿瘤(laterally spreading tumor,LST)及手术时间长(≥120 min)。预防用抗菌药物的指征分布情况见表1。由于某些患者的感染高危因素大于1个,故感染高危因素统计数之和大于所调查的患者例数。
338例患者中有用药指征的共计127例(37.6%),无用药指征211例(62.4%)。有用药指征的患者中,预防用药的例数为55例(43.3%);未预防用药的例数为72例(56.7%)。无用药指征的患者中,预防用药29例(13.7%);未预防用药182例(86.3%)。通过比较有用药指征的患者用药与否的感染高危因素差异,分析医生实际参考的预防用药指征。结果显示,肠道息肉大这一感染高危因素有显著性差异(P< 0.001),即该因素对医生决定是否预防用药有影响。肠道LST也是影响医生决定预防用药的因素(P= 0.003)。其他各个因素均P> 0.05,无显著性差异。

表1 预防用药指征的分布情况Tab 1 Distribution of indications for antibiotic prophylaxis
2.4 预防用药品种
预防性使用抗菌药物的患者共计84例,其中有用药指征55例,无用药指征29例。不同品种的抗菌药物选用例次及构成比详见表2。用药例次之和大于患者例数是由于有3名患者在预防性用药过程中存在换药。有2名患者不除外术后穿孔,选用注射用亚胺培南西司他丁钠为预防用抗菌药物。
在所有预防性使用抗菌药物的患者中,有2例患者存在头孢类抗菌药物过敏史,其选用的抗菌药物为硫酸依替米星注射液;有8例患者存在青霉素过敏史,其选用的抗菌药物为硫酸依替米星注射液(6例)、盐酸莫西沙星氯化钠注射液(1例)及注射用头孢呋辛钠(1例)。
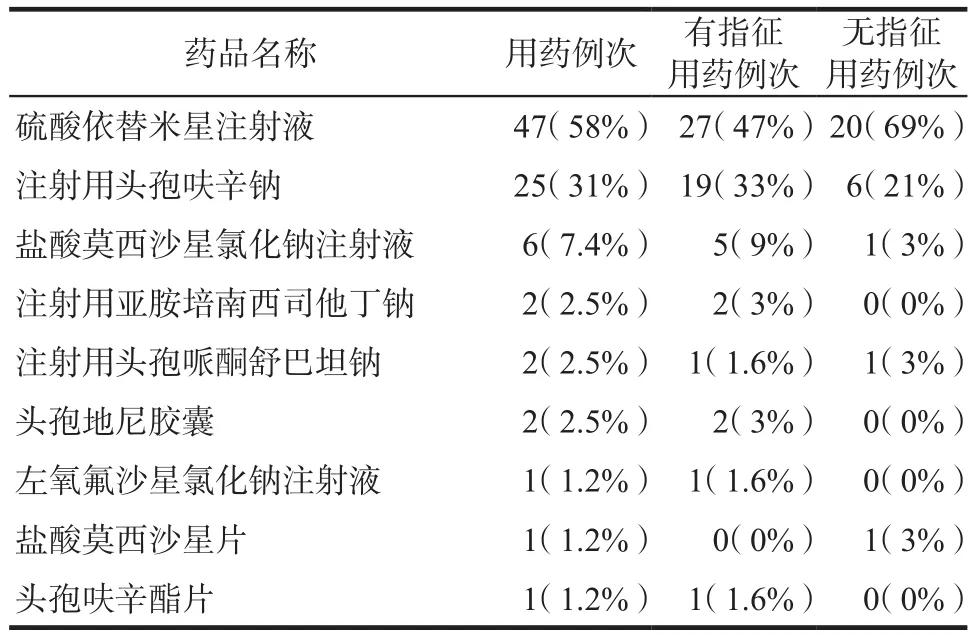
表2 预防用药品种及构成比Tab 2 Variety and proportion of antibiotic prophylaxis
2.5 给药时机、给药剂量与每日药费
本研究结果显示全部预防用药的给药时机均在手术后给药,给药剂量及每日药费情况详见表3。
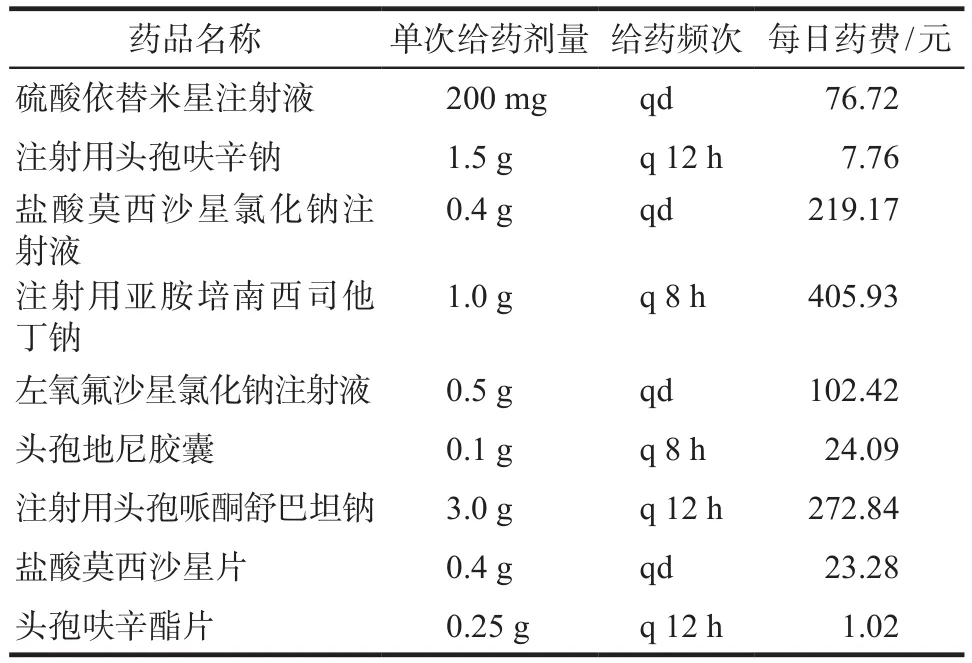
表3 预防用药剂量与每日药费Tab 3 Dosage and daily cost of antibiotic prophylaxis
2.6 预防用药疗程与术后感染治疗情况
338例患者的用药疗程最短为1 d,最长为11 d,平均用药疗程为(3.21±1.94)d。未出现感染指标升高的患者预防用药疗程为(2.96±1.55)d,预防用药疗程> 3 d的患者共计20例(23.8%)。
7例患者在内镜操作之后因感染指标升高进行治疗,占调查患者总数的2.07%。7例患者均有白细胞计数的升高,最高值为20.45×109·mL-1;5例患者合并有CRP水平升高;有2例患者出现体温一过性升高。7例患者均无腹痛、腹泻的症状。治疗感染的药物为盐酸莫西沙星氯化钠注射液(3例)、注射用亚胺培南西司他丁钠(2例)、注射用头孢哌酮舒巴坦钠(1例)、硫酸依替米星注射液(1例)。出现感染指标升高的患者预防和治疗使用抗菌药物的平均用药疗程为(6.14±2.90)d,治疗感染的疗程为(3.40±1.56)d。
3 讨论
从调查的结果来看,我院消化内镜切除肠道息肉预防用抗菌药物的有效性较好,所调查的住院患者有7例因感染指标升高进行治疗,构成比为2.07%。但在用药指征判定、品种选择、给药时机及用药疗程上存在不合理之处,仍需改进。
3.1 预防用药指征
有29例患者没有感染高危因素但预防性使用了抗菌药物,表明临床对预防用药指征把控不严,预防用药存在过度使用的情况。通过分析文献中的用药指征发现,较小的肠道息肉采用热活检钳或普通活检钳摘除等内镜切除术时,菌血症风险较低,2009年英国消化病学会(BSG)[2]和2015年美国消化内镜学会(ASGE)[1]发布的指南中,均不推荐常规预防使用抗菌药物。肠道息肉较大,采用EMR或ESD时,在之后2015年日本消化内镜学会[5]、2017年欧洲消化内镜学会[6]和2018年美国消化内镜学会[7]发布的指南中均无预防使用抗菌药物的相关推荐。此新型内镜技术的研究较少,但根据目前已有的文献报道[8]显示,肠道肿瘤ESD或EMR术后菌血症风险较低,其所调查的40例内镜治疗患者中仅1例(2.5%)血培养结果为阳性,因此并不推荐预防使用抗菌药物。《中国早期结直肠癌筛查及内镜诊治指南(2014,北京)》[4]及《抗菌药物临床应用指导原则(2015 年版)》[3]也不推荐常规预防用药。综上可知,内镜切除肠道息肉的感染风险低,应提示医生常规不需要预防用抗菌药物,避免过度用药。本次调查发现6个感染高危因素为预防用药指征,以高龄及糖尿病为主(各占37.8%)。而进一步分析发现,肠道息肉大(直径≥2 cm)及肠道侧向发育型肿瘤(穿孔风险高)为医师主要参考的用药指征。这提示我们应关注大面积切除、穿孔风险高的EMR和ESD操作,通过相关研究进展,明确这些情况是否为感染高风险操作以及预防用药的获益。
3.2 预防用药品种
本次调查中预防性应用的抗菌药物共计9种,其中硫酸依替米星注射液用药47例次,占用药总例次的58%,指导原则[3]推荐的头孢呋辛使用次数为25次(占总例次的31%)。硫酸依替米星属于氨基糖苷类抗菌药物,切除肠道息肉时应在患者对头孢菌素过敏的情况下考虑使用,除去有头孢过敏史的2例患者,依替米星的使用量仍为最多,表明预防用药选用品种不合理。也有病例预防用药选用莫西沙星(7例)和左氧氟沙星(2例),由于肠道息肉切除后可能污染的主要细菌大肠埃希菌对氟喹诺酮类药物耐药率高,应严格限制此类药物预防性应用[3]。
本次调查共有7例患者对青霉素过敏,1例预防用药选用头孢呋辛钠,其余有6例未进行头孢皮试选用了依替米星,1例选用莫西沙星。临床药师与管床医生交流后发现,多数医生对青霉素过敏史的问诊并不详细,没有明确区分患者对青霉素仅为皮试阳性还是用药后出现过敏反应。对于仅有青霉素皮试阳性史的患者,应优先选用头孢呋辛作为预防用药。
从预防用药的日均花费看,注射用头孢呋辛钠明显低于其他种类的抗菌药物,且此药预防用药的循证证据充足。石秀锦等[9]研究提示可以通过优化选药品种达到控制预防用药费用的目的。本次调查中,若将除β-内酰胺过敏患者的预防用药品种全部替换为注射用头孢呋辛钠,共可节省21 545.68元人民币,在促进合理用药的同时,也可降低患者的医疗费用。
3.3 给药时机、用法用量与疗程
本次调查的预防用药均在术后给药,这种不规范用药造成切口组织暴露时药物无法达到有效杀菌浓度,从而可能导致预防用药失败。预防用药的给药方式以静脉输注为主,用量为常规预防用剂量,疗程为(2.96±1.55)d,普遍长于24 h。有个别患者静脉用药后序贯口服治疗,这种不规范的预防用药也导致疗程过长。20例(23.8%)患者预防用药疗程大于72 h,超过目前所有指南推荐的上限。长疗程用药会导致医院感染风险增加以及导致耐药菌的产生,同时也会加重患者的经济负担。因此,应在规范术前给药的同时,严格控制用药疗程。
3.4 术后感染的判定标准
7例患者在内镜操作之后出现感染指标升高,多为白细胞计数和CRP升高,2例患者出现体温一过性升高,均未出现腹痛、腹泻等症状。研究[10-11]报道,内镜下肠道息肉切除预防用药与未用药的两组患者在白细胞计数、发热、腹泻、大便异常等方面比较,差异均无统计学意义;白细胞升高者未进行干预,3 d内可恢复正常[11]。因此,内镜切除术后白细胞或CRP升高、体温一过性升高,可能是机体的应激反应。本研究发现7例术后白细胞升高的患者均按感染处理,更换高强度抗菌药物治疗,此方案欠妥。
综上,本研究结果显示我院内镜切除肠道息肉预防性使用抗菌药物仍存在诸多不合理之处,建议临床应重点关注,避免无指征用药,如需用药应首选一线预防用药物,内镜操作前给药,需严格控制预防用药疗程。刘小华等[12]对江苏省人民医院消化内镜预防用抗菌药物进行干预,干预后抗菌药物的使用强度下降,一、二代头孢使用例数上升,术前给药比例上升,用药疗程缩短。临床药师可加强对这一领域的关注,参考最新的指南并结合患者实际情况,进一步促进临床合理使用抗菌药物,遏制细菌耐药,减少患者花费和节约医保费用。
