内镜黏膜下剥离术在十二指肠隆起性病变中的 临床应用
2020-03-12邱吉陈飞
邱吉,陈飞
(浙江省诸暨市人民医院 消化内科,浙江 诸暨 311800)
近来年,内镜黏膜下剥离术(endoscopic submuco- sal dissection,ESD)逐渐发展成熟,它可以实现完整切除消化道早期癌及癌前病变,且并发症发生率和肿瘤复发率均较低,目前已成为部分消化道早期肿瘤的首选治疗方法。但ESD 治疗十二指肠隆起性病变的报道尚少,一方面是因为十二指肠隆起性病变的发病率低,另一方面则是由于十二指肠本身的解剖特点,内镜治疗风险较大,出血和穿孔的发生率较高[1]。笔者总结本院用ESD 治疗的21例十二指肠隆起性病变的临床资料,探讨ESD 治疗十二指肠隆起性病变的临床价值。
1 资料与方法
1.1 一般资料
回顾性分析2015年9月-2017年11月诸暨市人民医院收治的21例十二指肠隆起性病变行ESD 治疗的患者资料,并排除十二指肠乳头病变患者。其中,男13例,女8例,年龄30 ~62岁,平均(47.6±9.5)岁;15例有上腹隐痛、腹胀和嗳气等症状,6例无明显症状。十二指肠球部14例(66.7%),降部7例(33.3%);病灶直径1.5 ~4.0cm,平均(2.4± 0.6)cm。
1.2 仪器与设备
采用Olympus GIF—XQ 260J 胃镜,超声内镜(Fujinon SU-8000),Olympus NM·200U-0423 注射针,Fujinon Optical DK2618JN15 Flush 刀,Olympus 5XK 热活检钳,Olympus HX-610-090L 钛夹及释放器,APC 300 氩离子凝固器,ERBE200D 电刀工作站,CO2 泵,透明帽等。
1.3 方法
1.3.1 ESD 手术 ①术前评估:对于黏膜层来源的病变,术前放大内镜了解微血管和微腺管开口类型,超声内镜明确病变侵犯层次;对于黏膜下层来源的病变,超声内镜明确病变来源层次;②标记:应用Flush 刀于病灶边缘0.5 ~1.0cm 进行电凝标记;③黏膜下注射:采用含靛胭脂、透明质酸钠和肾上腺素的生理盐水进行黏膜下注射,自肛侧向口侧,可以重复注射直至病灶明显抬起,若黏膜层病变侵犯到黏膜下层,则注射生理盐水后不会明显抬起;④切开病变外侧缘黏膜:应用Flush 刀沿病灶边缘标记点切开十二指肠黏膜,自肛侧向口侧切开,并随时注射少量黏膜下注射液充分抬举病灶;⑤剥离病变:应用Flush 刀于病灶下方对黏膜下层进行剥离,剥离中反复黏膜下注射,始终保持剥离层次在黏膜下层,剥离中通过拉镜或旋镜沿病变基底切线方向进行剥离,并随时调节胃镜旋转按钮,使镜身平稳固定在切缘,利于操作;同时在剥离过程中,利用前端透明帽顶开黏膜层,暴露出黏膜下层;对于黏膜下层或固有肌层来源的病变,需沿肿瘤边缘进行仔细解剖,完整切除病灶;⑥创面处理:切除病灶后,对于创面可见的小血管应用氩离子血浆凝固术(argon plasma coagulation,APC)凝固治疗或热活检钳处理,术后应用金属钛夹或尼龙绳缝合创面。切除病变送病理检查。十二指肠占位性病变ESD 操作步骤见 图1。
1.3.2 术后处理和随访 术后常规禁食24 ~72 h,予以抑酸、止血、抗感染和补液等治疗,如有穿孔则胃肠减压,观察有无迟发性出血、穿孔和腹腔感染等。排气后开始进食,对于术中有穿孔且行内镜下金属夹缝合的患者可适当延长禁食的时间。术后3、6 和12个月定期内镜检查;以后根据创面愈合情况及术后病理结果每年1 次进行胃镜复查。

图1 十二指肠占位性病变ESD 操作步骤Fig.1 Operational procedures of endoscopic submucosal dissection for duodenal space-occupying lesions
2 结果
2.1 术后病理
21例患者中,病变来源于黏膜层者5例(23.8%),术后病理为管状腺瘤伴高级别上皮内瘤变4例(19.0%),绒毛状-管状腺瘤1例(4.8%);来源于黏膜下层者16例,其中Brunner 腺瘤9例(42.8%),异位胰腺4例(19.0%),类癌1例(4.8%),平滑肌瘤1例(4.8%),脂肪瘤1例(4.8%)。
2.2 并发症
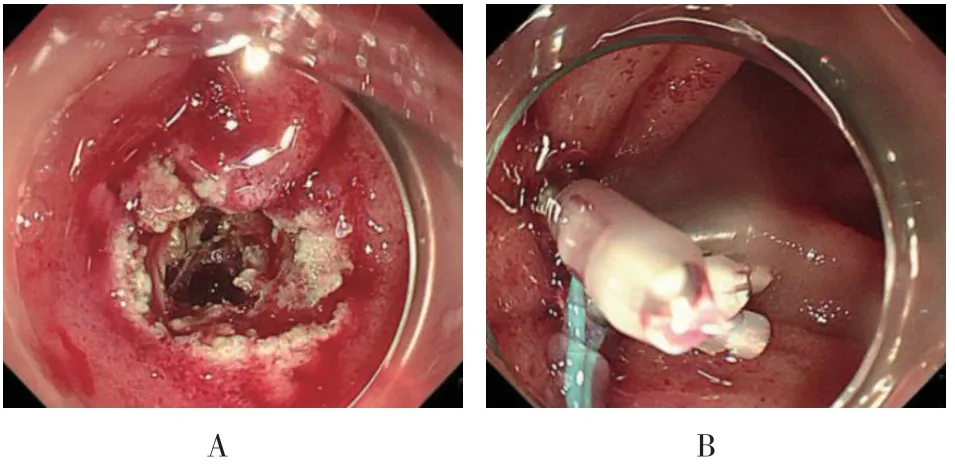
图2 十二指肠ESD 术中穿孔Fig.2 Perforation in duodenal endoscopic submucosal dissection during operation
21例患者均顺利完成ESD 手术,围手术期并发症发生率为9.5%(2/21)。其中,术中穿孔1例(4.8%),其病灶与固有肌层关系密切,ESD 剥离困难,术中发生穿孔,在镜下给予钛夹及尼龙绳夹闭和术后禁食等保守治疗后好转,无迟发性穿孔和追加手术;术中出血1例(4.8%),因其病灶较大,操作空间受限,手术过程中出血约100 ml,通过氩气刀电凝和金属夹夹闭等方法止血后顺利完成操作,术后无感染及狭窄等并发症发生。见图2 和3。
2.3 术后随访
21例患者术后平均住院(6.5±2.3)d,术后中位随访时间3.9 ~24.7 个月,平均14 个月,随访期间无复发、狭窄和肠粘连等情况发生。

图3 十二指肠ESD 术中出血Fig.3 Bleeding in duodenal endoscopic submucosal dissection during operation
3 讨论
原发性十二指肠隆起性病变发病率低,良性病变主要包括息肉、囊肿、异位胰腺、Brunner 腺瘤、间质瘤、脂肪瘤和类癌等,患者通常没有明显临床症状和体征,多在体检时偶然发现[2-3]。朱宏等[4]报道了201例患者行常规胃镜发现的210 个十二指肠隆起性病灶,其中囊性病变68 个,息肉35 个,异位胰腺26 个,胃肠间质瘤25 个,脂肪瘤12 个,恶性肿瘤10 个,副乳头10 个,Brunner 腺瘤8 个,黏膜炎性增生1 个,血管瘤1 个。
十二指肠Burnner 腺瘤一般位于十二指肠近段,以十二指肠球部最多。国内外绝大多数文献都认为十二指肠Burnner 腺瘤属于良性病变,恶变可能性极小,如无明显临床症状,一般无需治疗或仅需内科保守治疗[5],对于巨大的病灶,由于会引起出血、阻塞等症状,则需要尽早治疗。随着内镜技术的不断发展,由于十二指肠Burnner 腺瘤起源于黏膜下层的生长特性,对于病灶小、无症状的患者,选择内镜下手术切除治疗往往是一种更好的选择[6]
因十二指肠隆起性病变具有恶变性,手术切除仍然是其标准的治疗方法。但保留器官的局部切除术仍有很高的复发率[7-8]。胰十二指肠切除术虽然是一种非常有效地治疗方法,但患者围手术期并发症死亡率高达30%~40%,且术后并发症长期存在,严重影响患者的生活质量[8-9]。近年来,随着超声内镜和内镜下切除技术的发展,ESD 因具有更小的侵入性、更短的住院时间和更少的花费,成为治疗十二指肠隆起性病变更为安全有效的选择[10]。
由于十二指肠的解剖位置较为特殊,连接胃和空肠紧贴腹后壁,位置相对固定且血供丰富,管壁较薄,内镜操作空间相对狭小,术中及术后容易出现穿孔和出血等并发症,增加了内镜治疗的难度和风险。因此,十二指肠隆起性病变的ESD 治疗需要经验丰富的内镜医生才能完成。
出血和穿孔是十二指肠ESD 手术最常见的并发症,也是导致ESD 手术失败的主要原因。在本研究中,有1例患者出现了术中穿孔,主要是由于十二指肠壁较薄、肠腔狭窄、肠管弯曲、操作空间小,而且十二指肠黏膜下层有丰富的Brunner's 腺体,局部黏膜下注射不易实现黏膜层的充分隆起,与胃肠道的其他部位相比,黏膜隆起的持续时间也相对较短。这些因素降低了手术的可操作性,使操作难度变大。为了预防穿孔的发生,充分的黏膜隆起是ESD 术中及术后防止穿孔的关键因素之一。有研究[11]报道,透明质酸在黏膜下可较长时间保留,与其他溶液相比,ESD 操作视野更清晰,便于剥离,且对组织损伤小、安全性高,有利于ESD 操作,是最佳的黏膜下注射液。故本组病例的黏膜下注射液均采用透明质酸钠并封闭创面。同时,十二指肠ESD 术后封闭创面,能够明显降低术后出血和延迟性穿孔的风险[12],可用金属夹夹闭创面,或者使用金属钛夹和尼龙绳套扎行“荷包缝合”。本组1例术中穿孔的患者均使用了金属钛夹和尼龙绳套扎封闭创面。
十二指肠另一常见并发症是术中及术后出血。由于十二指肠黏膜下层有丰富的血管,而且ESD 术后形成的人工溃疡容易受到十二指肠内容物(主要是胆汁和胰液)的刺激,所以容易发生术中及术后出血。在本组病例中有1例患者出现了术中出血,但经过氩气刀电凝和金属夹夹闭均顺利止血。为了减少术中及术后出血的发生,在十二指肠ESD 术中,对剥离过程中发现的裸露血管要立即在最低水平上给予电凝,以进行预防性止血,且要注意避免过量电凝引起十二指肠薄壁损伤而导致延迟性穿孔。另外,对ESD 术后形成的人工溃疡进行封闭处理,也能减少术后出血的发生。
对于十二指肠占位性病变ESD 术后的复发情况,HOTEYA 等[10]报道了38例成功完成十二指肠ESD 术后的早期腺癌/腺瘤患者,中位随访时间48(3.2 ~94.1)个月,没有发现局部复发或者远处转移,患者无病存活率是100%。本组病例术后中位随访时间是14(3.9 ~24.7)个月,随访期间也未出现复发及狭窄、肠粘连等情况,与上述文献[10]报道相似。
综上所述,因十二指肠隆起性病变位置特殊,手术操作难度大、时间长、相关并发症发生率较高,但能实现病变的完整切除,且创伤小、住院时间短,术后恢复快。因此,只要术前充分掌握适应证,技术应用得当,十二指肠ESD 治疗十二指肠隆起性病变是安全有效的。
